检测猪腹泻病原体并分型的组合物、试剂盒、方法及其用途与流程
1.本发明属于分子生物学检测领域;具体地,涉及猪腹泻病原体的检测;更具体地,涉及猪霍乱沙门氏菌(sc)、胞内劳森菌(li)、猪痢疾短螺旋体(bh)、致病性大肠杆菌(etec)、产气荚膜梭菌(cp)、艰难梭菌(cd)的检测。
背景技术:
2.新生仔猪的腹泻发病率很高,是一种常见且很难防控的疾病,80%~90%的母猪场都会存在新生仔猪腹泻问题,而且以后备母猪群出现产后仔猪腹泻为主,仔猪发病率超过50%;经产母猪群的仔猪发病率在30%~35%。猪场发生腹泻的影响因素有很多,比如病毒性感染、细菌行感染和寄生虫感染。其中,病毒性感染就是生猪感染某些致病病毒所造成的猪腹泻病症,包括传染性肠胃炎病毒、流行性腹泻病毒、轮状病毒、猪伪狂犬病病毒、猪瘟病毒、腺病毒以及疱疹病毒等。细菌性感染同样也是生猪受到外来病菌的入侵所产生的腹泻症状,包括大肠杆菌、沙门氏菌、魏氏梭菌、猪痢疾杆菌、艰难梭菌、内劳森氏菌以及短螺旋体等病菌的感染,均会有引发猪腹泻的可能。寄生虫感染,并不是所有的寄生虫都会引发猪腹泻,一般来说,只有引发肠道感染的寄生虫才会造成猪腹泻,比如烟虫、鞭虫、球虫、蛔虫以及结肠小袋纤毛虫等寄生虫。通过改善猪饲养环境和提高猪饲料配比与管理的科学性,能够有效降低寄生虫对猪造成的感染现象。
3.目前来说,腹泻的病发主要关注于病毒性的感染,对于细菌性的感染则缺乏监控,这主要在于养殖过程中抗生素的大量使用是其主要的治疗与预防方式,随着国家推行的减抗、禁抗政策,以及精准用抗,本领域需求一种产品能够检测并区分不同细菌的感染,以便能够给予针对性的治疗,同时成本低,灵敏度高。
技术实现要素:
4.有鉴于此,第一方面,本发明提供一种用于检测猪腹泻病原体并分型的组合物,所述组合物包括:
5.第一核酸组合物:
6.如seq id no:1所示的猪霍乱沙门氏菌上游引物、如seq id no:2所示的猪霍乱沙门氏菌下游引物,和如seq id no:3所示的猪霍乱沙门氏菌探针;
7.如seq id no:4所示的胞内劳森菌上游引物、如seq id no:5所示的胞内劳森菌下游引物,和如seq id no:6所示的胞内劳森菌探针;和
8.如seq id no:7所示的猪痢疾短螺旋体上游引物、如seq id no:8所示的猪痢疾短螺旋体下游引物,和如seq id no:9所示的猪痢疾短螺旋体探针。
9.进一步地,所述组合物还包括:
10.第二核酸组合物:
11.如seq id no:10所示的致病性大肠杆菌上游引物,和如seq id no:11所示的致病性大肠杆菌下游引物;
12.如seq id no:12所示的产气荚膜梭菌上游引物,和如seq id no:13所示的产气荚膜梭菌下游引物;和
13.如seq id no:14所示的艰难梭菌上游引物,和如seq id no:15所示的艰难梭菌下游引物。
14.本发明提供的检测猪腹泻病原体并分型的组合物,主要利用多重荧光pcr和熔解曲线分析方法,对猪霍乱沙门氏菌(sc)、胞内劳森菌(li)、猪痢疾短螺旋体(bh)、致病性大肠杆菌(etec)、产气荚膜梭菌(cp)、艰难梭菌(cd)多种病原体以及内标,在一管内进行检测,使得不同病原体能够得到区别对待,从而使得治疗和预防更有效。本发明的组合物,结合荧光探针熔解曲线法,其成本低,通量高。并且操作简便,结果读取过程通过ct值和熔解峰tm值即可以判定。
15.在一些实施方案中,本发明的组合物可以同时包括上述引物和探针中的一对或多对。在本发明中,“对”是指检测一个突变的互相匹配的上游、下游引物和探针。
16.举例来说,可以只包括第一核酸组合物;可以只包括第二核酸组合物。
17.举例来说,还可以只包括不同核酸组合物的一些引物和探针对,例如第一核酸组合物中的一对或多对,以及第二核酸组合物中的一对或多对。
18.进一步地,第一核酸组合物和第二核酸组合物均还可以包括用于检测内标的引物和/或探针。
19.在一个具体的实施方案中,第一核酸组合物进一步包括:如seq id no:16所示的内标上游引物、如seq id no:17所示的内标下游引物,和如seq id no:18所示的内标探针。
20.进一步地,第一和第二核酸组合物每组之内的探针的荧光基团彼此互不相同且互不干扰。
21.在本文中,“互不相同且互不干扰”是指组合物中每个探针所用的荧光基团是不一样的,并且不会影响彼此的检测,即可以利用不同的通道进行检测。例如可以使用fam、hex、rox和cy5,这些基团吸光值不接近,能选择不同的通道,因而不会互相干扰。
22.在一些具体的实施方案中,本发明组合物用于荧光pcr。
23.在本发明中,荧光报告基团可以选自fam、hex、rox、vic、cy5、5-tamra、tet、cy3和joe,但不限于此。
24.进一步地,探针的3’末端还具有淬灭基团,例如bhq1或bhq2或mgb。
25.在一个具体的实施方案中,探针的3’末端为bhq1。
26.在一个具体的实施方案中,探针的3’末端为mgb。
27.进一步地,所述组合物中引物的用量为0.02μm~0.25μm;所述组合物中探针的用量为0.02μm~0.25μm。
28.在一个具体的实施方案中,本发明的组合物的各核酸组合物分别存在于单独包装中。
29.在一个具体的实施方案中,本发明的组合物的各核酸组合物存在于同一个包装中。
30.进一步地,本发明的组合物的每一核酸组合物中的各成分以混合的形式存在。
31.第二方面,本发明提供了上述本发明的组合物在制备检测猪腹泻病原体并分型的试剂盒中的用途。
32.第三方面,本发明提供了一种检测猪腹泻病原体并分型的试剂盒,所述试剂盒包括如上所述本发明的组合物。
33.进一步地,所述试剂盒还包括阴性质控品和阳性质控品。
34.进一步地,所述试剂盒还包括dntp、pcr缓冲液以及mg
2+
中的至少一种。
35.更进一步地,所述试剂盒还包括:核酸释放剂、核酸提取试剂、尿嘧啶糖基化酶以及dna聚合酶中的至少一种。
36.更进一步地,所述试剂盒还包括核酸释放试剂、核酸提取试剂、dntp、尿嘧啶糖基化酶、dna聚合酶、pcr缓冲液以及mg
2+
中的至少一种。
37.进一步地,所述dna聚合酶的浓度为3u/反应~15u/反应,例如dna聚合酶可以是taq酶。
38.在一个具体的实施方案中,本发明试剂盒包括:taq酶、尿嘧啶糖基化酶、mg
2+
、mn
2+
、rnasin、dntp、引物、探针和pcr缓冲液。
39.常见的pcr缓冲液由tris-hcl、mgcl2、kcl、triton x-100等缓冲体系构成。一般单个pcr反应管中总体积为20μl~100μl。
40.在一个具体的实施方案中,本发明试剂盒可以兼容数字pcr扩增体系,即可以直接用于数字pcr仪上进行扩增。
41.第四方面,提供了一种用于检测猪腹泻病原体并分型的方法,所述方法包括以下步骤:
42.1)提取或释放待测样本的核酸;
43.2)使用如上所述本发明的组合物或上述本发明的试剂盒对步骤1)获得的核酸进行荧光定量pcr分析;
44.3)获得并分析结果。
45.在本发明中,用于检测的样本可以是猪血清、血浆、肠道,肠内容物、肠系膜淋巴结、排泄物等,但不限于此。
46.进一步地,所述荧光定量pcr的反应条件为:
47.ung酶反应,温度为50℃~60℃,时间1~5分钟,1次循环;taq酶活化,温度为95℃,时间1~10分钟,1次循环;变性,温度为93℃,时间为5~20秒,退火,温度为55℃~60℃,更优选60℃,时间为20~60秒,更优选25s,40~50次循环,熔解曲线分析,62℃~75℃,一次循环。
48.在一个具体的实施方案中,提供了一种用于以非诊断目的检测猪腹泻病原体并分型的方法,所述方法包括以下步骤:
49.1)提取或释放待测样本的核酸;
50.2)使用如上述本发明的组合物或上述本发明的试剂盒对步骤1)获得的核酸进行荧光定量pcr分析;
51.3)获得并分析结果。
52.进一步地,所述荧光定量pcr的反应条件为:
53.ung酶反应,温度为50℃~60℃,时间1~5分钟,1次循环;taq酶活化,温度为95℃,时间1~10分钟,1次循环;变性,温度为93℃,时间为5~20秒,退火,温度为55℃~60℃,更优选60℃,时间为20~60秒,更优选25s,40~50次循环,熔解曲线分析,62℃~75℃,一次循
环。
54.在本文中,术语“非诊断目的”指并非旨在获得个体是否感染猪腹泻相关病原体并罹患腹泻的信息。例如,该方法可以在以科研为目的的实验中的检测培养物中检测是否有猪腹泻相关病原体并分型。
附图说明
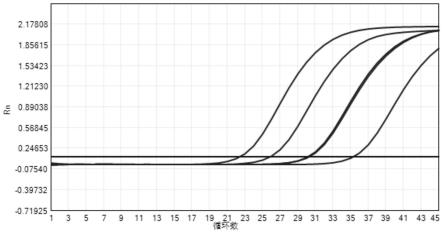
55.图1~7为本发明组合物检测各靶标的检测结果(分别为猪霍乱沙门氏菌(sc)、胞内劳森菌(li)、猪痢疾短螺旋体(bh)、致病性大肠杆菌(etec)、产气荚膜梭菌(cp)、艰难梭菌(cd)和内标);
56.图8~10为本发明组合物部分灵敏度检测结果(分别为猪霍乱沙门氏菌(sc)、胞内劳森菌(li)和致病性大肠杆菌(etec));
57.图11~12为本发明组合物部分特异性检测结果(猪霍乱沙门氏菌(sc)和艰难梭菌(cd));
58.图13~15为本发明对比例组合物检测结果图。
具体实施方式
59.下文将结合具体实施方案和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方案和实施例是用于说明本发明,而非限制本发明。
60.实施例1、本发明所使用的引物及探针
61.表1
62.名称序列编号sc-f5'-tcaactccgctatcaccaacct-3'seq.id no:1sc-r5'-cggtcgcgtagtcggaat-3'seq.id no:2sc-p5'-tgtcttctgcccgtagccgtatcga-3'seq.id no:3li-f5'-ccgtgaggtgttgggttaagtc-3'seq.id no:4li-r5'-tctagagtgcccaactttacttgatg-3'seq.id no:5li-p5'-cgcaacgagcgcaacccttatctttag-3'seq.id no:6bh-f5'-ggaatgtgggagagattgatcaa-3'seq.id no:7bh-r5'-tcggcagatctttggtataaatga-3'seq.id no:8bh-p5'-atcttcctccatgccatatgatgtgcca-3'seq.id no:9etec-f5'-ttctggcgcaccatctaagg-3'seq.id no:10etec-r5'-taagccgctcgcgtaattgt-3'seq.id no:11cp-f5'-gcagaggaaagaaaagaacagta-3'seq.id no:12cp-r5'-acctcttgcatattcttttgacc-3'seq.id no:13cd-f5'-gcagtagggccaacaaaaggt-3'seq.id no:14cd-r5'-tgttacagaacacttgaaagtcatcca-3'seq.id no:15ic-f5'-caaagaccgttgtgtccagaag-3'seq.id no:16ic-r5'-ggcggtggcgcaaa-3'seq.id no:17
ic-p5'-caacgtcctgtcacctcctcctatg-3'seq.id no:18
63.其中,猪霍乱沙门氏菌(sc)的荧光报告基团为fam;内标的荧光报告基团为hex;胞内劳森菌(li)的荧光报告基团为rox;猪痢疾短螺旋体(bh)的荧光报告基团为cy5,探针的3’末端还具有bhq淬灭基团。
64.致病性大肠杆菌(etec)的上游引物荧光报告基团为fam;产气荚膜梭菌(cp)的上游引物荧光报告基团为hex;艰难梭菌(cd)的上游引物荧光报告基团为rox;荧光引物基团的荧光报告基团均标记在引物中的一个t碱基上。
65.实施例2、检测猪腹泻病原体的方法
66.本发明检测样本为猪血清、血浆、肠道,肠内容物、肠系膜淋巴结、排泄物等组织样本等样本,用本公司磁珠法提取dna核酸,在样本处理室进行核酸提取如下操作:
67.核酸提取仪按设定的程序操作,具体操作详见核酸提取仪仪器操作说明。
68.预分装提取试剂操作说明
69.取出试剂盒中预分装的96深孔板试剂,平衡至室温,将可能粘附到深孔板封膜或孔壁的液体甩至底部,静置1~3min。
70.去除封口膜;在深孔板a2~h2,a8~h8加入样本和蛋白酶k;推荐样本加入量为200μl/孔、蛋白酶k 40μl/孔。
71.打开提取仪,将深孔板、磁套放入仪器相应位置,启动对应程序。
72.约15~30min后,提取程序结束。
73.取出深孔板,转移核酸备用。
74.本发明所提供的检测试剂盒还包括如下实时荧光pcr反应体系:
75.组份每一个反应中的体积/浓度mg
2+
4mmdntps(100mm)0.5mmtaq酶(5u/μl)5u引物和探针1000nm模板10μlpcr缓冲液补至30μl
76.pcr扩增程序
[0077][0078][0079]
结果分析:
[0080]
1)目标靶点检测信号为fam,rox,以及cy5通道扩增曲线以及fam、hex、rox通熔解曲线,内标检测信号为hex通道的扩增曲线;
[0081]
2)baseline的设置:baseline一般设置为3-15个循环,具体可根据实际情况进行调整。其调整原则为:选择指数扩增前荧光信号较稳定的区域,起点(start)避开荧光采集起始阶段的信号波动,终点(end)比最早出现指数扩增的样本ct减少1-2个循环。threshold的设置:设定原则以阈值线刚好超过正常阴性对照品的最高点。
[0082]
3)结果阴阳性判定:先分析内标在反应液中hex通道是否检测到扩增曲线,且ct值在判定范围内,若有,表示本次检测有效,可继续进行后续分析。
[0083]
4)若内标在反应液中hex通道没有检测到ct值或无典型s型曲线,表示本次检测样本浓度太低或者有干扰物质抑制反应,需重新准备实验。
[0084]
判读规则
[0085][0086]
实施例3、本发明组合物测试样本的检测结果
[0087]
将实施例1所示的引物和探针,按照实施例2的方法对各种阳性病原体进行检测,实验结果如图1~7所示。结果表明,各通道均能正常进行检测,该多重pcr体系能够检测对应靶标的情况,并所有病原体进行分型。
[0088]
实施例4、本发明组合物的灵敏度
[0089]
将阳性样本分别用阴性样本稀释浓度至100拷贝/ml,以验证本试剂及检测方法的灵敏度。部分检测结果如图8~10所示,结果表明本发明的方法灵敏度高,检测浓度可达100拷贝/ml。
[0090]
实施例5、本发明组合物的特异性
[0091]
将实施例1所示的引物和探针,按照实施例2所述的方法,对核酸序列具有同源性、易引起相同或相似的临床症状的病原体(如志贺氏菌、沙门氏菌、弯曲杆菌、变形杆菌、金黄色葡萄球菌等)在荧光定量pcr仪上进行多重pcr检测,结果如图11~12所示。从图中可以看出,各靶点检测均为阴性,证明本发明组合物有很好的特异性。
[0092]
对比例1、本发明设计的其余的效果不好的引物和探针
[0093]
由于碱基互补配对原则,引物和(或)探针之间会形成二聚体,但这种概率很少,在设计之初就可以排除掉。但多种病原体联合检测时,引物和探针众多,引物和引物、探针和探针或者引物和探针之间容易发生二聚体,要保证设计的保守性(保守性对检测的准确性至关重要),又要考虑不同引物探针之间的相互干扰,需要精心对引物探针进行设计。
[0094]
因此,发明人还设计了其余一些引物和探针(序列未示出)组成了不同的检测体系,同样用于检测各种病原体。具体检测结果如图13~15所示,从图中可以看出检测扩增曲线荧光增幅低,灵敏度检测效果差,而部分靶标甚至无扩增曲线,因此,整体检测效果差。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1