提高无色杆菌或肠杆菌的菌体丰度的培养基及其发酵方法与流程
0.6%酵母 粉、1.0-1.5%蛋白胨,1.0-1.5%磷酸氢二钾,其余为去离子水的培养基,调节培养基的ph为 8-8.5,装瓶量为10-20%,温度26-28℃、转速160-220rpm摇床培养。
15.优选地,在提高肠杆菌丰度的发酵方法中,所述培养基的ph为8.2,装瓶量为15%,温 度26℃、转速180rpm。
16.本发明相比现有技术的有益效果:
17.本发明提供的提高无色杆菌或肠杆菌的菌体丰度的培养基再结合优化的发酵方法,相比 普通的lb液体培养基及其常规发酵方法,能快速实现无色杆菌或肠杆菌的扩大培养,为无 色杆菌或肠杆菌的工业应用提供基础。
具体实施方式
18.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实 施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例, 而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动 前提下所获得的所有其他实施例,都属于本发明保护的范围。
19.本发明中无色杆菌为无色杆菌(achromobacter insuavis)sl8,其16srdna的核苷酸序 列如se q id no:1所示;另一株为肠杆菌为肠杆菌(enterobacter cancerogenus)sl12,其 16srdna的核苷酸序列如seq id no:2所示。肠杆菌(enterobacter cancerogenus)sl12的 保藏号:cctcc m 2022288;无色杆菌(achromobacter insuavis)sl8的保藏号:cctcc m2022286。上述2株微生物于2022年3月18号保藏于中国典型培养物保藏中心(cctcc),保 藏地址:中国.武汉.武汉大学。
20.试验一:培养基成分优化
21.菌株培养的基础条件为:以0.5%的接种量将种子液接种至lb液体培养基中,装液量100% (v/v),置于30℃、160rpm摇床上培养24h,每个处理设4个重复。固定其他元素不变, 分别用不同碳源、氮源、无机盐替换基础培养基中的碳源、氮源及无机盐。替换碳源及添加 量为:0.5%的酵母粉、玉米淀粉、蔗糖、可溶性淀粉、麦芽糖、nahco3;替换氮源及添加量 为:1.0%的蛋白胨、豆粕、kno3;替换无机盐及添加量为:1.0%的nacl、二氢钾、k2hpo4、 mgso4·
7h2o、caco3。本发明中(%)代表质量百分数。
22.36组培养基设计如表1所示。
23.表1实验组设计
24.编号氮源碳源无机盐1kno3蔗糖nacl2豆粕酵母粉mgso4·
7h2o3蛋白胨可溶性淀粉二氢钾4kno3nahco3caco35豆粕玉米淀粉caco36kno3玉米淀粉二氢钾7蛋白胨酵母粉caco38蛋白胨麦芽糖nacl9豆粕蔗糖mgso4·
7h2o
10豆粕nahco3二氢钾11蛋白胨蔗糖磷酸氢二钾12kno3酵母粉nacl13豆粕麦芽糖磷酸氢二钾14蛋白胨玉米淀粉nacl15豆粕可溶性淀粉磷酸氢二钾16kno3可溶性淀粉nacl17kno3麦芽糖mgso4·
7h2o18蛋白胨nahco3nacl19蛋白胨麦芽糖二氢钾20豆粕nahco3nacl21kno3可溶性淀粉mgso4
·
7h2o22豆粕麦芽糖nacl23kno3玉米淀粉磷酸氢二钾24蛋白胨酵母粉磷酸氢二钾25蛋白胨可溶性淀粉nacl26kno3nahco3磷酸氢二钾27豆粕蔗糖nacl28kno3酵母粉二氢钾29蛋白胨蔗糖caco330蛋白胨玉米淀粉mgso4·
7h2o31豆粕可溶性淀粉caco332蛋白胨nahco3mgso4·
7h2o33豆粕玉米淀粉nacl34kno3麦芽糖caco335kno3蔗糖二氢钾36豆粕酵母粉二氢钾
25.分别选取表1中实验设计作为培养基,按0.5%接种量将菌液接种到已调ph的100ml 三角瓶中,30℃、160rpm摇床培养24h后测定od
600
值。ph调节使用hac、naoh/氨水。 结果如表2所示:
26.表2无色杆菌和肠杆菌采用表1中实验设计后菌体丰度
27.编号无色杆菌丰度(亿cfu/ml)肠杆菌丰度(亿cfu/ml)10.00.1210.713.036.46.040.00.1512.610.464.13.8715.212.4
86.520.893.85.3104.64.2118.811.8127.910.41310.613.9148.414.3156.115.8160.40.5170.30.3185.49.8196.915.8203.715.6216.60.3227.610.1233.33.1249.220.7251.410.6260.80.0274.26.52819.68.9295.47.33010.15.83110.07.9322.70.1337.17.7340.10.5352.10.23624.726.4
28.表2中显示,采用处理7的培养基培养后无色杆菌的丰度为15.2亿cfu/ml;采用处理 28的培养基培养后无色杆菌的丰度为19.6亿cfu/ml,采用处理36的培养基培养后无色杆 菌的丰度为24.7亿cfu/ml,因此确认无色杆菌的碳源为酵母粉、氮源为豆粕、蛋白胨和 kno3;无机盐为nacl、二氢钾、caco3。
29.采用处理8的培养基培养后肠杆菌的丰度为20.8亿cfu/ml;采用处理24的培养基培 养后肠杆菌的丰度为20.7亿cfu/ml,采用处理36的培养基培养后无色杆菌的丰度为26.4 亿cfu/ml,因此确认无色杆菌的碳源为酵母粉、氮源为豆粕、蛋白胨;无机盐为nacl、二 氢钾、k2hpo4。
30.(3)正交试验优化
31.试验因素和水平如表3所示,设计正交试验,进一步确定最佳配比。正交试验水平
设计 如表4所示。
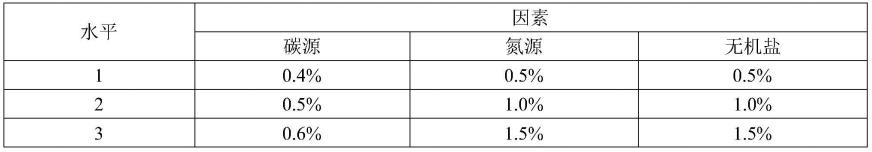
32.表3正交试验因素及水平
[0033][0034]
表4正交试验处理设计
[0035]
处理碳源氮源无机盐10.4%0.5%0.5%20.4%1.0%1.5%30.4%1.5%1.0%40.5%0.5%1.5%50.5%1.0%1.0%60.5%1.5%0.5%70.6%0.5%1.0%80.6%1.0%0.5%90.6%1.5%1.5%
[0036]
(4)无色杆菌采用表4中正交试验设计,按0.5%接种量将菌液接种到自然ph的100ml 三角瓶中,30℃、160rpm摇床培养24h,检测无色杆菌的细菌丰度,结果如表5所示:
[0037]
表5无色杆菌在不同配比碳源、氮源和无机盐下菌体的丰度数据
[0038]
[0039][0040]
在表5中,采用处理6配比的培养基无色杆菌的菌体丰度为22.1亿cfu/ml;采用处理 19配比的培养基无色杆菌的菌体丰度为22.9亿cfu/ml;采用处理20配比的培养基无色杆 菌的菌体丰度为26.6亿cfu/ml;采用处理24配比的培养基无色杆菌的菌体丰度为22.4亿 cfu/ml;因此,适合无色杆菌的培养基的配比为:0.4-0.5%酵母粉、0.5-1.5%豆粕,0.5-1.5% 二氢钾,其余为去离子水。最优培养基配比为:0.4%酵母粉、1.0%豆粕,1.5%二氢钾,其余 为去离子水。
[0041]
(5)肠杆菌采用表4中正交试验设计,按0.5%接种量将菌液接种到已调ph的100ml 三角瓶中,30℃、160rpm摇床培养24h,检测无色杆菌的细菌丰度,结果如表6所示:
[0042]
表6肠杆菌在不同配比碳源、氮源和无机盐下菌体的丰度数据
[0043]
[0044][0045]
在表6中,采用处理12配比的培养基肠杆菌的菌体丰度为18.7亿cfu/ml;采用处理 18配比的培养基无色杆菌的菌体丰度为23.0亿cfu/ml;采用处理20配比的培养基肠杆菌 的菌体丰度为26.6亿cfu/ml;采用处理26配比的培养基肠杆菌的菌体丰度为17.8亿 cfu/ml;因此,适合肠杆菌的培养基的配比为:0.4-0.6%酵母粉、1.0-1.5%蛋白胨,1.0-1.5% 磷酸氢二钾,其余为去离子水。最优培养基配比为:0.6%酵母粉、1.5%蛋白胨,1.5%磷酸氢 二钾,其余为去离子水。
[0046]
试验二:无色杆菌和肠杆菌发酵条件优化
[0047]
(1)无色杆菌的发酵条件优化
[0048]
实施例1
[0049]
选取0.4%酵母粉、1.0%豆粕,1.5%二氢钾作为培养基初始值,按0.5%接种量将菌液接 种到已调ph为8的100ml三角瓶中,装瓶量为20%,温度26℃、转速160rpm摇床培养 24h后测定od
600
值。
[0050]
实施例2
[0051]
选取0.4%酵母粉、1.0%豆粕,1.5%二氢钾作为培养基初始值,按0.5%接种量将菌液接 种到已调ph为9的100ml三角瓶中,装瓶量为30%,温度27℃、180rpm摇床培养24h后 测定od
600
值。
[0052]
实施例3
[0053]
选取0.4%酵母粉、1.0%豆粕,1.5%二氢钾作为培养基初始值,按0.5%接种量将菌液接 种到已调ph为10的100ml三角瓶中,装瓶量为40%,温度28℃、220rpm摇床培养24h 后测定od
600
值。
[0054]
对比例1与实施例1的区别为:装瓶量为10%。
[0055]
对比例2与实施例1的区别为:装瓶量为50%。
[0056]
对比例3与实施例1的区别为:ph为6。
[0057]
对比例4与实施例1的区别为:ph为9。
[0058]
对比例5与实施例1的区别为:温度23℃。
[0059]
对比例6与实施例1的区别为:温度为30℃。
[0060]
对比例7与实施例1的区别为:转速为140rpm。
[0061]
对比例8与实施例1的区别为:转速为250rpm。
[0062]
对比例9培养基为液体lb培养基。
[0063]
表7实施例1-3和对比例1-9中无色杆菌的菌体丰度
[0064]
处理无色杆菌的菌体丰度(亿cfu/ml)实施例172.1实施例275.6实施例373.8对比例115.6对比例223.4对比例326.1对比例429.8对比例531.2对比例632.8对比例728.6对比例829.7对比例92.9
[0065]
表7显示,本发明在无色杆菌的扩大培养中,选择酵母粉作为碳源、豆粕作为氮源,二 氢钾作为无机盐,优化发酵培养中装瓶量、培养基的ph、温度和转速,相比对比例9,显著 提高了无色杆菌的菌体丰度,取得预料不到的技术效果;此外对比例1-8的数据表明,本发 明的技术方案是装瓶量、培养基的ph、温度和转速不断优化,协同提高了菌体丰度,不是简 单的常规调节。
[0066]
实施例1-3中的技术方案中的无色杆菌的菌体丰度显著高于对比例1-9中数据,
[0067]
(2)肠杆菌的发酵条件优化
[0068]
实施例1
[0069]
选取0.6%酵母粉、1.5%蛋白胨,1.5%磷酸氢二钾作为培养基初始值,按0.5%接种量将 菌液接种到已调ph为8的100ml三角瓶中,装瓶量为10%,温度26℃、转速160rpm摇床 培养24h后测定od
600
值。
[0070]
实施例2
[0071]
选取0.6%酵母粉、1.5%蛋白胨,1.5%磷酸氢二钾作为培养基初始值,按0.5%接种量将 菌液接种到已调ph为8.2的100ml三角瓶中,装瓶量为15%,26℃、180rpm摇床培养24 h后测定od
600
值。
[0072]
实施例3
[0073]
选取0.6%酵母粉、1.5%蛋白胨,1.5%磷酸氢二钾作为培养基初始值,按0.5%接种量将 菌液接种到已调ph为8.5的100ml三角瓶中,装瓶量为30%,26℃、220rpm摇床培养24 h后测定od
600
值。
[0074]
对比例1与实施例1的区别为:装瓶量为5%。
[0075]
对比例2与实施例1的区别为:装瓶量为30%。
[0076]
对比例3与实施例1的区别为:ph为7。
[0077]
对比例4与实施例1的区别为:ph为9。
[0078]
对比例5与实施例1的区别为:温度23℃。
[0079]
对比例6与实施例1的区别为:温度为30℃。
[0080]
对比例7与实施例1的区别为:转速为140rpm。
[0081]
对比例8与实施例1的区别为:转速为250rpm。
[0082]
对比例9培养基为液体lb培养基。
[0083]
表8实施例1-3和对比例1-9中肠杆菌的菌体丰度
[0084][0085][0086]
表8显示,本发明在肠杆菌的扩大培养中,选择酵母粉作为碳源、蛋白胨作为氮源,磷 酸二氢钾作为无机盐,优化发酵培养中装瓶量、培养基的ph、温度和转速,相比对比例9显 著提高了肠杆菌的菌体丰度,取得预料不到的技术效果;此外对比例1-8的数据表明,本发 明的技术方案是装瓶量、培养基的ph、温度和转速不断优化,协同提高了菌体丰度,不是简 单的常规选择。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1