一种基于新型冠状病毒奥密克戎突变株的mRNA疫苗的制作方法
一种基于新型冠状病毒奥密克戎突变株的mrna疫苗
技术领域
1.本发明涉及生物技术领域,具体涉及一种基于新型冠状病毒奥密克戎突变株的 mrna疫苗。
背景技术:
2.2019新型冠状病毒(sars-cov-2)是以前从未在人体中发现的冠状病毒新毒株,该病毒为第七个可以感染人的冠状病毒(cov)。人感染sars-cov-2的潜伏期一般为 1~14天,感染后常见体征有呼吸道症状、发热、咳嗽、气促和呼吸困难等。在较严重病例中,感染可导致肺炎、严重急性呼吸综合征、肾衰竭,甚至死亡。
3.新冠病毒是正义单链rna((+)ssrna)包膜病毒,编码4种结构蛋白:刺突蛋白 (s)、包膜蛋白(e)、膜蛋白(m)和核壳蛋白(n)。s蛋白分为s1和s2两个子结构域,s1结构域负责识别病毒特异性受体并结合至宿主细胞,s2具有跨膜结构域,负责膜融合。sars-cov-2omicron变异病毒株于2021年11月在南非被首次报告,后已传播至少159个国家和地区,成为全球主要流行的病毒变异株,而基于早期流行株研发的新冠疫苗针对sars-cov-2omicron变异病毒株的中和能力均存在显著下降。
4.目前上市和在研的新型冠状病毒疫苗主要包括mrna疫苗、灭活疫苗、腺病毒载体疫苗、dna疫苗、重组蛋白疫苗等。mrna疫苗是将体外转录的mrna递送至细胞,翻译产生蛋白,进而激发机体的特异免疫应答。mrna疫苗不同于其他的核酸疫苗,不需要入核仅在细胞质中完成表达,因此没有造成宿主基因组插入突变的风险。此外, mrna的快速、简易制备方法和低成本也是作为疫苗的优势之一,大大缩短了应对突发感染性疾病的反应时间,降低了防控成本。
技术实现要素:
5.本发明的目的是提供一种基于新型冠状病毒奥密克戎突变株的mrna疫苗。
6.鉴于s蛋白在宿主细胞识别和进入以及宿主免疫系统诱导病毒中和抗体中的重要性,本发明将sars-cov-2的s蛋白用于疫苗开发。s蛋白的融合前构象对建立有效的免疫系统至关重要,因此为开发更有针对性的mrna疫苗,本发明选取了omicron 病毒株的s蛋白以及在此基础上进行的特定脯氨酸位点的替代变体,分别得到 omicron s,omicron s-2p(k983p,v984p)和omicron s-6p(f814p,a889p,a896p,a939p,k983p,v984p)的抗原序列。
7.第一方面,本发明提供一种rna分子。
8.本发明提供的rna分子,包括编码sars-cov-2的抗原性多肽或者免疫原性片段的核酸序列(如可为开放阅读框);其中,所述抗原性多肽或所述免疫原性片段选自 sars-cov-2的s蛋白或其变体、sars-cov-2的受体结合结构域(rbd)或其变体。
9.所述sars-cov-2的s蛋白的变体与所述sars-cov-2的s蛋白的原始序列相比,存在如下突变位点:k983p和v984p。以k983p为例,表示将所述sars-cov-2的s蛋白的原始序列的第983位(对应seq id no.1的第983位)的氨基酸残基由k突变为 p。其余突变位点表示法同
理。
10.进一步地,所述sars-cov-2是sars-cov-2omicron变异病毒株。
11.在本发明的一些案例中,所述sars-cov-2的s蛋白的变体与所述sars-cov-2的s蛋白的原始序列相比,还存在如下突变位点中的全部或部分:f814p、a889p、a896p、a939p。
12.在所述抗原性多肽或者所述免疫原性片段中,可包含一个或多个免疫原性表位。例如,至少2个,至少3个,至少4个,至少5个,至少6个,至少7个,至少8个,至少9个,至少10个或更多个免疫原性表位。
13.进一步地,所述抗原性多肽或者所述免疫原性片段可为如下任一:
14.(a1)sars-cov-2omicron变异病毒株的s蛋白;
15.(a2)sars-cov-2omicron变异病毒株的s蛋白变体omicrons-2p,其氨基酸序列与所述sars-cov-2omicron变异病毒株的s蛋白的原始序列相比,仅存在k983p和v984p两个突变位点;
16.(a3)sars-cov-2omicron变异病毒株的s蛋白变体omicrons-6p,其氨基酸序列与所述sars-cov-2omicron变异病毒株的s蛋白的原始序列相比,仅存在f814p、a889p、a896p、a939p、k983p和v984p六个突变位点。
17.在(a2)-(a3)中,所述sars-cov-2omicron变异病毒株的s蛋白变体的突变位置相对应的原始序列为含有信号肽的序列(如seqidno.1)。
18.(a4)seqidno.1的第17-1270位或seqidno.2的第17-1270位或seqidno.3的第17-1270位所示多肽;
19.(a5)与(a4)所限定的氨基酸序列相比具有至少99%、98%、97%、96%、95%、90%、85%或80%同源性的多肽。
20.相应地,编码所述抗原性多肽或者所述免疫原性片段的rna序列为如下任一:
21.(b1)将seqidno.4的第49-3810位或seqidno.5的第49-3810位或seqidno.6的第49-3810位核苷酸中的t替换为u后所得核苷酸序列;
22.(b2)与(b1)所限定的核苷酸序列相比具有至少99%、98%、97%、96%、95%、90%、85%或80%同源性。
23.其中,seqidno.1的第17-1270位所示多肽为不含信号肽的sars-cov-2omicron变异病毒株的s蛋白的原始序列(由seqidno.4的第49-3810位编码得到);seqidno.2的第17-1270位所示多肽为不含信号肽的omicrons-2p(由seqidno.5的第49-3810位编码得到);seqidno.3的第17-1270位所示多肽为不含信号肽的omicrons-6p(由seqidno.6的第49-3810位编码得到)。
24.在一些实施方案中,编码所述抗原性多肽或者所述免疫原性片段的核酸序列还包含用于编码分泌信号肽的核酸序列。
25.进一步地,编码所述分泌信号肽的核酸序列位于编码所述抗原性多肽或者所述免疫原性片段的核酸序列的5’端。
26.进一步地,所述分泌信号肽可为如下任一:
27.(c1)sars-cov-2(如sars-cov-2omicron变异病毒株)的s蛋白的分泌信号肽;
28.(c2)seqidno.1的第1-16位或seqidno.2的第1-16位或seqidno.3的第1-16位所示多肽;
29.(c3)与(c2)所限定的氨基酸序列相比具有至少99%、98%、97%、96%、95%、 90%、85%或80%同源性的多肽。
30.相应地,编码所述分泌信号肽的rna序列可选自如下任一:
31.(d1)将seq id no.4的第1-48位或seq id no.5的第1-48位或seq id no.6 的第1-48位核苷酸中的t替换为u后所得核苷酸序列;
32.(d2)与(d1)所限定的核苷酸序列相比具有至少99%、98%、97%、96%、95%、 90%、85%或80%同源性。
33.在一些实施方案中,所述rna分子可为mrna、环状rna(crna)或自复制rna (sarna)。其中,所述rna分子适合多肽的细胞内表达。
34.在一些实施方案中,所述rna分子为经过修饰的rna分子。进一步地,所述修饰是通过用修饰的尿苷残基取代一些或全部尿苷残基。更进一步地,所述修饰的尿苷可以是n1-甲基-假尿苷。
35.在一些实施方案中,所述rna分子还可包括一个或多个能够促进稳定性和/或翻译效率的结构元件。进一步地,所述结构元件可包括:5’帽、5’utr、3’utr和/ 或polya尾。
36.更进一步地,所述5’帽可以是或包含cap1结构;更加具体地,所述5’帽是 m7g(5’)ppp(5’)(2
’‑
omea)pg。
37.更进一步地,所述5'-utr可以是人β-珠蛋白mrna的5'-utr序列;所述5'-utr 可以具有kozak序列。更加具体地,所述5’utr可包含或为seq id no.7所示核苷酸序列,或与seq id no.7所示核苷酸序列具有至少99%、98%、97%、96%、95%、90%、 85%或80%同源性的核苷酸序列。
38.更进一步地,所述3'-utr可以是人β-珠蛋白mrna的两个重复的3'-utr。更加具体地,所述3’utr可以包含或为seq id no.8所示核苷酸序列,或与seq id no.8 所示核苷酸序列具有至少99%、98%、97%、96%、95%、90%、85%或80%同源性的核苷酸序列。
39.更进一步地,所述polya尾可以包含至少50、至少60或至少100个腺嘌呤核糖核苷酸;更加具体地,所述polya尾可以包含或为seq id no.9所示核苷酸序列,或由seq id no.9所示核苷酸序列组成。
40.在本发明的具体实施方式中,所述rna分子的序列为如下任一:
41.(e1)seq id no.10或seq id no.11seq id no.12;
42.(e2)与(e1)所限定的核苷酸序列相比具有至少99%、98%、97%、96%、95%、 90%、85%或80%同源性。
43.第二方面,本发明要求保护如下任一生物材料:
44.(f1)能够转录得到前文第一方面所述rna分子的dna分子;
45.(f2)含有(f1)中所述dna分子的表达盒或重组载体或重组菌或重组细胞系。
46.第三方面,本发明要求保护一种用于预防和/或治疗新冠病毒感染的组合物。
47.本发明要求保护的组合物包含前文第一方面所述的rna分子。
48.在一些实施方案中,所述组合物可配制为或待配制为液体、固体或其组合。进一步地,所述组合物配制为或待配制为用于注射或其他给药方式。更进一步地,所述组合物配制为或待配制为用于肌肉内注射。
49.进一步地,所述组合物可为将所述rna分子与蛋白和/或脂质复合而成的rna-颗
粒。
50.更进一步地,所述组合物可为将所述rna分子负载于脂质纳米颗粒中后得到。所述脂质纳米颗粒可为如下任一:
51.(g1)包含可电离的阳离子脂质、磷脂、胆固醇和聚乙二醇(peg)-脂质,或者由这四者组合而成。
52.(g2)包含十七烷-9-基8-((2-羟乙基)(6-氧代-6-((癸氧基)己基)氨基) 辛酸酯)、二肉豆蔻酰甘油-聚乙二醇2000、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱和胆固醇,或者由这四者组合而成。
53.其中,十七烷-9-基8-((2-羟乙基)(6-氧代-6-((癸氧基)己基)氨基)辛酸酯)即为sm-102;二肉豆蔻酰甘油-聚乙二醇2000即为dmg-peg2000;1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱即为dspc。
54.在一些实施方案中,所述脂质纳米颗粒中包载的所述rna分子的量在200μg/ml 以上(如350μg/ml-640μg/ml)。
55.在一些实施方案中,sm-102、dspc、胆固醇和dmg-peg2000以274.64:61.12: 115.14:29.11的质量比混合。
56.在一些实施方案中,将所述rna分子配制为或待配制为胶体。进一步地,所述 rna配制为颗粒,在形成的胶体分散相中存在50%或更多、75%或更多或者85%或更多的rna。更进一步地,所述颗粒通过使溶于水相中的rna暴露于溶于有机相中的脂质形成,其中所述有机相可包含乙醇。或者,所述颗粒通过使溶于水相中的rna暴露于分散于水相中的脂质形成,其中所述分散于水相中的脂质形成脂质体。
57.在一些实施方案中,所述rna分子可以1μg-100μg每剂量的范围的量存在于所述组合物中。
58.第四方面,本发明要求保护前文第一方面所述rna分子或前文第二方面所述生物材料或前文第三方面所述组合物在制备用于预防和/或治疗新冠病毒感染药物中的用途。所述药物可为疫苗(如rna疫苗)。
59.进一步地,所述药物可包含一种或多种药学上可接受的载剂、稀释剂和/或赋形剂。
60.第五方面,本发明要求保护一种用于预防和/或治疗新冠病毒感染的药物。
61.本发明要求保护的用于预防和/或治疗新冠病毒感染的药物,其有效成分包括或为前文第一方面所述的rna分子。
62.进一步地,所述药物还可包含一种或多种药学上可接受的载体、稀释剂和/或赋形剂。
63.在一些实施方案中,所述药物用于在受试者中诱导针对冠状病毒的免疫应答;进一步地,所述针对冠状病毒的免疫应答为针对冠状病毒抗原的特异性免疫应答。
64.在一些实施方案中,所述药物用于冠状病毒感染的治疗和/或预防。
65.在第四和第五方面中,所述冠状病毒为β冠状病毒。所述冠状病毒为沙贝病毒 (sarbecovirus)。所述冠状病毒为sars-cov-2,进一步地所述冠状病毒为 sars-cov-2omicron变异病毒株。
66.在一些实施方案中,当所述rna分子、所述组合物或所述药物给予人源细胞时,实
现能够被检测的所述抗原性多肽或者所述免疫原性片段的表达;进一步地,所述表达持续至少24小时或更长的时间段。
67.在一些实施方案中,施用所述rna分子、所述组合物或所述药物能够在所述受试者中产生免疫效果,所述免疫效果包括产生sars-cov-2中和抗体和/或t细胞应答;进一步地,所述t细胞应答为th1型t细胞应答;更进一步地,所述th1型t细胞应答为cd4
+
和/或cd8
+
t细胞应答。
68.在一些实施方案中,施用所述rna分子、所述组合物或所述药物在所述受试者中产生免疫应答,所述免疫应答包括产生针对sars-cov-2刺突蛋白的s1亚基的结合抗体滴度;进一步地,所述免疫应答包括产生针对sars-cov-2病毒的中和抗体滴度。
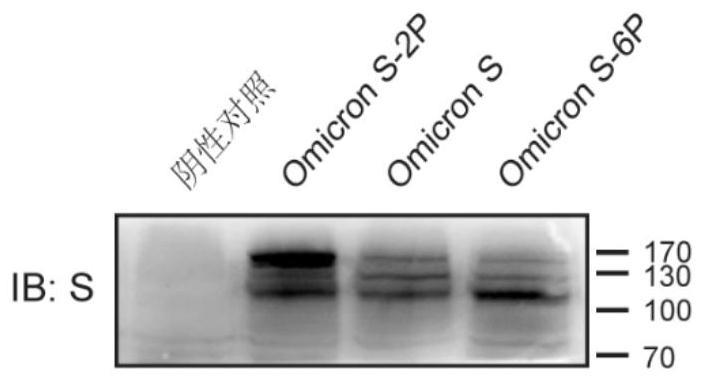
69.在一些实施方案中,将所述rna分子、所述组合物或所述药物施用给所述受试者之后7天,所述受试者(如小鼠)的血清显示针对所述抗原性多肽或者所述免疫原性片段的抗体的产生。
70.在一些实施方案中,将所述rna分子、所述组合物或所述药物施用给所述受试者之后14天,所述受试者(如小鼠)的血清显示病毒中和活性。
71.进一步地,所述受试者为哺乳动物;更进一步地,所述受试者为小鼠;更加具体地,所述受试者为人类。
72.第六方面,本发明要求保护一种制备用于预防和/或治疗新冠病毒感染rna疫苗的方法。
73.本发明要求保护的制备用于预防和/或治疗新冠病毒感染rna疫苗的方法,可包括将前文第一方面所述的rna分子负载于脂质纳米颗粒中的步骤。
74.所述脂质纳米颗粒可为如下任一:
75.(g1)包含可电离的阳离子脂质、磷脂、胆固醇和聚乙二醇(peg)-脂质,或者由这四者组合而成。
76.(g2)包含十七烷-9-基8-((2-羟乙基)(6-氧代-6-((癸氧基)己基)氨基) 辛酸酯)、二肉豆蔻酰甘油-聚乙二醇2000、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱和胆固醇,或者由这四者组合而成。
77.其中,十七烷-9-基8-((2-羟乙基)(6-氧代-6-((癸氧基)己基)氨基)辛酸酯)即为sm-102;二肉豆蔻酰甘油-聚乙二醇2000即为dmg-peg2000;1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱即为dspc。
78.在一些实施方案中,所述脂质纳米颗粒中包载的所述rna分子的量在200μg/ml 以上(如350μg/ml-640μg/ml)。
79.在一些实施方案中,sm-102、dspc、胆固醇和dmg-peg2000以274.64:61.12: 115.14:29.11的质量比混合。
80.本发明还要求保护在受试者中诱导针对冠状病毒的免疫应答,进一步地针对冠状病毒抗原的特异性免疫应答的方法。在另一方面,本发明还要求保护用于冠状病毒感染的治疗或预防性治疗的方法。所述方法包括向受试者施用本文所述的rna分子、所述组合物或所述药物。所述受试者为哺乳动物,进一步地所述受试者为小鼠,更进一步地所述受试者为人类。在本发明所述方法的一些实施方案中,所述冠状病毒为β冠状病毒,或所述冠状病毒为沙贝病毒,或所述冠状病毒为sars-cov-2,进一步地所述冠状病毒为sars-cov-2omicron
变异病毒株。
81.实验证明,本发明所提供的rna疫苗能够有效的诱导冠状病毒抗原特异性免疫应答,产生针对sars-cov-2病毒的中和抗体滴度。假病毒实验显示omicron s组, omicron s-2p组,omicron s-6p组28天免疫血清对sars-cov-2假型病毒中和抗体几何平均效价分别为895,4300,5760。真病毒实验显示:omicron s组,omicron s-2p 组,omicron s-6p组28天免疫血清对sars-cov-2流行株、南非株、印度株和奥米克戎株均具有中和活性,其中以对奥米克戎株的中和活性(nt50)最高,分别为512、 768和512。本发明对于预防或治疗冠状病毒感染,特别是预防或治疗sars-cov-2 omicron变异病毒的感染具有重要意义。
附图说明
82.图1为lnp-mrna在293t细胞中的表达。阴性对照为lnp(未包载mrna脂质颗粒的对照)。
83.图2为mrna疫苗免疫小鼠血清igg抗体检测。
84.图3为免疫后28天各组mrna疫苗诱导的体液免疫应答。
85.图4为elispot检测免疫小鼠脾细胞分泌ifn-γ水平。
86.图5为elispot检测免疫小鼠脾细胞分泌il-2水平。
87.图6为mrna疫苗免疫小鼠血清针对omicron假型病毒的中和抗体检测。
具体实施方式
88.除非另外指出,否则本发明实验将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和合成生物学等等的常规技术,其在本领域技术范围内。这样的技术在文献中有充分的解释:“molecular cloning:a laboratory manual,”第二版(sambrook等人,1989);“oligonucleotide synthesis”(m.j.gait 编,1984);“animal cell culture”(r.i.freshney编,1987);“methods inenzymology”(academic press,inc.);“current protocols in molecular biology”(f.m.ausubel等人编,1987,以及定期更新);“pcr:the polymerase chainreaction,”(mullis等人编,1994);singleton等人,dictionary of microbiologyand molecular biology第二版,j.wiley&sons(new york,n.y.1994)和march’s advanced organic chemistry reactions,mechanisms and structure第四版, john wiley&sons(new york,n.y.1992),为本领域技术人员提供了本技术中使用的许多术语的通用指南。
89.除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员通常理解的相同的含义。为了本发明的目的,下文定义了下述术语。
90.冠词“一个/一种”和“该/所述”在本文中用于指一个/一种;超过一个/一种即至少一个/一种。替代(例如“或”)的使用应理解为意指替代方案中任一、两者或其任何组合。术语“和/或”应理解为意指替代方案中任一或两者。
91.如本文使用的,术语“约”或“大约”是指与参考数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度相比较,改变多达15%、10%、9%、8%、 7%、6%、5%、4%、3%、2%或1%的数量、水平、值、数量、频率、百分比、尺度、大小、量、重量或长度。
92.在本说明书全文,除非上下文另有要求,否则术语“包含”,“包括”、“含有”和“具
有”应理解为暗示包括所述步骤或要素或者步骤组或要素组,但不排除任何其他步骤或要素或者步骤组或要素组。在特定实施方式中,术语“包含”,“包括”、“含有”和“具有”同义使用。
[0093]“由
……
组成”意指包括但限于在短语“由
……
组成”中的任何。因此,短语“由
……
组成”是指示所列出的要素是需要的或强制性的,并且没有其他要素是可以存在的。
[0094]“基本上由
……
组成”意指包括在短语“基本上由
……
组成”中列出的任何要素,并且限于不干扰或贡献于所列出的要素的公开内容中指定的活动或动作的其他要素。因此,短语“基本上由
……
组成”是指示所列出的要素是需要的或强制性的,但没有其他要素是任选的,并且取决于它们是否影响所列出的要素的活动或动作而可以存在或不存在。
[0095]
在本说明书全文,提到“一个实施方案”、“一些实施方案”、“一个具体的实施方案”等类似表述意指与所述实施方式结合描述的特定特征、结构或特性被包括在本发明的至少一个实施方式中。因此,前述短语在本说明书全文的各个地方的出现不一定全部指相同实施方式。此外,特定特征、结构或特性可以以任何合适方式在一个或多个实施方式中组合。
[0096]
如本文所用的,“突变体”和“变体”是指保留与原始序列的生物学活性相同或基本上相同的生物学活性的分子。该突变体或变体可以来自相同或不同的物种,或者可以是基于天然的分子或现有的分子的合成序列。在一些实施方式中,术语“突变体”和“变体”是指多肽具有的氨基酸序列与对应的野生型多肽至少相差一个氨基酸。例如,突变体和变体可以包含保守氨基酸取代:即用具有相似性质的氨基酸取代原有的对应氨基酸。保守取代可以是极性对极性氨基酸,如甘氨酸(g,gly)、丝氨酸(s,ser)、苏氨酸(t,thr)、酪氨酸(y,tyr)、半胱氨酸(c,cys)、天冬酰胺(n,asn)和谷氨酰胺(q,gln);非极性对非极性氨基酸,如丙氨酸(a, ala)、缬氨酸(v,val)、色氨酸(w,trp)、亮氨酸(l,leu)、脯氨酸(p,pro)、甲硫氨酸(μ,met)、苯丙氨酸(f,phe);酸性对酸性氨基酸,如天冬氨酸(d, asp)、谷氨酸(e,glu);碱性对碱性氨基酸,如精氨酸(r,arg)、组氨酸(h, his)、赖氨酸(k,lys);带电荷氨基酸对带电荷氨基酸,如天冬氨酸(d,asp)、谷氨酸(e,glu)、组氨酸(h,his)、赖氨酸(k,lys)和精氨酸(r,arg));疏水对疏水性氨基酸,如丙氨酸(a,ala)、亮氨酸(u,leu)、异亮氨酸(i,ile)、缬氨酸(v,val)、脯氨酸(p,pro)、苯丙氨酸(f,phe)、色氨酸(w,trp)和甲硫氨酸(m,met)。在一些其他实施方式中,突变体或变体也可以包含非保守性取代。
[0097]
在一些实施方式中,突变体或变体多肽可以具有约1、2、3、4、5、6、7、8、 9、10、15、20、30、40、50、60、70、80、90、100个或更多个或前述数值中的任意两者构成的范围的氨基酸的置换、添加、插入或缺失。与未改变的多肽相比,突变体或变体可以具有至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、 90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%或前述数值中的任意两者构成的范围的活性。
[0098]
多核苷酸或多肽与另一个多核苷酸或多肽具有一定的“序列同一性”或“相同性”百分比,意味着当比对两条序列时,该百分比的碱基或氨基酸相同并且在相同的相对位置。确定两个氨基酸序列或两个核苷酸序列的百分比相同性可以包括比对和比较两个序列中相应位置处的氨基酸残基或核苷酸。如果两个序列中的所有位置被相同的氨基酸残基或核苷酸占据,那么所述序列被认为是100%相同的。序列相同性可以以多种不同方式确定,例如,可以使用各种方法和计算机程序(例如, blast、t-coffee、muscle、mafft等)对序列进行比对。
[0099]
本发明一般包括受试者的免疫治疗,包括施用rna,即疫苗rna,其编码氨基酸即疫苗抗原,包含sars-cov-2s蛋白或其免疫原性片段或变体。因此,疫苗抗原包含sars-cov-2s蛋白的表位,用于在受试者中诱导针对冠状病毒s蛋白,特别是sars-cov-2s蛋白的免疫应答。施用编码疫苗抗原的rna以提供抗原(在通过适当的靶细胞表达多核苷酸之后),用于诱导,即刺激、引发和/或扩大免疫应答,例如,抗体和/或免疫效应细胞,其靶向靶抗原(冠状病毒s蛋白,特别是sars-cov
ꢀ‑
2s蛋白)或其加工产物。根据本公开诱导的免疫应答是b细胞介导的免疫应答,即抗体介导的免疫应答,特别是抗sars-cov-2免疫应答。
[0100]
本文描述的疫苗包含作为有效成分的单链rna,其可以在进入接受者细胞后翻译为相应的蛋白。除了编码抗原序列的野生型、突变型或密码子优化的序列,rna 还可以包含一个或多个结构元件,这些结构元件针对rna在稳定性和翻译效率方面的最大效力进行优化(5'帽、5'utr、3'utr、polya尾)。cleancap形成的 m7g(5’)ppp(5’)(2
’‑
omea)pg可以用作rna药物物质5'-端的特定加帽结构。作为5'-utr序列,可以使用人β-珠蛋白mrna的5'-utr序列,任选地具有优化的“kozak序列”以提高翻译效率。3'-utr可以是人β-珠蛋白mrna的两个重复的 3'-utr。此外,可以使用长度为50-120个核苷酸的polya尾序列。
[0101]
此外,可以将分泌信号肽(sec)以sec翻译为n末端标签的方式融合至抗原编码区。在一个实施方案中,sec对应于s蛋白的分泌信号肽。
[0102]
本文描述的疫苗rna可以与蛋白和/或脂质复合,以产生用于施用的rna-颗粒。如果使用不同rna的组合,可以将rna一起或分别与蛋白和/或脂质复合以产生用于施用的rna-颗粒。
[0103]
在一方面,本发明涉及一种组合物或药物制品(medical preparation),其包含编码氨基酸序列的rna,所述氨基酸序列包含sars-cov-2s蛋白或其免疫原性片段或变体。
[0104]
在一个实施方案中,包含sars-cov-2s蛋白或其免疫原性片段或变体的氨基酸序列能够形成多聚体复合物,特别是三聚体复合物。为此,包含sars-cov-2s 蛋白或其免疫原性片段或变体的氨基酸序列可以包含允许形成多聚体复合物的结构域,特别是包含sars-cov-2s蛋白或其免疫原性片段或变体的氨基酸序列的三聚体复合物。在一个实施方案中,允许形成多聚体复合物的结构域包含三聚结构域,例如,本文描述的三聚结构域。
[0105]
在一个实施方案中,包含sars-cov-2s蛋白或其免疫原性片段或变体的氨基酸序列由编码序列编码,与野生型编码序列相比,所述编码序列是密码子优化的和 /或g/c含量增加,其中所述密码子优化和/或g/c含量增加不改变编码的氨基酸序列的序列。
[0106]
在一个实施方案中,(
ⅰ
)编码sars-cov-2s蛋白或其免疫原性片段或变体的 rna包含seq id no.4、seq id no.5或seq id no.6的核苷酸49-3810的核苷酸序列(t替换为u),与seq id no.4、seq id no.5或seq id no.6的核苷酸49-3810 的核苷酸序列(t替换为u)具有至少99%、98%、97%、96%、95%、90%、85%或80%相同性的核苷酸序列。(
ⅱ
)sars-cov-2s蛋白或其免疫原性片段或变体包含seq idno.1、seq id no.2或seq id no.3的氨基酸17-1270的氨基酸序列,与seq id no.1、 seq id no.2或seq id no.3的氨基酸17-1270的氨基酸序列具有至少99%、98%、 97%、96%、95%、90%、85%或80%相同性的氨基酸序列。
[0107]
在一个实施方案中,所述rna还包含用于编码分泌信号肽的rna序列。
[0108]
在一个实施方案中,所述分泌信号肽融合,通过n-末端融合至sars-cov-2s 蛋白
或其免疫原性片段或变体。
[0109]
在一个实施方案中,(
ⅰ
)编码所述分泌信号肽的rna包含seq id no.4、seq idno.5或seq id no.6的核苷酸1-48的核苷酸序列(t替换为u),与seq id no.4、 seq id no.5或seq id no.6的核苷酸1-48的核苷酸序列(t替换为u)具有至少 99%、98%、97%、96%、95%、90%、85%或80%相同性的核苷酸序列。(
ⅱ
)所述分泌信号肽包含seq id no.1、seq id no.2或seq id no.3的氨基酸1-16的氨基酸序列,与seq id no.1、seq id no.2或seq id no.3的氨基酸1-16的氨基酸序列具有至少99%、98%、97%、96%、95%、90%、85%或80%相同性的氨基酸序列。
[0110]
在一个实施方案中,所述rna是修饰的rna,特别是稳定的mrna。在一个实施方案中,所述rna包含修饰的核苷,以代替尿苷。在一个实施方案中,所述修饰的核苷是n1-甲基-假尿苷(m1ψ)。
[0111]
在一个实施方案中,编码包含sars-cov-2s蛋白或其免疫原性片段或变体的氨基酸序列的rna包含5’utr,其包含seq id no.7的核苷酸序列,或与seq id no.7 的核苷酸序列具有至少99%、98%、97%、96%、95%、90%、85%或80%相同性的核苷酸序列。
[0112]
在一个实施方案中,编码包含sars-cov-2s蛋白或其免疫原性片段或变体的氨基酸序列的rna包含3’utr,其包含seq id no.8的核苷酸序列,或与seq id no.8 的核苷酸序列具有至少99%、98%、97%、96%、95%、90%、85%或80%相同性的核苷酸序列。
[0113]
在一个实施方案中,编码包含sars-cov-2s蛋白或其免疫原性片段或变体的氨基酸序列的rna包含polya尾序列。在一个实施方案中,所述polya尾序列包含至少100个核苷酸。在一个实施方案中,所述polya尾序列包含seq id no.9的核苷酸序列,或由seq id no.9的核苷酸序列组成。
[0114]
在一个实施方案中,所述rna或组合物配制为或待配制为液体、固体或其组合。在一个实施方案中,所述rna或组合物配制为或待配制为用于注射。在一个实施方案中,所述rna或组合物配制为或待配制为用于肌肉内注射。
[0115]
在一个实施方案中,所述rna配制为或待配制为颗粒。在一个实施方案中,所述颗粒为脂质纳米颗粒(lnp)。
[0116]
在一个实施方案中,所述lnp颗粒包含十七烷-9-基8-((2-羟乙基)(6-氧代
ꢀ‑
6-((癸氧基)己基)氨基)辛酸酯)(heptadecan-9-yl 8-((2-hydroxyethyl)(6-oxo-6-(undecyloxy)hexyl)amino)octanoate)、二肉豆蔻酰甘油-聚乙二醇2000(1,2-dimyristoyl-sn-glycero-3-methoxypolyethylene glycol)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(1,2-distearoyl-sn-glycero-3
ꢀ‑
phosphocholine)和胆固醇。
[0117]
在一个实施方案中,所述rna配制为或待配制为胶体。在一个实施方案中,所述rna配制为或待配制为颗粒,形成胶体的分散相。在一个实施方案中,所述分散相中存在50%或更多、75%或更多或者85%或更多的rna。在一个实施方案中,所述 rna配制或待配制为包含rna和脂质的颗粒。在一个实施方案中,所述颗粒通过使溶于水相中的rna暴露于溶于有机相中的脂质形成。在一个实施方案中,所述有机相包含乙醇。在一个实施方案中,所述颗粒通过使溶于水相中的rna暴露于分散于水相中的脂质形成。在一个实施方案中,所述分散于水相中的脂质形成脂质体。
[0118]
在一个实施方案中,所述rna为mrna、环状rna(crna)和自复制rna(sarna)。
[0119]
在一个实施方案中,所述组合物或药物制品为药物组合物。在一个实施方案中,所述组合物或药物制品为疫苗。在一个实施方案中,所述药物组合物进一步包含一种或多种药学上可接受的载体、稀释剂和/或赋形剂。
[0120]
在一方面,本发明涉及本文描述的组合物或药物制品,其用于制药用途。在一个实施方案中,所述制药用途包括在受试者中诱导针对冠状病毒的免疫应答。在一个实施方案中,所述制药用途包括冠状病毒感染的治疗或预防性治疗。
[0121]
在一个实施方案中,所述冠状病毒为β冠状病毒。在一个实施方案中,所述冠状病毒为沙贝病毒(sarbecovirus)。在一个实施方案中,所述冠状病毒为sars-cov
ꢀ‑
2。
[0122]
在一方面,本发明涉及一种在受试者中诱导针对冠状病毒的免疫应答的方法,所述方法包括向受试者施用包含编码氨基酸序列的rna的组合物,所述氨基酸序列包含sars-cov-2s蛋白或其免疫原性片段或变体。
[0123]
在一个实施方案中,所述方法为针对冠状病毒进行疫苗接种的方法。在一个实施方案中,所述方法为用于冠状病毒感染的治疗或预防性治疗的方法。
[0124]
在一个实施方案中,所述受试者为小鼠。在一个实施方案中,所述冠状病毒为β冠状病毒。在一个实施方案中,所述冠状病毒为沙贝病毒(sarbecovirus)。在一个实施方案中,所述冠状病毒为sars-cov-2。
[0125]
在一方面,本发明涉及本文描述的组合物或药物制品,其用于本文描述的方法。
[0126]
其中,本公开证实包含脂质纳米颗粒包裹的mrna的组合物可以在根据方案(包括施用至少一个剂量的疫苗组合物)向小鼠施用之后7天内实现血清中针对表位的可检测的抗体滴度,所述mrna编码sars-cov-2多肽(例如,sars-cov-2的s蛋白)的至少一部分(例如,是或包含表位)。
[0127]
本公开记录了其中mrna内的核苷酸经修饰的组合物(例如,包含脂质纳米颗粒包裹的mrna的组合物,所述mrna编码sars-cov-2多肽(例如,sars-cov-2的 s蛋白)的至少一部分(例如,是或包含表位))和/或涉及这类组合物的方法,其特征在于:不存在内在佐剂作用,或者与具有未修饰的其他可比组合物(或方法) 相比减少的内在佐剂作用。可选地或额外地,在一些实施方案中,这类组合物(或方法)诱导抗体应答和/或cd4
+
t细胞应答。在涉及修饰的核苷酸的一些实施方案中,这类修饰的核苷酸可以存在于例如3’utr序列、抗原编码序列和/或5’utr 序列中。在一些实施方案中,修饰的核苷酸是或包括一个或多个修饰的尿嘧啶残基。
[0128]
其中,本公开记录了提供的组合物(例如,包含脂质纳米颗粒包裹的mrna的组合物,所述mrna编码sars-cov-2的多肽(例如,sars-cov-2的s蛋白)的至少一部分(例如,是或包含表位))和/或方法,其特征在于:编码的多肽(例如, sars-cov-2的蛋白(如s蛋白))。在一些实施方案中,所述多肽持续表达。例如,在一些实施方案中,这类组合物和/或方法的特征在于,当给予人源细胞时,它们实现可检测的多肽表达,并且在一些实施方案中,这种表达持续至少24小时或更长的时间段。
[0129]
阅读本公开的本领域技术人员会进一步理解它描述了各种mrna构建体,其包含全长sars-cov-2刺突蛋白的核酸序列(例如,包括其中这样的编码的sars-cov
ꢀ‑
2刺突蛋白可以包含至少一个或多个氨基酸取代的实施方案,例如,如本文描述的脯氨酸取代,和/或其中mrna序列针对受试者(例如,哺乳动物,例如,人)进行密码子优化的实施方案)。更进一
步,阅读本公开的这样的普通技术人员会理解它描述了包含编码全长sars-cov-2刺突蛋白的核酸序列的某些mrna构建体的特定特征和/或优点。不希望受任何特定理论的束缚。在一些实施方案中,阅读本公开的普通技术人员会理解提供的编码全长sars-cov-2s蛋白的mrna构建体,可以对于用作或用于免疫原性组合物(例如,疫苗)实现如本文描述的免疫效果(例如,产生sars-cov-2中和抗体,和/或t细胞应答(例如,cd4
+
和/或cd8
+
t细胞应答)) 特别有用和/或有效。
[0130]
在一些实施方案中,本公开提供包含编码全长sars-cov-2s蛋白(例如,具有一个或多个氨基酸取代的全长sars-cov-2s蛋白)的rna(例如,mrna),所述rna适合多肽的细胞内表达。在一些实施方案中,这样的rna可以配制于脂质纳米颗粒(例如,本文描述的脂质纳米颗粒)中。
[0131]
在一些实施方案中,本文提供的免疫原性组合物可以包含sars-cov-2多肽或其变体的多个(例如,至少2个或更多个,包括,例如,至少3个,至少4个,至少5个,至少6个,至少7个,至少8个,至少9个,至少10个等)免疫原性表位。在一些这样的实施方案中,这样的多个免疫原性表位可以由单一rna(例如, mrna)编码。不希望受任何特定理论的束缚,在一些实施方案中,当考虑sars-cov
ꢀ‑
2变体的遗传多样性时,提供的多表位免疫原性组合物(包括,例如,编码全长 sars-cov-2刺突蛋白的组合物)可以特别用于提供针对多种病毒变体的保护和/或可以提供更大的机会来开发多样化和/或稳健的中和抗体和/或t细胞应答,特别是特别稳健的th1型t细胞(例如,cd4
+
和/或cd8
+
t细胞)应答。
[0132]
在一些实施方案中,本公开记录了提供的组合物和/或方法的特征在于它们用单一施用实现一种或多种特定治疗结果(例如,如本文描述的有效免疫应答和/或编码的sars-cov-2s蛋白的可检测表达)。
[0133]
在一些实施方案中,免疫应答可以包括产生针对sars-cov-2刺突蛋白的s1 亚基的结合抗体滴度。在一些实施方案中,免疫应答可以包括产生针对sars-cov
‑ꢀ
2病毒的中和抗体滴度。
[0134]
在一些实施方案中,中和抗体滴度是(例如,已建立为)相对于适当对照(例如,未疫苗接种的对照小鼠)所观察到的足以减少或阻断病毒与疫苗接种的小鼠血清结合的滴度。
[0135]
实施例
[0136]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0137]
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0138]
实施例1、新型冠状病毒mrna疫苗的制备
[0139]
一、s蛋白基因合成和载体构建
[0140]
1、s蛋白基因合成及优化
[0141]
本实施例中新型冠状病毒mrna疫苗的目标抗原为omicron变异病毒株的s蛋白全长(如seq id no.1所示),并在此基础上进行不同位点的组合突变,分别获得omicron s-2p
(k983p、v984p)和omicron s-6p(f814p、a889p、a896p、a939p、 k983p、v984p)。根据氨基酸序列,反推编码的核苷酸,由基因合成公司经过人源密码子优化及相关酶切位点排除后进行合成。
[0142]
seq id no.1为n端融合有分泌信号肽的omicron变异病毒株的s蛋白原始序列。其中,第1-16位为分泌信号肽,第17-1270位为omicron变异病毒株的s蛋白原始序列。
[0143]
seq id no.2为n端融合有分泌信号肽的omicron变异病毒株的s蛋白变体 omicron s-2p(k983p、v984p)序列。其中,第1-16位为分泌信号肽,第17-1270 位为omicron变异病毒株的s蛋白变体omicron s-2p序列,与seq id no.1相比,具有k983p和v984p这两个突变位点。以k983p为例,表示将seq id no.1的第983 位的氨基酸残基由k突变为p。其余突变位点表示法同理。
[0144]
seq id no.3为n端融合有分泌信号肽的omicron变异病毒株的s蛋白变体 omicron s-6p(f814p、a889p、a896p、a939p、k983p、v984p)序列。其中,第1-16 位为分泌信号肽,第17-1270位为omicron变异病毒株的s蛋白变体omicron s-6p 序列,与seq id no.1相比,具有f814p、a889p、a896p、a939p、k983p和v984p这六个突变位点。
[0145]
seq id no.4为经过人源密码子优化的seq id no.1对应的编码核苷酸序列。seqid no.5为经过人源密码子优化的seq id no.2对应的编码核苷酸序列。seq id no.6 为经过人源密码子优化的seq id no.3对应的编码核苷酸序列。
[0146]
2、重组载体构建
[0147]
将合成的序列[自5’端到3’端依次为:5’端带有xbai的t7启动子(seq idno.13)、5’utr(seq id no.7)、s蛋白或其变体的编码核苷酸序列(两端分别带有酶切位点bamhi和asci的seq id no.4、seq id no.5和seq id no.6)、3’utr(seqid no.8)及polya尾(5’端带有ecori,3’端带有sapi及noti的seq id no.9)] 进行xbai和noti双酶切,与经过xbai和noti酶切的puc57-gw-kan(金维智,载体全序列如seq id no.14所示)载体骨架片段进行连接反应,构建重组质粒。利用卡那抗生素进行单克隆平板初筛后,小提质粒并通过bamhi和asci限制性内切酶酶切法和dna测序进行阳性克隆验证。
[0148]
重组质粒puc57-s的结构描述为:在puc57-gw-kan(金维智)载体的酶切位点xbai 和noti之间克隆入合成序列[自5’端到3’端依次包括:t7启动子(seq id no.13)、 5’utr(seq id no.7)、s蛋白编码核酸(seq id no.4)、3’utr(seq id no.8) 及polya尾(seq id no.9)]的重组质粒。
[0149]
重组质粒puc57-s-2p的结构描述为:在puc57-gw-kan(金维智)载体的酶切位点 xbai和noti之间克隆入合成序列[自5’端到3’端依次包括:t7启动子(seq idno.13)、5’utr(seq id no.7)、s蛋白变体2p编码核酸(seq id no.5)、3’utr (seq id no.8)及polya尾(seq id no.9)]的重组质粒。
[0150]
重组质粒puc57-s-6p的结构描述为:在puc57-gw-kan(金维智)载体的酶切位点 xbai和noti之间克隆入合成序列[自5’端到3’端依次包括:t7启动子(seq idno.13)、5’utr(seq id no.7)、s蛋白变体6p编码核酸(seq id no.6)、3’utr (seq id no.8)及polya尾(seq id no.9)]的重组质粒。
[0151]
二、mrna的制备
[0152]
1、质粒线性化
[0153]
步骤一构建的重组质粒puc57-s、puc57-s-2p和puc57-s-6p,包含t7启动子、 5’utr(seq id no.7)、目的基因(即seq id no.4、seq id no.5和seq id no.6)、 3’utr(seq id no.8)以及polya尾序列(seq id no.9),在polya尾序列最后一个a后面有一个sapⅰ酶切位点。用限制性内切酶sapⅰ线性化含有目的基因的质粒,反应体系如表1所示,37℃酶切3h。
[0154]
表1、质粒线性化酶切体系
[0155]
10
×
cutsmart缓冲液5μlsapi酶(10000u/ml)1μl质粒10μgddh2o补齐至50μl
[0156]
取2μl酶切产物进行1%琼脂糖凝胶电泳,检测质粒的线性化情况。利用pcr 产物回收试剂盒(康维世纪)纯化线性化质粒。
[0157]
2、体外转录
[0158]
以步骤1获得的线性化重组质粒为模板进行体外转录,利用高产量t7 rna转录试剂盒进行体外转录。高产量t7 rna转录试剂盒,产品名称为high yield t7 rnasynthesis kit,上海兆维科技发展有限公司,产品目录号为on-040;5
×
reactionbuffer、100mm atp solution、100mm ctp solution、100mm gtp solution、enzymemix、dnase i、ammonium acetate stop solution、lithium chloride(licl) precipitation solution均为高产量t7 rna转录试剂盒中的组件。100mmψutpsolution,全称为n1-me-putp,100mm,上海兆维科技发展有限公司,产品目录号为 r5-027。按如下体系(表2)加入各组分(以20μl反应体系为例),混匀后37℃反应3h。
[0159]
表2、体外转录体系
[0160]5×
reaction buffer4μlatp(100mm)2μlψtp(100mm)2μlctp(100mm)2μlgtp(100mm)2μlenzyme mix1μl线性化dna模板500ng-1μgcleancap ag(100mm)1μl无核酸酶h2o补齐至20μl
[0161]
其中,cleancap ag为m7g(5’)ppp(5’)(2
’‑
omea)pg,货号为on-134,上海兆维。
[0162]
转录反应结束后,加入1μl dnase i,37℃反应15min,加入15μl ammoniumacetate stop solution,混匀。
[0163]
3、rna纯化
[0164]
向步骤2的体外转录反应体系中加入1/3体积的7.5m lithium chloride(licl) precipitation solution(使其终浓度为2.5m),-20℃放置30min。12000g离心 15min,rna沉淀在底部,弃掉上清。加入1ml 70%乙醇清洗rna,12000g离心5min,弃掉上清。晾干后加入50μl无rna酶的水溶解沉淀,并使用紫外分光光度计进行 mrna定量,得到加帽的体外转录mrna。其中,对应于omicron s蛋白的体外转录mrna 的具体序列如seq id no.10所示;对
应于omicron s-2p突变蛋白的体外转录mrna 的具体序列如seq id no.11所示;对应于omicron s-6p突变蛋白的体外转录mrna 的具体序列如seq id no.12所示。
[0165]
三、脂质纳米颗粒(lnp)包载
[0166]
将步骤二得到的三种mrna原液分别分散于20mm醋酸溶液(ph 5.0),得到mrna 浓度为200μg/ml的rna溶液。设置注射泵流速(mrna溶液的流速为9ml/min,脂质混合物的流速为3ml/min),同时启动注射泵,使mrna溶液与脂质混合物(配方见表 3)按3:1的体积比进行混合。然后用278mm蔗糖水溶液进行10倍稀释,经过超滤管 (millipore,ufc910096)离心浓缩后进行三次溶液置换(置换液:含2mm醋酸和 250mm蔗糖,余量为水)。
[0167]
将上述得到的溶液,加入1/24体积的tris水溶液(500mm,ph 7.0),得到lnp 包载的mrna溶液。lnp即脂质纳米颗粒。
[0168]
用ribogreen rna定量试剂盒(invitrogen,r11490)测定lnp包载的mrna浓度。游离rna直接取样测定,总rna用终浓度为1%triton x-100裂解后测定,计算三种lnp包载的mrna浓度分别为350μg/ml,500μg/ml和640μg/ml,包封率均在90%以上。用马尔文zetasizer粒径仪测量lnp包载的mrna的粒径,三种lnp包载的mrna均为60nm左右。实验同时设置没有包载任何物质的lnp作为对照。
[0169]
表3、脂质混合物配方
[0170]
物料名称母液浓度用量sm-10225mg/ml274.64μldspc25mg/ml61.12μl胆固醇25mg/ml115.14μldmg-peg200025mg/ml29.11μl无水乙醇 520μl
[0171]
四、s目标抗原的表达鉴定
[0172]
将293t细胞接种到六孔板中,24h后在细胞培养基中加入2μg步骤三获得的 lnp包载的mrna(按lnp包载的mrna中mrna的质量计算),进行细胞内表达。24h 后收集细胞,每孔细胞沉淀加入100μl 1
×
蛋白上样缓冲液于100℃金属浴中裂解变性30min。蛋白样品储存于-20℃或者-80℃。通过免疫印迹检测s蛋白的表达:取8μl蛋白裂解液进行10%sds-page电泳,分离蛋白样品。使用pvdf膜75v恒压湿法转膜1.2h后,5%脱脂牛奶室温封闭1h。先后与一抗(抗sars-cov-2s蛋白兔抗(义翘神州,货号40591-t62,1:1000)和二抗(山羊抗兔,1:5000)进行孵育,最后ecl显色。结果如图1所示,omicron s、omicron s-2p和omicron s-6p 三个mrna疫苗在细胞水平均能检测到s蛋白的表达,大小约为110-150kd,与预期一致。
[0173]
实施例2、不同新型冠状病毒mrna疫苗在小鼠模型上的免疫学评价
[0174]
一、疫苗体液免疫反应检测
[0175]
20只spf级雌性balb/c小鼠(6-8周龄),随机分成4组,每组5只。根据表4 所示分组情况对小鼠进行mrna疫苗的免疫,免疫途径为肌肉注射。
[0176]
表4、疫苗体液免疫反应检测小鼠分组情况
[0177]
候选疫苗剂量免疫方式小鼠数量omicron s5μg肌肉注射5omicron s-2p5μg肌肉注射5
omicron s-6p5μg肌肉注射5lnp5μg肌肉注射5
[0178]
注:候选疫苗omicron s、omicron s-2p和omicron s-6p分别为实施例1制备得到的lnp包载的omicron s mrna、omicron s-2p mrna和omicron s-6p mrna。lnp 为没有包载任何物质的空载lnp。“剂量”一栏均是以lnp包载的mrna中mrna的质量计算。
[0179]
初次免疫时每只小鼠后大腿内侧注射50μl体积的5μg mrna(以lnp包载的mrna 中mrna的质量计算),初次免疫后第14天加强免疫一次,剂量同初次免疫。眼眶取血时间分别为初次免疫后第7天,第14天,第21天和第28天。血样先置37℃灭活 1小时,4℃静置2小时,然后3000rpm离心10分钟分离血清,使用elisa试剂盒 (义翘神州,货号kit022)检测血清中的针对新型冠状病毒omicron株s1蛋白的igg 抗体滴度(图2)。
[0180]
小鼠肌肉注射lnp包载的mrna后第7天即可产生血清igg抗体,其中omicron s 组的抗体几何平均滴度(gmt)为31251,omicron s-2p组的抗体几何平均滴度为3356,omicron s-6p组的抗体几何平均滴度为40272。从免疫后第7天至免疫后第28天,血清抗体水平逐渐升高。对免疫后第28天3组rna疫苗注射诱导的血清igg总抗体滴度进行比较分析,如图3结果显示各组之间均无显著性差异(ns,p≥0.05)。
[0181]
二、疫苗细胞免疫反应检测
[0182]
免疫后28天处死小鼠,取脾置于70μm细胞尼龙滤网上,在2ml rpmi-1640完全培养基中充分研磨制成细胞悬液,计数后用培养基进行稀释,按每孔105或5
×
104个细胞接种到elispot板中,加入s蛋白重叠肽库(义翘神州,pp003)刺激培养20 小时,阳性对照孔加入佛波酯(pma)和ionomycin(离子霉素)阳性刺激剂,阴性对照孔不加刺激剂。使用不同抗体预包被的elispot板分别检测免疫小鼠的脾细胞经特异性肽刺激后表达ifn-γ和il-2的水平。
[0183]
各组mrna疫苗免疫小鼠后诱导的细胞免疫水平如图4和图5所示,其中lnp组为注射未包载mrna脂质颗粒的对照组。结果显示omicron s、omicron s-2p和omicrons-6p均可诱导其免疫小鼠产生明显的细胞免疫反应,三组疫苗之间没有显著性差异。
[0184]
三、疫苗中和抗体检测
[0185]
1、假型病毒的方法和结果
[0186]
在稳定过表达sars-cov-2主要受体ace2的hela-ace2细胞系(记载于“liu x, wei l,xu f,zhao f,huang y,fan z,mei s,hu y,zhai l,guo j,zheng a,cens,liang c,guo f.sars-cov-2spike protein-induced cell fusion activates thecgas-sting pathway and the interferon response.sci signal.2022apr 12;15(729):eabg8744.doi:10.1126/scisignal.abg8744.epub 2022apr 12.pmid: 35412852.”一文,公众可从申请人处获得,仅可用于重复本发明实验使用,不得他用)中检测免疫小鼠血清(步骤一得到的初次免疫后第28天的小鼠血清)针对 sars-cov-2omicron毒株假病毒的中和活性。假型病毒是以慢病毒为核心,萤火虫荧光素酶报告基因的ba.2株(诺唯赞,货号dd1796-02的产品“sars-cov2-flucba.2”)。将待检测的血清用dmem培养基进行2倍系列稀释,共稀释8个梯度,从1:128 起稀释至1:16384。在p2实验室中用dmem培养基将假病毒稀释至1
×
104tcid50/ml。取各梯度的血清与稀释好的病毒液混合,37℃,5%co2温箱中孵育1小时。将孵育好的病毒血清混合物按每孔100μl加入到预先接种的hela-ace2细胞板中,置于
37℃, 5%co2温箱中培养。48小时后,测定萤火虫荧光素酶活性,计算假病毒感染性,以抑制50%荧光素酶活性的血清最高稀释度的倒数为终点效价。结果如图6所示,omicrons组,omicron s-2p组,omicron s-6p组28天免疫血清对假型病毒中和抗体几何平均效价分别为895,4300,5760。
[0187]
2、对新冠病毒活毒的中和能力
[0188]
在vero-e6细胞上检测免疫小鼠血清(步骤一得到的初次免疫后第28天的小鼠血清)针对sars-cov-2的4个毒株(流行株,即新冠原始毒株gd108)、南非株、印度株和奥米克戎株)的中和抗体效价。将待检测的血清56℃灭活30分钟。用dmem 培养基进行2倍系列稀释,从1:8开始稀释。在p3实验室中根据病毒的原始滴度,用dmem培养基将病毒稀释至工作浓度。取稀释好的病毒液等倍体积与各稀释梯度的血清混合,37℃,5%co2温箱中孵育1小时。将孵育好的病毒血清混合物按每孔100μl 加入到悬浮vero-e6细胞板中,置于37℃,5%co2温箱中培养,每天观察cpe,5天后判定最终结果。以抑制50%细胞病变的血清最高稀释度的倒数为终点效价。该实验是在中国医学科学院医学生物学研究所的p3实验室进行的。
[0189]
各疫苗免疫血清针对流行株(gd108)、南非株、印度株和奥米克戎株的中和效价如表5所示。
[0190]
表5、疫苗的广谱中和活性(nt50)
[0191] 流行株南非株印度株奥米克戎株lnp32《824《8omicron s1289664512omicron s-2p641632768omicron s-6p2569632512
[0192]
综上所述,omicron s、omicron s-2p和omicron s-6p三个mrna疫苗均具有良好的免疫原性,可诱导小鼠产生高水平的血清igg抗体和特异性细胞免疫反应,并且产生的中和抗体对多种毒株具有交叉保护作用。
[0193]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1