一种Z-3-乙烯基取代的异吲哚啉酮类化合物的合成方法
一种z-3-乙烯基取代的异吲哚啉酮类化合物的合成方法
技术领域
1.本发明属于有机合成领域,具体涉及一种绿色简便的苯甲酰胺和苯氧乙腈制备z-3-乙烯基取代的异吲哚啉酮的合成方法。
背景技术:
2.异吲哚啉酮骨架广泛存在于药物分子、天然产物、生物活性分子以及功能分子中。随着金属有机化学的发展,过渡金属催化苯甲酰胺与偶联试剂反应制备异吲哚啉酮类化合物显示出了优异的步骤经济性,受到了合成化学家们的广泛关注。但是已报道的方法中,绝大多数都只实现了结构更为稳定的e-3-乙烯基异吲哚啉酮产物合成,而有关z式的3-乙烯基异吲哚啉酮骨架制备的报道很少。鉴于近年来过渡金属催化腈类化合物的官能团转化为含氮杂环化合物的构筑提供了便利。本发明巧妙地将过渡金属催化惰性碳氢键的官能团化与腈类底物的转化有效结合,实现了铑催化苯甲酰胺的c-h键活化并对氰基的亲核加成,经由后续的串联和消除反应历程完成一步制备z式的3-乙烯基取代的异吲哚啉酮的目标产物。本发明以简单易制备的n-甲氧基苯甲酰胺和苯氧乙腈为底物,五甲基环戊二烯二氯化铑的二聚体作为催化剂,碳酸钠作为碱,在六氟异丙醇的反应溶剂中,在130-150℃空气的反应氛围下,通过搅拌反应12 小时,能够顺利合成z-3-乙烯基取代的异吲哚啉酮类化合物。该转化无需额外的氧化剂、配体和路易斯酸,并具有优异的立体选择性,为不同官能团取代的z-3-乙烯基取代的异吲哚啉酮类化合物的合成提供了一种绿色环保且高效的合成新方法。
技术实现要素:
3.本发明提供了一种绿色简便的铑催化n-甲氧基苯甲酰胺与苯氧乙腈底物经由串联环合反应制备z-3-乙烯基取代的异吲哚啉酮类化合物的合成方法,该合成方法官能团兼容性好、化学选择性好,反应活性高。
4.一种简单绿色、高效的z-3-乙烯基取代的异吲哚啉酮类化合物的合成方法,包括如下步骤:将n-甲氧基苯甲酰胺化合物、苯氧乙腈化合物、铑催化剂、碳酸钠加入到有机溶剂中,空气条件下加热到130-150℃进行反应,反应12h,反应完全后,后处理(萃取以及柱层色谱分离)得到相应的z-3-乙烯基取代的异吲哚啉酮类化合物;
5.所述的n-甲氧基苯甲酰胺化合物的结构如式(ii)所示:
[0006][0007]
所述的苯氧乙腈化合物的结构如式(iii)所示:
[0008][0009]
所述的z-3-乙烯基取代异吲哚啉酮类化合物的结构如式(i)所示:
[0010][0011]
式(i)~(iii)中,r1选自h、c1~c5烷基、c1~c5烷氧基、二甲氨基、卤素等;r2选自h、c1~c5烷氧基、c1~c5烷基、卤素、萘基、乙酰氨基或杂环基;
[0012]
本发明中,直接利用简单易制备、稳定的苯甲酰胺和苯氧乙腈作为反应底物,在无氧化剂、配体、路易斯酸存在的条件下,经由铑催化惰性碳氢键活化、c-h键对氰基的亲核加成、环化反应和消除等一系列历程转化顺利地实现一步法制备z-3-乙烯基取代的异吲哚啉酮类化合物。
[0013]
作为优选,所述的有机溶剂为六氟异丙醇。
[0014]
作为优选,反应温度为130-150℃,反应时间为12小时。
[0015]
同现有技术相比,本发明的有益效果体现在:
[0016]
(1)现有的3-乙烯基取代的异吲哚啉酮制备大都局限于更为稳定的 e式构型产物的制备。本发明高选择性地实现了z-3-乙烯基取代的异吲哚啉酮类化合物。
[0017]
(2)本发明反应条件简单,在无氧化剂、配体和路易斯酸等添加剂的存在下就能以较为优异的收率实现z-3-乙烯基取代的异吲哚啉酮类产物的制备。
[0018]
(3)本发明的合成方法操作简便,具有优异的立体选择性和反应活性,并且可以将本发明应用于药物活性的反应底物的后期修饰。
附图说明
[0019]
图1为实施例1得到的化合物的氢谱和碳谱谱图;
[0020]
图2为实施例2得到的化合物的氢谱和碳谱谱图;
[0021]
图3为实施例3得到的化合物的氢谱和碳谱谱图;
[0022]
图4为实施例4得到的化合物的氢谱和碳谱谱图;
[0023]
图5为实施例5得到的化合物的氢谱和碳谱谱图;
[0024]
图6为实施例6得到的化合物的氢谱和碳谱谱图;
[0025]
图7为实施例7得到的化合物的氢谱和碳谱谱图;
[0026]
图8为实施例8得到的化合物的氢谱和碳谱谱图;
[0027]
图9为实施例9得到的化合物的氢谱和碳谱谱图;
[0028]
图10为实施例10得到的化合物的氢谱和碳谱谱图;
[0029]
图11为实施例11得到的化合物的氢谱和碳谱谱图;
[0030]
其中,氢谱在500mhz核磁仪器上进行测试。碳谱在125mhz核磁仪器上进行测试。测试条件均为室温下使用四甲基硅烷作内标,样品用氘代氯仿或氘代二甲基亚砜溶解。
具体实施方式
[0031]
下面结合具体实施例对本发明做进一步的描述,以下具体实施例都是本发明的最优实施方式。
[0032]
实施例1~11
[0033]
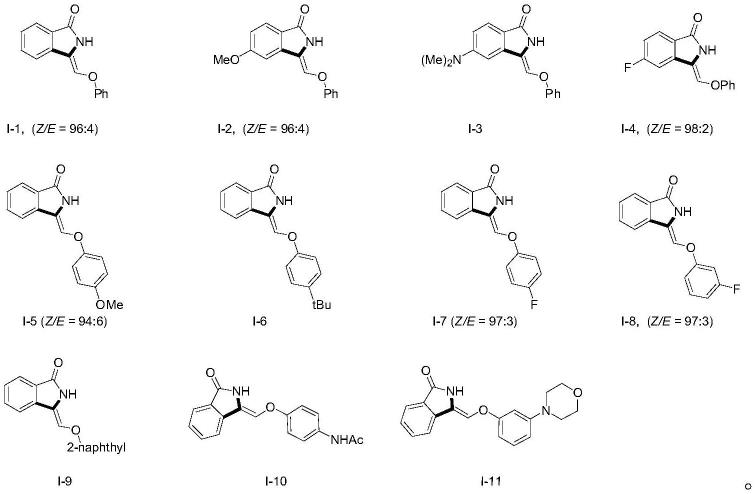
按照表1的原料配比在25ml封管中加入n-甲氧基苯甲酰胺化合物(ii,0.2mmol)、苯氧乙腈类底物(iii,0.4mmol)、五甲基环戊二烯二氯化铑的二聚体催化剂(0.01mmol)、碳酸钠(0.2mmol),有机溶剂六氟异丙醇(1ml),混合搅拌均匀,在空气氛围下,在油浴(130-150℃)下反应12h。按照表2的反应条件反应完成后,冷却,萃取收集有机相并用硫酸钠干燥,硅胶拌样,经过柱层析纯化得到相应的z-3-乙烯基取代的异吲哚啉酮类化合物(i),反应过程如下式所示:
[0034][0035]
表1实施例1~11的原料配比
[0036][0037]
表2实施例1~11的反应条件和反应结果
[0038][0039][0040]
表1和表2中,t为反应温度,t为反应时间。
[0041]
实施例1~11制备得到部分化合物的结构确认数据:
[0042][0043]
(z)-3-(phenoxymethylene)isoindolin-1-one(i-1)
[0044]
yellowsolid(35.6mg,75%;z/e=96:4).mp:152-153℃.columnchromatographyonsilicagel(eluent:petroleumether/ethylacetate,5/1).1hnmr(500mhz,dmso-d6)δ10.83(s,1h),7.99(d,j=7.5hz,1h),7.74(d,j=7.5hz,1h),7.63(t,j=7.5hz,1h),7.59(s,1h),7.48(t,j=7.5hz,1h),7.43(t,j=8.0hz,2h),7.28(d,j=8.0hz,2h),7.15(t,j=7.0hz,1h).
13
cnmr(125mhz,dmso-d6)δ167.2,157.0,137.0,132.1,130.4,129.3,128.4,124.6,123.8,123.3,121.7,120.4,116.8.hrms(esi-tof)m/z:[m+h]
+
calcdforc
15h12
no2238.0863;found238.0848.
d6)δ166.2,165.1(c-f,j
c-f
=245.1hz),156.8,139.4(c-f,j
c-f
=7.8hz),130.4,125.8(c-f,j
c-f
=6.1hz),125.7,124.0,120.8,116.8,116.2(c-f,j
c-f
=24.1hz),107.3,107.1.hrms(esi-tof)m/z:[m+h]
+
calcdforc
15h11
fno2256.0768;found256.0778.
[0054][0055]
(z)-3-((4-methoxyphenoxy)methylene)isoindolin-1-one(i-5)
[0056]
yellowsolid(39mg,73%;z/e=94:6).mp:155-156℃.columnchromatographyonsilicagel(eluent:petroleumether/ethylacetate,5/1).1hnmr(500mhz,cdcl3)δ8.52(s,1h),7.89(d,j=7.5hz,1h),7.59-7.51(m,2h),7.42(t,j=7.0hz,1h),7.06(d,j=9.0hz,2h),6.88(d,j=8.0hz,3h),3.79(s,3h).
13
cnmr(125mhz,cdcl3)δ167.2,156.1,151.0,136.3,131.8,129.0,128.0,125.1,124.0,120.7,118.7,117.8,114.9,55.7.hrms(esi-tof)m/z:[m+h]
+
calcdforc
16h14
no3268.0968;found268.0965.
[0057][0058]
(z)-3-((4-(tert-butyl)phenoxy)methylene)isoindolin-1-one(i-6)
[0059]
yellowsolid(36.3mg,62%).mp:160-161℃.columnchromatographyonsilicagel(eluent:petroleumether/ethylacetate,5/1).1hnmr(500mhz,cdcl3)δ8.23(s,1h),7.89(d,j=7.5hz,1h),7.57(t,j=8.5hz,2h),7.44(t,j=7.0hz,1h),7.39(d,j=9.0hz,2h),7.07(d,j=8.5hz,2h),6.94(s,1h),1.33(s,9h).
13
cnmr(125mhz,cdcl3)δ167.1,154.7,147.0,136.2,131.9,129.0,128.1,126.7,124.3,124.0,121.1,118.7,116.1,34.4,31.5.hrms(esi-tof)m/z:[m+na]
+
calcdforc
19h19
nano2316.1308;found316.1299.
[0060]
[0061]
(z)-3-((4-fluorophenoxy)methylene)isoindolin-1-one(i-7)
[0062]
yellowsolid(35.7mg,70%;z/e=97:3).mp:112-113℃.columnchromatographyonsilicagel(eluent:petroleumether/ethylacetate,5/1).1hnmr(500mhz,dmso-d6)δ10.81(s,1h),7.97(d,j=8.0hz,1h),7.73(d,j=7.5hz,1h),7.63(t,j=7.0hz,1h),7.54(s,1h),7.48(t,j=7.5hz,1h),7.33-7.25(m,4h).
13
cnmr(125mhz,dmso-d6)δ167.2,158.5(c-f,j
c-f
=237.5hz),153.3,136.9,132.2,129.3,128.5,124.9,123.3,121.7,120.4,118.4(c-f,j
c-f
=8.4hz),116.8(c-f,j
c-f
=23.2hz).hrms(esi-tof)m/z:[m+h]
+
calcdforc
15h11
fno2256.0768;found256.0772.
[0063][0064]
(z)-3-((3-fluorophenoxy)methylene)isoindolin-1-one(i-8)
[0065]
yellowoil(31.1mg,61%;z/e=97:3).columnchromatographyonsilicagel(eluent:petroleumether/ethylacetate,5/1).1hnmr(500mhz,dmso-d6)δ10.84(s,1h),7.99(d,j=8.0hz,1h),7.74(d,j=7.5hz,1h),7.67-7.61(m,2h),7.51-7.44(m,2h),7.21(d,j=10.5hz,1h),7.12(d,j=8.0hz,1h),6.99(t,j=7.5hz,1h).
13
cnmr(125mhz,dmso-d6)δ167.2,163.3(c-f,j
c-f
=242.9hz),158.0(c-f,j
c-f
=11.0hz),136.8,132.2,131.7(c-f,j
c-f
=9.9hz),129.4,128.7,123.7,123.4,122.3,120.6,112.9,110.3(c-f,j
c-f
=21.2hz),104.1(c-f,j
c-f
=25.2hz).hrms(esi-tof)m/z:[m+h]
+
calcdforc
15h11
fno2256.0768;found256.0775.
[0066][0067]
(z)-3-((naphthalen-2-yloxy)methylene)isoindolin-1-one(i-9)
[0068]
yellowsolid(38mg,66%).mp:101-102℃.columnchromatographyonsilicagel(eluent:petroleumether/ethylacetate,5/1).1hnmr(500mhz,dmso-d6)δ10.90(s,1h),8.05(d,j=8.0hz,1h),7.99(d,j=9.0hz,1h),7.92(t,j=9.0hz,2h),7.78-7.75(m,3h),7.66(t,j=7.5hz,1h),7.54(t,j=7.5hz,1h),7.51(t,j=7.5hz,1h),7.48-7.43(m,2h).
13
cnmr(125mhz,dmso-d6)δ167.2,154.8,136.9,134.3,132.2,130.4,130.2,129.4,128.6,128.2,127.5,127.3,125.2,124.3,123.4,122.2,120.5,118.8,110.8.hrms(esi-tof)m/z:[m+h]
+
calcdforc
19h14
no2288.1019;found288.1020.
[0069][0070]
(z)-n-(4-((3-oxoisoindolin-1-ylidene)methoxy)phenyl)acetamide(i-10)
[0071]
yellowsolid(41.2mg,70%);mp:156-157℃.1hnmr(500mhz,dmso-d6)δ10.80(s,1h),9.98(s,1h),7.96(d,j=8.0hz,1h),7.73(d,j=7.5hz,1h),7.62(t,j=8.5hz,3h),7.51(s,1h),7.46(t,j=7.5hz,1h),7.21(d,j=9.0hz,2h),2.05(s,3h).
13
cnmr(125mhz,dmso-d6)δ168.6,167.2,152.6,137.0,135.5,132.1,129.2,128.3,125.2,123.3,121.2,120.9,120.3,117.0,24.3.hrms(esi-tof)m/z:[m+h]
+
calcdforc
17h15
n2o3295.1077;found295.1074.
[0072][0073]
(z)-3-((3-morpholinophenoxy)methylene)isoindolin-1-one(i-11)
[0074]
yellowoil(20mg,31%);1hnmr(500mhz,dmso-d6)δ10.77(s,1h),7.99(d,j=8.0hz,1h),7.73(d,j=7.5hz,1h),7.62(t,j=7.0hz,1h),7.55(s,1h),7.47(t,j=7.5hz,1h),7.25(t,j=8.0hz,1h),6.78(s,1h),6.78-6.69(m,2h),3.75(s,4h),3.15(s,4h).
13
cnmr(125mhz,dmso-d6)δ167.1,158.0,153.1,137.0,132.1,130.5,129.3,128.3,124.9,123.3,121.2,120.4,110.6,107.2,103.4,66.5,48.7.hrms(esi-tof)m/z:[m+na]
+
calcdforc
19h18
n2o3na345.1210;found345.1220。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1