贝莱斯芽孢杆菌JBNH101及其培养基、发酵产物制备方法、制剂与应用与流程
贝莱斯芽孢杆菌jbnh 101及其培养基、发酵产物制备方法、制剂与应用
技术领域
1.本发明涉及微生物技术领域,具体涉及贝莱斯芽孢杆菌jbnh 101及其培养基、发酵产物制备方法、制剂与应用。
背景技术:
2.多年以来,国内种植业由于复种指数高、化学农药的不合理使用、肥料过量施用等问题,造成耕地质量下降、土壤中病原菌的数量和种类不断增加、病原菌耐药性增强,导致土传真菌、细菌等病害频发、混发。每年都会给全国范围内的粮食、果蔬、中药材等生产造成巨大的经济损失。探索更加安全、有效、可持续的土传真菌、细菌病害的防治方法成为行业迫切需要解决的难题。生物防治具有绿色环保,安全高效等特点,符合农业可持续发展的要求。
3.芽孢杆菌属由于能够产生多种抑菌活性代谢物、促生物质、有益酶类,以及具备易定殖、抗逆性强等特点,在植物防病促生制剂的研究和开发中占有重要地位。枯草芽孢杆菌、多粘类芽孢杆菌、解淀粉芽孢杆菌等已作为生物防治菌株实现商业化生产和应用。
4.然而,尽管国内外一些生物杀菌剂已实现应用,但本领域仍需要针对靶标病害和病原体的特异性,继续寻找、开发更加有效的生物防治产品。同时,考虑到菌剂产品容易受到各种生物和非生物因素的影响,需要稳定和改良其功效。
技术实现要素:
5.针对现有技术中存在的上述不足,本发明提供一种莱斯芽孢杆菌jbnh 101及其培养基、发酵产物制备方法、制剂与应用,以解决上述技术问题。本发明通过提供一种贝莱斯芽孢杆菌突变株及应用方法用于预防和减轻植物病害,尤其是土传真菌病害和细菌病害,来满足本领域的需求。本发明的贝莱斯芽孢杆菌jbnh 101能够有效的提高了表面活性素(surfactin)、丰原素(fengycin)的产量,同时能产生壳聚糖酶来抑制病原菌的生长。
6.第一方面,本发明提供一种贝莱斯芽孢杆菌(bacillus velezensis)jbnh 101;其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为cgmcc no.25034,保藏日期为2022年06月10日,保藏机构地址:北京市朝阳区北辰西路1号院3号。
7.一种用于贝莱斯芽孢杆菌jbnh 101的发酵培养基,所述的发酵培养基包括重量百分比的以下物质:蔗糖1.0%~7.0%,豆饼粉水解物1.0%~4.0%,l-亮氨酸0.3%~2.0%,k2hpo4·
3h2o 0.5%~1.5%,mgso4·
7h2o 0.05%~0.075%,mnso4·
h2o 0.1%~1.0%,feso
4 0.01%~0.12%,其余为水。
8.优选的,所述的培养基为:蔗糖4.0%,豆饼粉水解物2.0%,l-亮氨酸0.5%,k2hpo4·
3h2o 0.8%,mgso4·
7h2o 0.075%,mnso4·
h2o 0.2%,feso
4 0.07%,其余为水。
9.第二方面,本发明提供一种贝莱斯芽孢杆菌jbnh 101的培育方法,包括以下步骤:
10.挑取一环斜面菌种接种于20ml lb种子培养基,在35℃~40℃,150~200rpm条件
下过夜培养制备种子液。然后按照2%~10%接种量将种子液接种至灭菌的200ml发酵培养基中(摇瓶容积1000ml),在相同条件下发酵48~72h,获得贝莱斯芽孢杆菌jbnh 101发酵液。
11.第三方面,本发明提供一种贝莱斯芽孢杆菌jbnh 101在制备脂肽和/或壳聚糖酶中的应用。
12.一种脂肽的制备方法,将贝莱斯芽孢杆菌jbnh 101接种于培养基中进行发酵,从发酵液中分离得到所述的脂肽。
13.优选的,所述脂肽包括表面活性素(surfactin)和丰原素(fengycin)。
14.一种壳聚糖酶的制备方法,将贝莱斯芽孢杆菌jbnh 101接种于培养基中进行发酵,从发酵液中分离、纯化得到所述的壳聚糖酶。
15.所述壳聚糖酶为一种内切酶,它能将胶体壳聚糖水解成聚合度为2~20的低聚糖。
16.第四方面,本发明提供了一种贝莱斯芽孢杆菌jbnh 101在防治作物根部真菌病害、细菌病害中的应用。
17.优选的,所述真菌包括但不限于尖孢镰刀菌(fusarium oxysporum)、腐皮镰刀菌(fusarium solani)、丝核菌(rhizoctinia)灰葡萄孢(botrytis cinerea)、大丽轮枝菌(verticillium dahliae)、葱鳞葡萄孢(botrytis squamosa)、禾谷镰刀菌(fusarium graminearum)、枝状镰刀菌(fusarium virguliforme)、蔓延疫霉(phytophthora infestans)、寄生疫霉(phytophthora parasitica)、大豆疫霉(phytophthora sojae)、辣椒疫霉(phytophthora capsici)、肉桂疫霉(phytophthora cinnamon)、烟草疫霉(phytophthora nicotianae)、核盘菌(sclerotinia sclerotiorum)、小核盘菌(sclerotinia minor)、银斑核盘菌(sclerotinia homeocarpa)、黄曲霉(aspergillus favus)及其任意组合。所述细菌,包括但不限于假单胞菌(pseudomonas spp.)、茄科雷尔氏菌(ralstonia solanacearum)、欧文氏菌属(erwinia spp.)、黄单胞菌属(xanthomonas spp.)。
18.所述作物选自草莓、西瓜、番茄、辣椒、黄瓜、苹果、芦笋、浆果、香蕉、柑桔、奇异果、甜瓜、桃、梨、菠萝、仁果、石榴、芹菜、洋葱、蒜、葡萄、绿花椰菜、甘蓝、花椰菜、葫芦、马铃薯、小麦、水稻或大豆。
19.第五方面,本发明提供了一种包含贝莱斯芽孢杆菌jbnh 101和/或贝莱斯芽孢杆菌jbnh 101发酵产物的植物病害生防制剂。
20.本发明的有益效果为:
21.(1)本发明贝莱斯芽孢杆菌jbnh 101高产表面活性素(surfactin)和丰原素(fengycin),产量较原始菌株贝莱斯芽孢杆菌jbnh-01分别提高了4.3倍、2.7倍。在优化的发酵培养基中,表面活性素产量可达5.5g/l、丰原素产量可达1.9g/l、壳聚糖酶酶活达到217u/ml。
22.(2)本发明的贝莱斯芽孢杆菌jbnh 101代谢产物表面活性素(surfactin)、丰原素(fengycin)和壳聚糖酶存在协同增效作用。
23.(3)本发明的贝莱斯芽孢杆菌jbnh 101及其代谢物能够抑制多种作物致病菌,病害防治效果突出。
附图说明
24.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
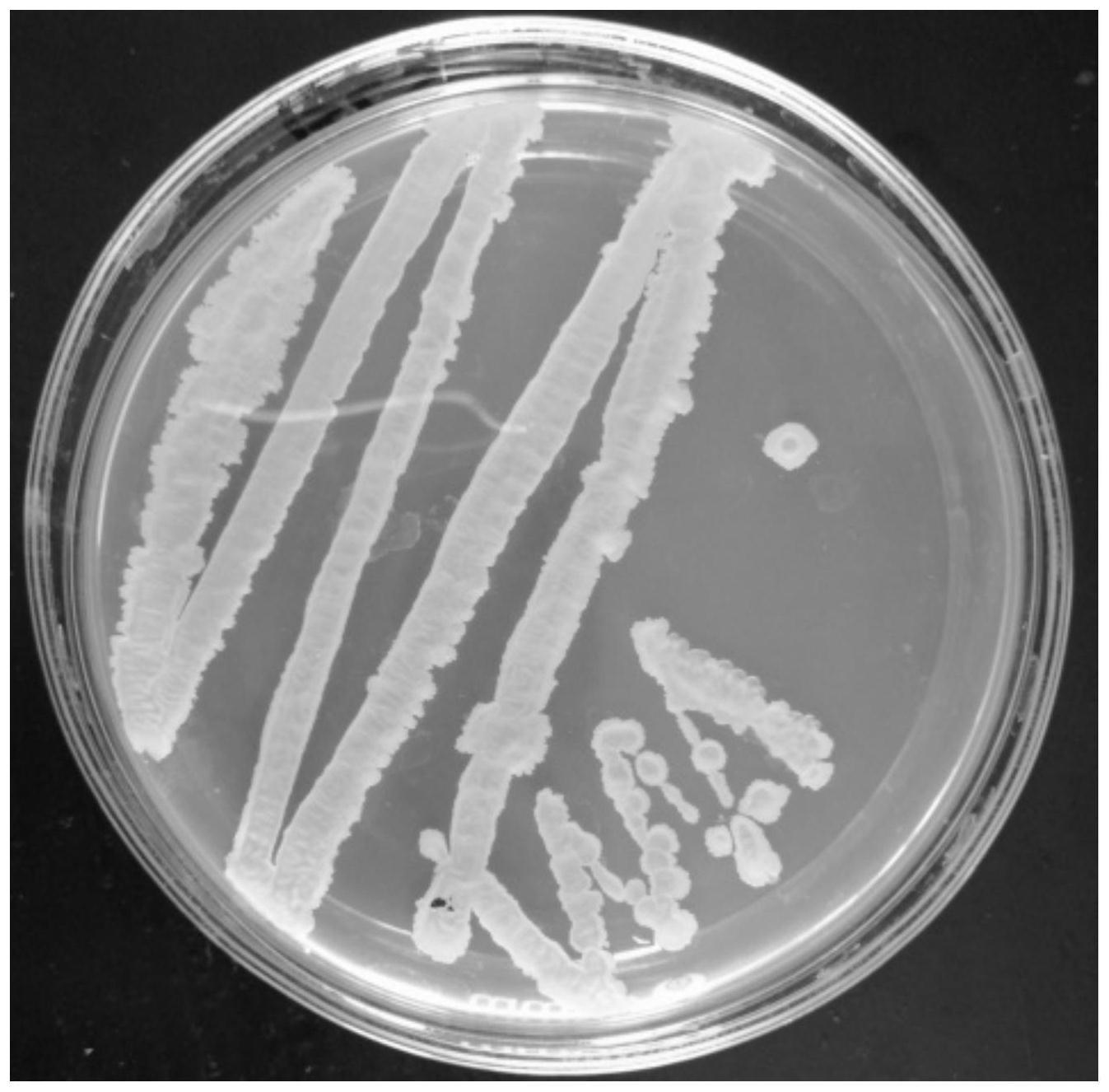
25.图1是本发明贝莱斯芽孢杆菌jbnh 101的菌落图。
26.图2是本发明贝莱斯芽孢杆菌jbnh 101与市售产品对七种枯萎病病原菌的平板拮抗效果对比图。图中,a为贝莱斯芽孢杆菌jbnh 101;b和c为市售产品,其中b中有效成分为枯草芽孢杆菌,c中有效成分为荧光假单胞菌;1-黄瓜枯萎病原菌;2-西瓜枯萎病原菌;3-香蕉枯萎病原菌;4-棉花枯萎病原菌;5-番茄枯萎病原菌;6-花椰菜枯萎病原菌;7-甜叶菊枯萎病原菌。
27.图3是本发明贝莱斯芽孢杆菌jbnh 101发酵制备的两种脂肽对黄瓜角斑病原菌的抑制能力对比图。图中,d为表面活性素(100ppm);e为空白对照;f为丰原素(100ppm)。
28.图4是本发明贝莱斯芽孢杆菌jbnh 101发酵制备的两种脂肽对番茄青枯病原菌的抑制能力对比图。图中,d为表面活性素(100ppm);e为空白对照;f为丰原素(100ppm)。
29.图5是本发明实施例4制备得到的壳寡糖样品离子色谱图谱。
30.图6是本发明实施例5中不同浓度壳聚糖酶对西瓜枯萎病原菌菌丝生长的抑制效果图。图中,g为0.01μg/ml;h为0.1μg/ml;i为0.5μg/ml;j为2.0μg/ml;k为5.0μg/ml。
31.图7是本发明实施例8中不同处理组番茄生长状况比较示意图。图中,l为清水对照;m为实施例7制备的制剂;n为化学药剂(多菌灵)。
32.图8是本发明贝莱斯芽孢杆菌jbnh 101的广谱抑菌实验图一。
33.图9是本发明贝莱斯芽孢杆菌jbnh 101的广谱抑菌实验图二。
34.图10是本发明贝莱斯芽孢杆菌jbnh 101的广谱抑菌实验图三。
35.图11是本发明贝莱斯芽孢杆菌jbnh 101的广谱抑菌实验图四。
36.图12是本发明贝莱斯芽孢杆菌jbnh 101的广谱抑菌实验图五。
37.图13是本发明贝莱斯芽孢杆菌jbnh 101的广谱抑菌实验图六。
具体实施方式
38.为了使本技术领域的人员更好地理解本发明中的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
39.实施例1
40.贝莱斯芽孢杆菌jbnh 101的原始菌株贝莱斯芽孢杆菌jbnh-01的筛选
41.1.采样地点
42.采样地点为山东省滨州市博兴县店子镇温室草莓大棚发病地块。选取长势良好、发病较轻的草莓植株,采集根部土壤。
43.2.菌株的分离、纯化
44.(1)于采样地点采集病害土壤1000g,带回实验室,作为土壤样品。
45.(2)将土样混合均匀,缩分后称取10g土壤样品,将其添加至装有90ml无菌水的三角瓶中,然后将三角瓶置于180r/min、37℃的恒温摇床中培养30min,获得样品悬浮液。
46.(3)取1ml步骤(2)获得的样品悬浮液,按照10倍比例梯度稀释后,获得10-1
、10-2
、10-3
、10-4
、10-5
和10-6
倍的样品稀释液。
47.(4)分别取步骤(3)获得的10-3
、10-4
、10-5
和10-6
倍的样品稀释液100μl涂布于lb固体培养基平板上,并将涂布后的lb固体培养基平板置于37℃的恒温培养箱中培养48h;培养后lb固体培养基平板上有菌落生长。
48.(5)挑取步骤(4)的lb固体培养基平板上生长的单菌落,划线转移至新的lb固体培养基平板上,并将划线后的lb固体培养基平板置于37℃的恒温培养箱中培养48h;观察培养后的lb固体培养基平板中只有一种菌落形态,则表明分离纯化完成;将分离纯化完成后的lb固体培养基平板置于4℃的条件下保存,备用。
49.通过上述对土壤样品中菌株的分离、纯化,共获得5种不同形态的菌株。
50.3.菌株的筛选
51.(1)分别将分离、纯化获得的5种菌株活化,接种至相应的lb液体培养基中,并将接种后的lb液体培养基置于180r/min、37℃的恒温摇床中培养48h;培养后lb液体培养基中菌株od600达到2.0以上,得到5种菌株的被测试菌液。
52.(2)利用对峙生长法筛选抗性菌株
53.a.将草莓根腐病病原菌置于pda固体培养基平板上活化(28℃培养96h),获得活化后的病原菌平板。
54.b.利用打孔器从活化后的病原菌平板边缘取样,获得病原菌菌块,并将病原菌菌块置于空白pda固体培养基平板的中央;然后在距离pda固体培养基平板中央20mm处用打孔器平行打出2个小孔,并向其中一个小孔加入20μl活化后的被测试菌液,作为检测样,向另一个小孔加入20μl无菌pda液体培养基,作为对照样;将上述pda固体培养基平板置于37℃的恒温培养箱中培养96h;若培养后的pda固体培养基平板上出现抑菌带,则表明该菌株为草莓根腐病原菌抗性菌株。
55.分别利用上述步骤对步骤(1)获得的被测试菌液进行筛选,通过培养后pda固体培养基平板上是否产生拮抗带以及产生的拮抗带宽度,对5种菌株的抗菌能力进行初步判定。
56.经过筛选,最终获得一株拮抗带宽度超过7mm的菌株,命名为jbnh-01,经16s rdna鉴定,其为贝莱斯芽孢杆菌(bacillus velezensis)。该菌株对草莓根腐等病原菌表现出明显的抑制作用。将菌株jbnh-01利用lb液体培养基培养后,-80℃甘油保藏(甘油浓度30%)
57.实施例2
58.贝莱斯芽孢杆菌jbnh-01诱变贝莱斯芽孢杆菌jbnh 101的方法
59.所述的贝莱斯芽孢杆菌jbnh 101是经artp诱变选育得到,具体方法如下:
60.1.菌悬液的制备
61.将在4℃冰箱平板上保存的菌株经液体lb培养基活化后,再接入50ml lb培养基中,在37℃、180r/min的摇床中培养12h,在12000r/min条件下离心5min,去除上清液,收集菌体,生理盐水清洗2~3次后,再用10%无菌甘油溶液稀释菌液浓度为106~108cfu/ml,用平板计数法测定菌液浓度。
62.2.菌株诱变
63.吸取10μl步骤(1)制得的菌液,均匀涂于无菌金属载片表面,利用无菌镊子将载片放于artp系统操作室的旋转台上的对应孔位,调整照射距离2mm,气流量10l/min,输出功率为120w,进行诱变,分别处理0、10、20、30、40、50、60、70和100s,诱变结束后,将载片放置于装有1ml无菌生理盐水的1ml离心管中,剧烈振荡,将菌液洗脱下来,稀释适当的倍数,分别取100μl涂布于lb固体培养基上,每个诱变时长做三个平行,进行活菌计数,计算致死率,并获取致死曲线,致死率公式如下式(ⅰ):
[0064][0065]
式(ⅰ)中:t为artp处理0s时的菌落数(未处理的总菌落数);a为artp处理后存活的菌落数。
[0066]
结果显示,随着诱变处理时间的增加,菌体的致死率逐渐升高,诱变时间为30s时致死率为63.18%,60s时致死率高达93.24%,100s时致死率达到100%。鉴于artp诱变的安全高效及多样性,结合前期经验数据,本实验把致死率到达80%~90%作为诱变依据,确定最适诱变时间为50s,该条件下致死率为85.33%。
[0067]
3.诱变菌株的筛选
[0068]
在上述最适诱变条件下,挑取生长较好的诱变株,通过平板对峙法进行初筛。所用待测液为不含菌的发酵粗提液。制备方法如下:将接种到平板上的诱变菌株转接到50ml液体lb培养基中,在37℃、180r/min的摇床中培养48h,在12000r/min条件下,离心5min,收获上清液并经0.22μm细菌过滤器过滤除菌,获得不含菌体的待测液。以拮抗带宽大于贝莱斯芽孢杆菌jbnh-01 5%作为正突变株筛选标准。
[0069]
表1-诱变子筛选正突变统计
[0070]
序号正突变幅度/%序号正突变幅度/%序号正突变幅度/%36.32
±
0.22555.77
±
0.1315722.08
±
0.6245.89
±
0.176217.21
±
0.5417316.37
±
0.4375.52
±
0.236612.64
±
0.4717421.90
±
0.85810.15
±
0.347721.68
±
0.7117825.39
±
0.76127.26
±
0.19818.73
±
0.2418129.16
±
0.77148.57
±
0.328216.55
±
0.4918223.54
±
0.63159.27
±
0.429423.81
±
0.6318326.51
±
0.691611.16
±
0.33975.77
±
0.261935.47
±
0.32215.98
±
0.2510137.18
±
0.582007.93
±
0.41256.37
±
0.1610619.66
±
0.4920712.76
±
0.632615.44
±
0.5211118.07
±
0.6121913.09
±
0.26306.81
±
0.2611520.09
±
0.8422018.73
±
0.563712.57
±
0.2912111.36
±
0.4922522.85
±
0.67439.55
±
0.641267.52
±
0.3722723.06
±
0.494818.33
±
0.471399.11
±
0.7123017.39
±
0.71
5013.29
±
0.4615219.02
±
0.5723510.06
±
0.43
[0071]
共挑选诱变菌株237株,其中正突变株48株,正突变幅度超过15%的菌株有22株,正突变幅度超过25%的有4株。所有48株正突变株进入复筛。将进入复筛的诱变株与初始菌株在相同条件下培养后离心取上清,过滤除菌后作为抑菌粗提液。采用预加孢子液平板扩散法进行复筛。具体操作如下:
[0072]
(1)挑取在pda平板上活化的草莓根腐病菌丝少许,接种于pda液体培养基中,28℃、160rpm培养6d,用灭菌纱布滤去培养液中的菌丝,用无菌水调整孢子浓度为1
×
105cfu/ml备用。
[0073]
(2)吸取制备好的草莓根腐病原菌孢子悬浮液(1
×
105cfu/ml)1ml,加入融化并冷却到45℃左右的pda固体培养基中,混匀,倾倒平板。
[0074]
(3)待冷却凝固后等距打孔,在不同的孔内分别加入各供试菌株抑菌粗提液20μl,以lb液体培养基作为空白对照,每个处理设置3个重复,28℃培养48h后测量诱变株和原始菌株抑菌圈直径,计算正突变幅度。计算公式如下式(ⅱ):
[0075][0076]
式(ⅱ)中:d为诱变菌株抑菌圈直径;d0为初始菌株jbnh-01抑菌圈直径。
[0077]
经过复筛,正突变幅度大于15%的菌株有7株,其中101号正突变幅度最大,达到52.7%,将101号突变株命名为贝莱斯芽孢杆菌jbnh 101,其在lb琼脂培养基上的菌落形态见图1。
[0078]
按照实施例1的对峙生长法考察贝莱斯芽孢杆菌jbnh 101与两种市售产品对七种枯萎病病原菌的拮抗效果,结果见图2。由图2可知,贝莱斯芽孢杆菌jbnh 101对七种病原菌的抑制效果明显优于两种同类市售产品。
[0079]
四、发酵液中抑菌物质的分离、鉴定
[0080]
对贝莱斯芽孢杆菌jbnh 101进行发酵培养:将在4℃平板上保存的贝莱斯芽孢杆菌jbnh-01和贝莱斯芽孢杆菌jbnh 101分别接种到20ml液体lb培养基中,37℃、180rpm培养12h,得到种子液。分别取种子液5ml,接种到装有100ml液体lb培养基的1000ml三角瓶中(每个菌株三个平行),37℃、180rpm振荡培养48h,获得发酵液。发酵液8000rpm离心10min后收集清液,然后经0.22μm滤器过滤,获得不含菌的粗提液,进行后续分离纯化,考察粗提液中抑菌物质的种类和含量。
[0081]
抑菌物质的分离纯化方法如下:
[0082]
a.利用旋转蒸发仪将200ml粗提液浓缩3倍,用6mol/l盐酸调节料液ph值至6.5,然后向浓缩液中加入等体积95%(v/v)乙醇,振荡使料液充分混合,乙醇使得浓缩液中的蛋白质变性形成絮状物,离心去除絮状蛋白质,得到清液。
[0083]
b.清液经旋转蒸发仪脱除乙醇,然后用6mol/l盐酸调节料液ph值至2.0,于4℃静置过夜。次日于4℃、12000r/min离心5min,收集沉淀。沉淀于通风橱中吹干后,用20ml甲醇溶解,经0.22μm过滤器过滤获得提取物,于4℃保存。
[0084]
c.采用高效液相色谱(hplc)对提取物中的活性物质进行分离和纯化。色谱柱型号
为source 25rpc st 4.6/100。流动相a:0.1%甲酸水溶液,流动相b:100%乙腈,a:b=60:40(v/v)。检测波长为215nm,流速为0.5ml/min。手动收集hplc分离得到两个组分a、b,在通风橱中吹干后,用相同体积的甲醇溶解。经0.22μm细菌过滤器过滤后于4℃保存,用于定性分析。
[0085]
d.定性分析:利用uplc-ms/ms(quadrupole time of flight 6200)对不同组分进行分子量测定,依据分子量对活性物质进行鉴定。色谱柱型号:c
18
色谱柱(agilent tc-c18,(5μm,4.6mm
×
250mm)。色谱分离条件:柱温40℃,流速0.3ml/min,进样体积4μl。质谱条件:电喷雾离子源(esi)正离子模式;离子化电压(is)5000v;喷雾气(gs1)50psi;辅助加热气(gs2)50psi;辅助加热气温度350℃;tof ms扫描范围为:m/z 50-2000;采集模式:飞行时间全扫描质谱和二级质谱(tof ms ida ms-ms)模式;tof ms触发二级扫描范围:m/z 50-2000;去簇电压(dp)100v;ms-ms碰撞能量(ce)。
[0086]
组分a的保留时间为20-24min,与fengycin的保留时间相似;而组分b的保留时间为30-37min,与surfactin的保留时间一致。分别收集这2个组分,浓缩后进行uplc-ms分析。结果表明,组分a的信号值[m+h]
+
分别为1475.8、1489.8、1503.8、1517.8,与fengycin a(c
15-c
18
)的分子量一致,组分b的[m+h]
+
分别为994.63、1008.65、1022.66、1036.65和1050.69,为surfactin(c
12-c
16
)的分子量。
[0087]
4.贝莱斯芽孢杆菌jbnh-01和贝莱斯芽孢杆菌jbnh 101脂肽表达水平对比
[0088]
通过uplc-ms/ms对脂肽粗提物中的脂肽含量进行定量分析,贝莱斯芽孢杆菌jbnh101的表面活性素和丰原素产量较贝莱斯芽孢杆菌jbnh-01分别提高82%、117%。
[0089]
表2-贝莱斯芽孢杆菌jbnh 101与贝莱斯芽孢杆菌jbnh-01脂肽发酵水平对比
[0090]
菌株表面活性素(g/l)丰原素(g/l)jbnh-011.060.51jbnh 1011.931.11
[0091]
实施例3
[0092]
表面活性素、丰原素抑菌性能评价
[0093]
将实施例2hplc纯化得到的表面活性素和丰原素用水稀释获得20~500ppm稀释液,评价其对典型细菌和真菌病原菌的抑制能力。
[0094]
1.表面活性肽和丰原素对两种病原细菌(黄瓜角斑病原菌和番茄青枯病原菌)的抑制能力
[0095]
病原细菌活化:将20ml lb种子培养基加入到100ml三角瓶中,接种一环保存于4℃的角斑或青枯病菌斜面种子,180rpm、37℃培养过夜,稀释100倍,获得稀释液。
[0096]
抑菌实验:取上述病原菌稀释液100μl,均匀涂布于平板上,然后在平板上打孔,每个孔加入20μl表面活性素或丰原素稀释液,每个处理两个重复。37℃培养过夜,测量抑菌圈大小。
[0097]
具体数据详见表3、图3和图4。
[0098]
表3-不同浓度表面活性素、丰原素对病原细菌的抑制效果对比
[0099][0100]
以上数据表明,表面活性素对黄瓜角斑和番茄青枯病原菌的抑制能力明显优于丰原素。
[0101]
2.脂肽对枯黄萎病原菌的抑制效果
[0102]
以西瓜枯萎、棉花黄萎病原菌为指示菌,考察表面活性素、丰原素以及两者组合对病原菌的抑制效果。结果见表4。
[0103]
表4-表面活性素、丰原素及组合物对病原菌的抑制效应
[0104][0105]
表4数据显示,表面活性素在5-50mg/l浓度下,对两种病原菌无肉眼可见的抑制作用;而丰原素展现出较强的抑制活性,其在50mg/l时的抑菌效果与40mg/l的噁霉灵相当。令人惊喜的是,表面活性素与丰原素组合使用时具有明显的协同效应,在达到相近抑制效果的情况下,组合物中丰原素的浓度可降至原来的1/5左右。
[0106]
实施例4
[0107]
贝莱斯芽孢杆菌jbnh 101生产壳聚糖酶能力验证、壳聚糖酶的获得方法及其在制备壳寡糖中的应用
[0108]
一、壳聚糖酶酶活性测定方法
[0109]
1.壳聚糖溶胀。称取2.0g(精确到0.01g)壳聚糖样品(记为m)至烧杯中,加入100ml水,搅拌使壳聚糖充分润湿。然后加入0.75ml冰醋酸,于55℃搅拌溶胀30min,直至物料变成粘稠、均一液体。
[0110]
2.酶解。按照预计的酶活水平加入一定体积(记为v)的酶液,自加入酶液开始计时。
[0111]
3.终点判定。定时取样,将酶解液滴加至0.1mol/l的naoh溶液中,无白色沉淀产生时视为反应终点。记录所用时间(记为t)。控制反应时间10-20min为宜。
[0112]
4.结果计算
[0113]
e=m
×
1000/(v
×
t)
[0114]
e-酶活,单位为u/ml
[0115]
m-壳聚糖样品质量,单位为g
[0116]
1000-克换算为毫克系数
[0117]
t-反应时间,单位为分钟
[0118]
v-加入的酶液体积,ml
[0119]
二、壳聚糖酶制备及其性质研究
[0120]
1.液体种子制备:将在4℃冰箱平板上保存的贝莱斯芽孢杆菌jbnh-01和贝莱斯芽孢杆菌jbnh 101分别接种到10ml液体lb培养基中,37℃、180rpm培养12h,得到一级种子液。分别取种子液5ml,接种到两个装有100ml液体lb培养基的1000ml三角瓶中,37℃、180rpm培养12h,获得二级种子液。
[0121]
2.接种发酵罐:将两个5l发酵罐罐体、管线、空气过滤器进行空消,121℃,空消30min,待温度降低后,每个发酵罐注入3l lb培养基,然后对培养基进行实消,121℃,实消30min;待温度降至32℃~37℃时进行接种,a罐接种贝莱斯芽孢杆菌jbnh-01二级种子液,b罐接种贝莱斯芽孢杆菌jbnh 101二级种子液。
[0122]
3.发酵产酶:两个发酵罐(a、b)的发酵条件保持一致。接种量3%(v/v);培养温度35
±
2℃;ph:7.0;初始转速:100rpm;发酵罐压:0.06mpa;通过调整搅拌转速和通气比使溶氧维持在15%左右;发酵周期:40~50h。从第15h开始,每隔6h取样检测酶活,待酶活基本不再增加时停止发酵。
[0123]
发酵液中壳聚糖酶酶活测定:从a、b罐中分别取100ml发酵液,于4℃、5000rpm离心15min,收集上清液,用于酶活测定。沉淀按照以下方法处理后测定酶活:沉淀用100ml蒸馏水重悬后离心,倾去上清液,保留菌体,如此重复3次,洗去菌体上的发酵液成分。取湿菌体20g,用100ml蒸馏水重悬后超声波破壁(300w,10s/10s,20分钟),取破壁后料液检测壳聚糖酶酶活。
[0124]
经测试,该壳聚糖酶为胞外酶,胞内酶的活性可忽略不计。两株菌的产酶能力和规律基本一致。发酵至45h后酶活不再增加,贝莱斯芽孢杆菌jbnh-01发酵离心清液酶活达到205u/ml,贝莱斯芽孢杆菌jbnh 101最高酶活达到213u/ml。
[0125]
4.酶的纯化:
[0126]
(1)对离心后的清液通过200nm陶瓷微滤膜处理,进一步去掉菌体和细小颗粒杂质;
[0127]
(2)微滤液再经6000dalton的超滤膜进行超滤浓缩,浓缩倍率1/5,收集超滤浓缩液;
[0128]
(3)向浓缩液中加入其体积50%的95%乙醇,常温下进行醇沉,离心收集沉淀,得到固体湿酶;
[0129]
(4)将得到的湿酶冷冻干燥,即得高纯度壳聚糖精酶。经测试其酶活为650000u/g,相当于纯化了3000倍。该固体酶稳定性良好,可长期保存。经计算,整个工艺过程酶活的综合回收率达到76%-80%。
[0130]
5.壳聚糖酶酶学性质研究
[0131]
(1)壳聚糖水解产物定性、定量分析
[0132]
a.胶体壳聚糖制备:取5g壳聚糖粉末(30-60目,脱乙酰度85%,壳聚糖含量90%),加入到100ml水中,充分搅拌使其全部润湿。然后加入1.5g冰醋酸,充分搅拌。55℃保温溶胀4h,获得胶体壳聚糖。
[0133]
b.壳聚糖水解:向胶体壳聚糖中加入酶活217u/ml的酶液1ml,开启机械搅拌(200r/min),55℃保持4h,过程中料液粘度逐渐下降。
[0134]
c.灭酶:将上述水解液于90℃条件下保温10min,使酶失活,以避免水解产物分子量继续下降。
[0135]
d.精制:向灭酶后的料液中加入3g硅藻土,搅拌均匀后抽滤,获得澄清的壳寡糖样品溶液。
[0136]
e.离子色谱定性分析:按照ny/t2889.2-2016中的离子色谱法对水解产物进行鉴别。样品溶液中检出壳二糖、壳三糖、壳四糖、壳五糖、壳六糖,氨基葡萄糖含量低于0.1%,说明该酶为内切酶。需要说明的是,通过控制酶解时间、加酶量等工艺参数,可以获得不同分子量的壳寡糖产品。制备得到的壳寡糖样品离子色谱图详见图5。样品中壳寡糖定量分析:按照ny/t2889.2-2016测定样品溶液中壳寡糖含量。上述样品溶液中壳二糖至壳六糖总量为4.4g/100ml,与理论含量(壳聚糖去除水分、灰分后的物质含量)高度吻合。
[0137]
(2)壳聚糖酶最适作用温度、ph值确定
[0138]
a.最适温度的确定
[0139]
设置30℃、40℃、50℃、60℃、70℃5个温度梯度,在ph值5.0、壳聚糖浓度为5%的条件下分别进行酶解实验,加酶量保持一致。以氢氧化钠滴定法判断反应终点(取1ml酶解液,加入到5ml 2%naoh溶液中,若无白色絮状物出现,说明达到终点),得出酶活与反应温度之间的关系。
[0140]
表5-温度对酶活力的影响
[0141]
温度(℃)酶活(u/ml)3070.440134.450214.360209.87066.7
[0142]
由表5可以看出,该酶的最适温度在50-60℃之间。
[0143]
b.酶解ph值确定
[0144]
分别配制ph值4.0、4.5、5.0、5.5、6.0等5个ph值梯度的胶体壳聚糖,55℃水浴锅中预热30min后加入一定标量的液体酶进行酶解反应,以氢氧化钠滴定法判断反应终点,得出酶活与ph值的数据,详见表6。
[0145]
表6-ph值对酶活力的影响
[0146]
ph值酶活(u/ml)4.0404.5204.25.0206.8
5.5224.36.0190.6
[0147]
从表6可以看出,该酶发挥作用的最适ph值为5.5,但是ph值在4.5~6.0之间对壳聚糖酶酶活的影响不大,考虑到ph值为5.0左右的壳聚糖胶体比较容易配制,故实验和实际生产过程中均选择ph值为5.0进行酶解反应。
[0148]
综上所述,贝莱斯芽孢杆菌jbnh 101具有优异的壳聚糖内切酶产生能力,该壳聚糖酶可用于壳寡糖的工业化生产。
[0149]
实施例5
[0150]
本实施例考察了壳聚糖酶及其与脂肽的组合物对枯萎病病原菌的抑制效应。
[0151]
作物致病性真菌的细胞壁主要由几丁质(chitin)构成,但前人的研究发现,这些几丁质并不是100%乙酰化的多糖,而是包含了大约10%脱乙酰化的壳聚糖。理论上讲,壳聚糖酶能够作用于这些脱乙酰化的位点,破坏真菌细胞壁的完整性,进而对病原真菌产生抑制作用。基于理论假设,考察了壳聚糖酶及其与脂肽组合使用时对枯萎病病原菌的抑制效应。
[0152]
1.实施例4制备的壳聚糖酶对病原菌的抑制效果评估
[0153]
(1)对峙生长法评估壳聚糖酶对西瓜枯萎病原菌菌丝生长的抑制作用
[0154]
将高纯度壳聚糖精酶配制成浓度0.01、0.1、0.5、2.0、5.0μg/ml的溶液,按照前述平板对峙生长法考察壳聚糖酶溶液对病原菌生长是否存在抑制作用,详见图6。结果显示,0.01-5.0μg/ml的壳聚糖酶对该病原菌无肉眼可见的抑制效应。
[0155]
(2)壳聚糖酶对西瓜枯萎病原菌孢子萌发的影响
[0156]
挑取在pda平板上活化的西瓜枯萎病原菌菌丝少许,接种于pda液体培养基中,25℃、160rpm培养6d,用灭菌纱布滤去培养液中的菌丝,用血球计数板计数,以无菌水调整分生孢子浓度为1
×
105cfu/ml。移取1ml孢子悬液,9ml不同浓度的壳聚糖酶溶液置于20ml离心管中,25℃、160rpm,振荡培养20min。吸取1ml处理后的菌液,加入9ml灭菌蒸馏水中,取100μl于pda平板上涂布均匀,做3次重复。28℃恒温黑暗培养2d后,对平板菌落计数。以生理盐水代替壳聚糖酶溶液作为对照,对照组平板菌落数记为“处理前萌发数”。
[0157][0158]
表7-壳聚糖酶对孢子萌发抑制率
[0159]
壳聚糖酶浓度(μg/ml)抑制率(%)0.0125.30.134.70.552.62.055.15.060.2
[0160]
根据表7数据可以看出,壳聚糖酶能够在一定程度上抑制孢子萌发,随着其浓度增加,抑制效应逐渐增强,有望作为杀菌/抑菌助剂使用。文献数据(j.agric.food chem.2021,69,3351-3361)显示,稻瘟病菌孢子经壳聚糖酶处理后,附着器发育受阻且芽管变短。
[0161]
2.壳聚糖酶与脂肽组合物对病原菌的抑制作用
[0162]
以西瓜枯萎病原菌为指示菌,考察壳聚糖酶与表面活性素、丰原素的两两组合或三者组合对病原菌的抑制效果。结果详见表8。
[0163]
表8-壳聚糖酶与脂肽组合物对病原菌的抑制效应
[0164][0165]
从表8中数据可以看出,壳聚糖酶与表面活性素或丰原素组合应用时具有及其明显的协同增效作用。这种作用可能与壳聚糖酶破坏病原菌细胞壁和脂肽破坏细胞膜引起的叠加效应有关。在达到同样的拮抗效果时,可进一步降低丰原素用量,这样可以很好地解决丰原素发酵水平偏低带来的问题。
[0166]
实施例6
[0167]
本实施例考察了培养基组成对脂肽、壳聚糖酶发酵水平的影响,形成了较优的培养基配方。
[0168]
将菌株贝莱斯芽孢杆菌jbnh 101接种至50ml lb液体培养基中(三个平行),37℃、180rpm振荡培养12h,作为种子液,按2%接种量接种至100ml不同的发酵培养基中,37℃、180rpm振荡培养72h。按照前文所述方法测定样品中表面活性素、丰原素含量和壳聚糖酶活性,每个处理取平均值。结果详见表9:
[0169]
表9-培养基对脂肽、壳聚糖酶发酵水平的影响
[0170][0171][0172]
表9数据表明,培养基组成对脂肽和壳聚糖酶的产量具有较大影响,且贝莱斯芽孢杆菌jbnh 101的脂肽产量均高于贝莱斯芽孢杆菌jbnh-01。其中贝莱斯芽孢杆菌jbnh 101表面活性素产量较高的培养基配方为:h》l》f》k,贝莱斯芽孢杆菌jbnh 101丰原素产量较高的培养基配方为:l》h》c》k,贝莱斯芽孢杆菌jbnh 101壳聚糖酶产量较高的培养基配方为:h》a》l》f。综合比较,配方h的脂肽、壳聚糖酶产量最高,其中表面活性素产量为5.53g/l,达到贝莱斯芽孢杆菌jbnh 101在lb液体培养基中发酵水平的2.62倍,丰原素产量为1.92g/l,达
到贝莱斯芽孢杆菌jbnh 101在lb液体培养基中发酵水平的1.64倍,壳聚糖酶较贝莱斯芽孢杆菌jbnh 101在lb液体培养基中的初始水平略有提高,相差不大。
[0173]
实施例7
[0174]
本实施例主要涉及包含贝莱斯芽孢杆菌jbnh 101及其代谢产物的生防制剂的制备方法。
[0175]
1.种子液的制备:将在4℃冰箱平板上保存的贝莱斯芽孢杆菌jbnh 101接种到50ml种子培养基中,35℃、180rpm培养10h,得到一级种子液。将一级种子液按照1%的接种量接种到二级种子培养基中,在35℃、180rpm的摇床中培养8h,获得二级种子液。
[0176]
其中,所述种子培养基的组成为:蛋白胨15g/l,酵母膏5g/l,葡萄糖10g/l,nacl10g/l,ph=7.2。
[0177]
2.发酵培养:将培养好的种子液按照1.2%v/v比例接种到5吨发酵罐中,装液量70%,发酵温度37℃,搅拌速度为150rpm,调节通风量保证溶氧在10%以上,罐压0.06mpa,发酵时间50h,芽孢量达到95%以上时停止发酵,降温至20℃。
[0178]
其中,所述发酵培养基的组成为:蔗糖4.0%,豆饼粉水解物2.0%,l-亮氨酸0.5%,k2hpo4·
3h2o 0.8%,mgso4·
7h2o 0.075%,mnso4·
h2o 0.2%,feso
4 0.07%,聚醚消泡剂1.2g/l,其余为水,ph=7.2。
[0179]
3.生防制剂(菌剂)的制备
[0180]
液体制剂:将发酵液用无菌水按一定比例稀释后,无菌灌装,制备成液体菌剂;或者,粉剂制剂:将所得发酵液用离心机浓缩2倍,再加入20%的辅料,然后搅拌30min,使用离心喷雾干燥塔进行干燥,设定进风温度170℃、出风温度85℃,收集干粉。其中,所述辅料为:麦芽糊精:mgso4·
7h2o(质量比)=60∶40。
[0181]
液体或粉剂制剂中表面活性素和丰原素的质量比为2.0-4.0:1.0,壳聚糖酶酶活≥75u/g。
[0182]
实施例8
[0183]
实施例7制备的生防制剂对番茄枯萎病的防治效果
[0184]
实验设置3个处理:(1)清水对照(ck);(2)生防制剂:实施例7制备的生防制剂;(3)化学药剂:50%多菌灵。
[0185]
实验设计:将6~8叶番茄秧苗在病原菌孢子液(1
×
106cfu/ml)浸泡20分钟,移栽至装有营养土的花盆中,每个处理10株,然后每株灌根20ml病原菌孢子液(1
×
106cfu/ml)。24h后实验组每棵番茄灌根1ml液体制剂或1g粉剂制剂(清水先稀释100倍);50%多菌灵稀释500倍后灌根100ml/棵。生长25d后调查病情,计算防治效果。
[0186]
评价方法:番茄枯萎病病情分级标准如下:0级:无症状;1级:1片或2片子叶明显变黄,以致脱落;2级:3片或4片真叶变黄,叶片萎焉下垂;3级:5片或6片真叶变黄或真叶萎焉下垂;4级:全株严重萎焉,以致枯死。
[0187]
计算公式:发病率=处理发病株数/处理总株数
×
100%
[0188][0189]
[0190]
具体防治数据详见表10,各处理组长势情况见表11和图7。
[0191]
表10-不同处理组对番茄枯萎病的防治效果
[0192][0193][0194]
表11-不同处组番茄植株生物量测定
[0195][0196]
由以上数据可知,实施例7制备的制剂处理组防效高达71.43%,而多菌灵药剂处理组防效仅为23.81%。另外,实施例7制备的制剂处理组的生物量,包括根长、根鲜重、茎叶鲜重、根干重、茎叶干重明显优于其他两个处理组。
[0197]
实施例9
[0198]
实施例7制备的生防制剂对黄瓜角斑病的防治效果
[0199]
测试生防制剂对温室黄瓜角斑病的防治效果,种植后的黄瓜按常规进行生产管理。
[0200]
表12-供测药剂
[0201]
药剂含量(%)剂型清水对照//中生菌素6.0可溶液剂春雷霉素6.0可溶液剂生防制剂100亿/g可湿性粉剂
[0202]
具体步骤包括:使用背负式喷雾剂,使用表12的杀菌剂样品药液分别对各个区块的作物进行喷雾,空白对照组使用等量清水喷雾,杀菌剂施药量为30g/亩,各杀菌剂均稀释500倍后进行喷雾。分别于施药前1天、施药后7天调查发病情况,具体试验方法按照《农药田间药效试验准则》进行。按照公式计算防治效果。
[0203]
黄瓜角斑病以病斑占叶面积比例大小,分6级记录:
[0204]
0级:无病斑;
[0205]
1级:病斑面积占整个叶面积的1%-20%以下;
[0206]
2级:病斑面积占整个叶面积的21%-40%;
[0207]
3级:病斑面积占整个叶面积的41%-60%;
[0208]
4级:病斑面积占整个叶面积的61%-80%;
[0209]
5级:病斑面积占整个叶面积的81%-100%。
[0210]
根据调查数据,计算各处理的病情指数和防治效果,具体结果详见表13:
[0211]
表13-各处理对黄瓜角斑病的防效
[0212]
药剂药前病情指数药后7天病情指数防治效果(%)清水对照12.5645.08/中生菌素11.2115.6265.35春雷霉素11.5214.3366.74生防制剂12.513.5268.62
[0213]
从表13可以看出,本发明生防制剂对黄瓜角斑病害的防效与中生菌素和春雷霉素相当,具有推广应用价值。
[0214]
实施例10
[0215]
贝莱斯芽孢杆菌jbnh 101的广谱抑菌性能验证
[0216]
(1)病原真菌抑菌实验:将4℃斜面保存的病原真菌转接到pda平板,25℃活化培养3d,然后在菌落边缘区域取菌饼,接种在直径为90mm的pda平板中央。25℃培养3d后,距离菌饼20mm处接种(灭菌牙签挑取菌落)平板保存的贝莱斯芽孢杆菌jbnh 101,继续置于25℃培养箱中培养,5-7d后进行拮抗带宽度的测定。
[0217]
(2)病原细菌抑菌实验:1)贝莱斯芽孢杆菌jbnh 101菌液制备。挑取一环斜面菌种接种于20ml lb液体培养基,在37℃,180rpm条件培养48h,获得菌株发酵液。2)病原细菌活化。将20ml lb种子培养基加入到100ml三角瓶中,接种一环保存于4℃的角斑或青枯病菌斜面种子,160r/min,37℃培养过夜,稀释100倍,获得稀释液。3)抑菌实验。取病原菌稀释液100μl,均匀涂布于平板上,然后在平板上打孔,每个孔加入20μl贝莱斯芽孢杆菌jbnh 101发酵液,每个处理两个重复。37℃培养过夜,测量抑菌圈直径。
[0218]
具体广谱抑菌实验结果详见图8~图13。
[0219]
由图8-图13可知,贝莱斯芽孢杆菌jbnh 101对多种经济作物和大田作物上的多种病原真菌,以及黄瓜角斑和番茄青枯致病菌均具有明显的抑制作用,在农业病害防治上具备巨大的应用潜力。
[0220]
尽管通过参考附图并结合优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明的涵盖范围内/任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求所述的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1