HEK293细胞裂解液的纯化方法与流程
hek293细胞裂解液的纯化方法
技术领域
1.本发明涉及生物技术领域,特别是涉及一种hek293细胞裂解液的纯化方法。
背景技术:
2.生物制药是以基因工程为基础的现代生物工程,其利用现代生物技术对dna进行切割、连接、改造,生产出传统制药技术难以获得的生物药品。生物制药技术主要包括细胞工程制药、发酵工程制药和酶工程制药。
3.细胞工程是应用细胞生物学、遗传学和分析生物学的理论和方法,在细胞水平上对细胞进行大规模培养和分子水平上的基因改造,依据人类的利益和需求进行生产的技术。
4.细胞工程涉及细胞培养,细胞培养是获得生物药物(例如蛋白或病毒)的主要手段。随着上游技术的不断发展,细胞浓度和存活率都有了显著的改善,这对生物制药下游工艺提出了新的挑战。
5.过滤和纯化技术是生物制药下游工艺中的主要技术。深层过滤由于其能截留住小尺寸细胞碎片,且较不容易堵塞,具有较大量的去杂能力,最近几年应用越来越广泛。但深层过滤器价格昂贵,用于工业上放大生产时存在困难。
技术实现要素:
6.基于此,有必要提供一种较低成本、易于放大且高效的hek293细胞裂解液的纯化方法。
7.一种hek293细胞裂解液的纯化方法,包括以下步骤:
8.获取hek293细胞裂解液;
9.对所述细胞裂解液采用碟式离心机进行离心,收集离心上清液;及
10.将所述离心上清液进行深层过滤处理,得到澄清液。
11.上述hek293细胞裂解液的纯化方法,由于细胞裂解液中存在大量的细胞碎片、宿主细胞蛋白(hcp)以及宿主细胞dna等杂质,先经过碟式离心机离心去除大部分细胞碎片后再进行深层过滤,能够极大地减轻深层过滤的压力,避免深层过滤时的滤膜堵塞,大大提高深层过滤的效率,易于扩大生产,并能制备得到浊度较低的澄清液,所得澄清液中的宿主细胞dna含量和hcp含量都得到了大幅度降低,极大减轻了后续蛋白进一步纯化工艺的压力,降低了生产成本。
12.在其中一个实施例中,所述离心的参数包括:进料速度为200l/h~500l/h,转鼓转速为6500rpm~8500rpm,背压为3bar以上,以及操作水压力为3bar以上。
13.在其中一个实施例中,所述离心的参数包括:进料速度为200l/h~300l/h,转鼓转速为7000rpm~8000rpm,背压为3bar~5bar,以及操作水压力为3bar~6bar。
14.在其中一个实施例中,所述离心的参数还包括:排渣间隔为1000s~2000s,以及单次排渣时间为20s~40s。
15.在其中一个实施例中,采用14块~16块深层滤膜进行所述深层过滤处理。
16.在其中一个实施例中,所述深层过滤处理时间为80min~100min。
17.在其中一个实施例中,所述细胞裂解液的浊度为900ntu~1500ntu。
18.在其中一个实施例中,所述离心上清液的浊度为200ntu~350ntu。
19.在其中一个实施例中,所述细胞裂解液的温度为0℃~20℃。
20.在其中一个实施例中,所述澄清液的浊度为20ntu~80ntu。
附图说明
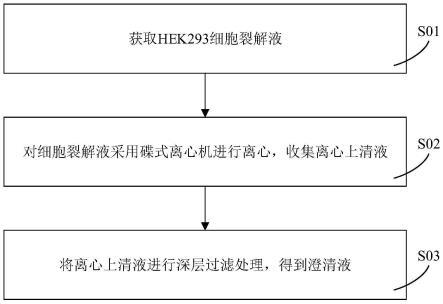
21.图1为本技术一实施方式的hek293细胞裂解液的纯化方法的具体步骤流程图。
具体实施方式
22.为使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
23.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
24.本文所述的“hek293细胞”是人胚胎肾细胞293,是一个衍生自人胚胎肾细胞的细胞系,具有转染效率高,且易于培养等特点,很适合用以表达研究外源基因。在本技术中,hek293细胞包括经过基因工程改造的能够表达产生外源蛋白的hek293细胞,通常,适用于本技术的经过基因工程改造的能够表达产生外源蛋白的hek293细胞的细胞活力、活细胞密度、滴度、生长速率、增殖应答、细胞形态、凋亡和自噬水平和/或总体细胞健康与其非工程改造的亲本hek293细胞类似。
25.所述的“浊度”是指溶液对光线通过时所产生的阻碍程度,它包括悬浮物对光的散射和溶质分子对光的吸收。本文采用的是比浊法浊度单位,即ntu(nephelometric turbidity unit)。
26.所述的“碟式离心机”是立式离心机的一种,转鼓装在立轴上端,通过传动装置由电动机驱动而高速旋转。转鼓内有一组互相套叠在一起的碟形零件,即碟片,碟片与碟片之间留有很小的间隙。悬浮液(或乳浊液)由位于转鼓中心的进料管加入转鼓。当悬浮液(或乳浊液)流过碟片之间的间隙时,固体颗粒(或液滴)在离心机作用下沉降到碟片上形成沉渣(或液层)。沉渣沿碟片表面滑动而脱离碟片并积聚在转鼓内直径最大的部位,分离后的液体从出液口排出转鼓。碟片的作用是缩短固体颗粒(或液滴)的沉降距离、扩大转鼓的沉降面积,转鼓中由于安装了碟片而大大提高了分离机的生产能力。
27.所述的“背压”指的是后端的压力,用于描述系统排出的流体在出口处或二次侧受到的与流动方向相反的压力(大于当地大气压)。在运动流体的描述中是指运动流体在密闭容器中沿其路径(例如管路或风通路)流动时,由于受到障碍物或急转弯道的阻碍而被施加的与运动方向相反的压力。
28.所述的“深层过滤”是指当颗粒尺寸小于介质孔道直径时,不能在过滤介质表面形成滤饼,这些颗粒便进入介质内部,借惯性和扩散作用趋近孔道壁面,并在静电和表面力的作用下沉积下来,从而与流体分离。
29.所述的“深层过滤膜”具有层层挤压的纤维,具有网目结构,其孔径比微孔滤膜大,经由网目的缝隙能够将粒子加以捕捉。深层过滤膜较厚,内外均可捕捉粒子,且较不容易堵塞,具有较大量的去除能力。
30.所述的“细胞悬液”是指含有悬浮状态的细胞的培养液。
31.所述的“培养液”是培养细胞过程中供给细胞营养和促使细胞生长增殖的基础物质,也是培养细胞时细胞生长和繁殖的生存环境。
32.所述的“宿主细胞”也即受体细胞,是指接受外源基因的细胞。在本技术中即是指hek293细胞。
33.所述的“宿主细胞蛋白”的英文名称是“host cell protein”,缩写为“hcp”,是在生物制药(如生产重组蛋白药物或单克隆抗体等)工艺过程中所产生的杂质。尽管hcp对临床和基因的潜在影响在很大程度上还是未知的,但有研究表明如果患者身上存在的hcp含量足够高的话,很有可能会引起免疫反应或其他不良反应。因此,在蛋白质生物制剂的生产工艺中,降低hcp的含量并对其进行检测和评估是生物制品中至关重要的操作。
34.所述的“宿主细胞dna”是在生物制品的生产过程中用以生产目标蛋白的细胞本身的dna,其对生物制品的影响在很大程度上还是未知的,但是也有研究表明宿主细胞dna可能包含一些有害的dna片段,使其具有传染性和致瘤性。因此,在生物制药中,降低宿主细胞dna的含量并对其进行检测是非常有必要的。
35.本技术一实施方式提供了一种hek293细胞裂解液的纯化方法,如图1所示,该纯化方法包括步骤s01、步骤s02和步骤s03。具体地:
36.步骤s01:获取hek293细胞裂解液。
37.在其中一个实施例中,在步骤s01之前还包括裂解hek293细胞并收集细胞裂解液的步骤。
38.具体地,当hek293细胞培养液到达培养终点时,对细胞悬液中的细胞进行裂解操作,裂解完成后将细胞裂解液从反应器转移至收集容器,并将温度控制在合适范围内。可以理解的是,在hek293细胞培养液到达培养终点之前,应维持hek293细胞在合适的条件下生长,具体的细胞培养条件根据具体情况而定,本领域技术人员理解用于培养细胞的方法是本领域中已知的,并且可以根据具体细胞状态而变化,在所有情况下,可以使用常规优化来确定用于细胞培养的最佳技术。
39.在其中一个实施例中,对细胞进行裂解的方法包括化学裂解法、酶裂解法和机械裂解法中的至少一种。
40.具体地,化学裂解法和酶裂解法包括利用去污剂破坏脂质双分子层破裂细胞、溶解蛋白、变性蛋白以及抑制蛋白酶的活性的步骤。机械裂解法包括冻融法或超声破碎法。冻融法是指采用反复冷冻与融化的方法裂解细胞,反复冻融时由于细胞中形成了冰晶,胞外剩余液体中盐浓度增高,从而可以使细胞破裂,达到裂解细胞的目的。超声破碎法是利用超声波在液体中的分散效应,使液体产生空化,从而使液体中的固体颗粒或细胞组织破碎。可以理解的是,本领域技术人员可根据实际需要选择合适的细胞裂解方法。
41.在其中一个实施例中,细胞裂解液的温度为0℃~20℃。
42.进一步地,细胞裂解液的温度为2℃~20℃。
43.更进一步地,细胞裂解液的温度为2℃~16℃。
44.在一个可选的具体示例中,细胞裂解液的温度为3℃、4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃或15℃。优选为4℃。
45.具体地,通过降低hek293细胞裂解液的温度以达到降低碟式离心机转鼓温度的效果,以保证目的产物的稳定性。
46.在其中一个实施例中,将细胞裂解液的浊度控制在900ntu~1500ntu。在其中一个实施例中,将细胞裂解液的浊度控制在900ntu~1400ntu。在其中一个实施例中,将细胞裂解液的浊度控制在900ntu~1300ntu。
47.步骤s02:对细胞裂解液采用碟式离心机进行离心,收集离心上清液。
48.具体地,离心的参数包括:进料速度为200l/h~500l/h,转鼓转速为6500rpm~8500rpm,背压为3bar以上,以及操作水压力为3bar以上。
49.进一步地,离心的参数包括:进料速度为200l/h~300l/h,转鼓转速为7000rpm~8000rpm,背压为3bar~5bar,以及操作水压力为3bar~6bar。
50.在一个可选的具体示例中,离心的参数包括:进料速度为210l/h、230l/h、250l/h、270l/h或290l/h,转鼓转速为7100rpm、7300rpm、7500rpm、7700rpm或7900rpm,背压为3.2bar、3.4bar、3.5bar、3.6bar、3.8bar、4.0bar、4.1bar、4.3bar、4.5bar、4.7bar或4.9bar,以及操作水压力为3.5bar、4.0bar、4.5bar、5.0bar或5.5bar。
51.具体地,通过控制进料流速和背压从而降低细胞裂解液的浊度。进一步地,通过控制进料流速、转鼓转速和背压更好地降低细胞裂解液的浊度。
52.在其中一个实施例中,离心的参数还包括:排渣间隔为1000s~2000s,以及单次排渣时间为20s~40s。
53.进一步地,离心的参数还包括:排渣间隔为1200s~1900s,以及单次排渣时间为25s~35s。
54.在一个可选的具体示例中,离心的参数还包括:排渣间隔为1300s、1400s、1500s、1600s、1700s或1800s,以及单次排渣时间为26s、28s、30s、32s或34s。
55.在其中一个实施例中,离心上清液的浊度为200ntu~400ntu。
56.进一步地,离心上清液的浊度为200ntu~350ntu。
57.更进一步地,离心上清液的浊度为250ntu~330ntu。
58.细胞裂解液经过碟式离心机处理后,其浊度值明显降低,说明该工艺路线离心效果较好,从而降低了后续深层过滤的处理难度。
59.步骤s03:将离心上清液进行深层过滤处理,得到澄清液。
60.在其中一个实施例中,采用14块~16块深层滤膜进行所述深层过滤处理。
61.进一步地,采用15块深层滤膜进行所述深层过滤处理。
62.在其中一个实施例中,深层滤膜包括三种以上不同孔径范围的深层滤膜。
63.在其中一个实施例中,深层滤膜包括四种不同孔径范围的深层滤膜。
64.具体地,深层滤膜的孔径范围为0.6μm~0.8μm、0.04μm~0.2μm、0.1μm~2μm以及0.02μm~0.4μm。
65.在其中一个实施例中,深层过滤处理时间为80min~100min。
66.进一步地,深层过滤处理时间为85min~95min。
67.更进一步地,深层过滤处理时间为88min~92min。
68.在其中一个实施例中,澄清液的浊度为20ntu~80ntu。
69.进一步地,澄清液的浊度为25ntu~75ntu。
70.更进一步地,澄清液的浊度为30ntu~73ntu。
71.上述hek293细胞裂解液的纯化方法,由于细胞裂解液中存在大量的细胞碎片、宿主细胞蛋白(hcp)以及宿主细胞dna等杂质,先经过碟式离心机离心去除大部分细胞碎片后再进行深层过滤,能够极大地减轻深层过滤的压力,避免深层过滤时的滤膜堵塞,大大提高深层过滤的效率,易于扩大生产,并能制备得到浊度较低的澄清液,所得澄清液中的宿主细胞dna含量和hcp含量都得到了大幅度降低,极大减轻了后续蛋白进一步纯化工艺的压力,降低了生产成本。
72.此外,本技术的hek293细胞裂解液的纯化方法,在进行深层过滤以后,不需要再经过0.2μm~0.45μm的过滤器处理,已经能够实现无菌的目的且澄清液中的杂质成分很少,浊度很低,从而进一步节约了资源,降低了成本。
73.具体实施例
74.以下结合具体实施例进行详细说明。以下实施例如未特殊说明,则不包括除不可避免的杂质外的其他组分。实施例中采用试剂和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,按照常规条件,例如文献、书本中所述的条件或者生产厂家推荐的方法实现。
75.实施例1
76.1.裂解hek293细胞
77.当hek293细胞培养至细胞密度(15.0
±
3.0)
×
106cells/ml时进行接毒,所接毒株为以人5型复制缺陷腺病毒为载体构建的表达新型冠状病毒s蛋白的ad5-ncov毒株,接毒培养48
±
6h后,依次加入终浓度为2mm的0.1m mgcl2溶液、终浓度为160
±
40u/g的核酸酶溶液及终浓度为1%(w/w)的10%(w/w)吐温80溶液对细胞进行裂解操作,裂解4h后用5
×
iex buffer(2.7m nacl,300mm hepes,2mm mgcl2,12%蔗糖,ph7.5)调节体系电导至28.0ms/cm~30.0ms/cm,继续孵育3h细胞裂解完成,裂解后的体积为865.70l,将细胞裂解液从反应器转移至收集容器,并将温度控制在4℃。
78.2.碟式离心机离心处理
79.将细胞裂解液通过动力泵传输至碟式离心机(clara 200)进行离心处理,离心机以7500rpm的转速和200l/h~300l/h的进料速度连续处理裂解液,排渣间隔设置为1800s,碟片离心机背压保持在4bar~5bar,操作水压力保持在3bar。收集离心上清液,并采用比浊法检测浊度,结果如表1所示。
80.3.深层过滤收集澄清液
81.预冲水完毕后将深层过滤装置进料口连接至离心收集液出料口并在管道上加蠕动泵,以提供深层过滤的动力。离心处理过后的上清液使用15块深层滤膜进行过滤处理,其中,深层滤膜的孔径组成及型号如表2所示。处理过程中监测过滤系统进料口的压力变化,取样检测经深层过滤后的样品中的宿主细胞dna残留和hcp残留。深层过滤处理时间为90分
钟,得到并收集澄清液,采用比浊法检测浊度,并计算收率,结果如表1所示。
82.表2
[0083][0084]
实施例2
[0085]
1.裂解hek293细胞
[0086]
当hek293细胞培养至细胞密度(15.0
±
3.0)
×
106cells/ml时进行接毒,所接毒株为以人5型复制缺陷腺病毒为载体构建的表达新型冠状病毒s蛋白的ad5-ncov毒株,接毒培养48
±
6h后,依次加入终浓度为2mm的0.1m mgcl2溶液、终浓度为160
±
40u/g的核酸酶溶液及终浓度为1%(w/w)的10%(w/w)吐温80溶液对细胞进行裂解操作,裂解4h后用5
×
iex buffer(2.7m nacl,300mm hepes,2mm mgcl2,12%蔗糖,ph7.5)调节体系电导至28.0ms/cm~30.0ms/cm,继续孵育3h细胞裂解完成,裂解后的体积为899.02l,将细胞裂解液从反应器转移至收集容器,并将温度控制在4℃。
[0087]
2.碟式离心机离心处理
[0088]
将细胞裂解液通过动力泵传输至碟式离心机(clara 200)进行离心处理,离心机以7500rpm的转速和200l/h~300l/h的进料速度连续处理裂解液,排渣间隔设置为1800s,碟片离心机背压保持在4bar~5bar,操作水压力保持在3bar。收集离心上清液,并采用比浊法检测浊度,结果如表1所示。
[0089]
3.深层过滤收集澄清液
[0090]
预冲水完毕后将深层过滤装置进料口连接至离心收集液出料口并在管道上加蠕动泵,以提供深层过滤的动力。离心处理过后的上清液经15块深层滤膜进行过滤处理,其中,深层滤膜的孔径组成及型号如表2所示。处理过程中监测过滤系统进料口的压力变化,取样检测经深层过滤后的样品中的宿主细胞dna残留和hcp残留。深层过滤处理时间为90分钟,得到并收集澄清液,采用比浊法检测浊度,并计算收率,结果如表1所示。
[0091]
实施例3
[0092]
1.裂解hek293细胞
[0093]
当hek293细胞培养至细胞密度(15.0
±
3.0)
×
106cells/ml时进行接毒,所接毒株为以人5型复制缺陷腺病毒为载体构建的表达新型冠状病毒s蛋白的ad5-ncov毒株,接毒培养48
±
6h后,依次加入终浓度为2mm的0.1m mgcl2溶液、终浓度为160
±
40u/g的核酸酶溶液及终浓度为1%(w/w)的10%(w/w)吐温80溶液对细胞进行裂解操作,裂解4h后用5
×
iex buffer(2.7m nacl,300mm hepes,2mm mgcl2,12%蔗糖,ph7.5)调节体系电导至28.0ms/cm~30.0ms/cm,继续孵育3h细胞裂解完成,裂解后的体积为882.6l,将细胞裂解液从反应器转移至收集容器,并将温度控制在4℃。
[0094]
2.碟式离心机离心处理
[0095]
将细胞裂解液通过动力泵传输至碟式离心机(clara 200)进行离心处理,离心机
以7500rpm的转速和200l/h~300l/h的进料速度连续处理裂解液,排渣间隔设置为1800s,碟片离心机背压保持在4bar~5bar,操作水压力保持在3bar。收集离心上清液,并采用比浊法检测浊度,结果如表1所示。
[0096]
3.深层过滤收集澄清液
[0097]
预冲水完毕后将深层过滤装置进料口连接至离心收集液出料口并在管道上加蠕动泵,以提供深层过滤的动力。离心处理过后的上清液经15块深层滤膜进行过滤处理,其中,深层滤膜的孔径组成及型号如表2所示。处理过程中监测过滤系统进料口的压力变化,取样检测经深层过滤后的样品中的宿主细胞dna残留和hcp残留。深层过滤处理时间为90分钟,得到并收集澄清液,采用比浊法检测浊度,并计算收率,结果如表1所示。
[0098]
实施例4
[0099]
1.裂解hek293细胞
[0100]
当hek293细胞培养至细胞密度(15.0
±
3.0)
×
106cells/ml时进行接毒,所接毒株为以人5型复制缺陷腺病毒为载体构建的表达新型冠状病毒s蛋白的ad5-ncov毒株,接毒培养48
±
6h后,依次加入终浓度为2mm的0.1m mgcl2溶液、终浓度为160
±
40u/g的核酸酶溶液及终浓度为1%(w/w)的10%(w/w)吐温80溶液对细胞进行裂解操作,裂解4h后用5
×
iex buffer(2.7m nacl,300mm hepes,2mm mgcl2,12%蔗糖,ph7.5)调节体系电导至28.0ms/cm~30.0ms/cm,继续孵育3h细胞裂解完成,裂解后的体积为895.99l,将细胞裂解液从反应器转移至收集容器,并将温度控制在4℃。
[0101]
2.碟式离心机离心处理
[0102]
将细胞裂解液通过动力泵传输至碟式离心机(clara 200)进行离心处理,离心机以7500rpm的转速和200l/h~300l/h的进料速度连续处理裂解液,排渣间隔设置为1800s,碟片离心机背压保持在4bar~5bar,操作水压力保持在3bar。收集离心上清液,并采用比浊法检测浊度,结果如表1所示。
[0103]
3.深层过滤收集澄清液
[0104]
预冲水完毕后将深层过滤装置进料口连接至离心收集液出料口并在管道上加蠕动泵,以提供深层过滤的动力。离心处理过后的上清液经15块深层滤膜进行过滤处理,其中,深层滤膜的孔径组成及型号如表2所示。处理过程中监测过滤系统进料口的压力变化,取样检测经深层过滤后的样品中的宿主细胞dna残留和hcp残留。深层过滤处理时间为90分钟,得到并收集澄清液,采用比浊法检测浊度,并计算收率,结果如表1所示。
[0105]
实施例5
[0106]
1.裂解hek293细胞
[0107]
当hek293细胞培养至细胞密度(15.0
±
3.0)
×
106cells/ml时进行接毒,所接毒株为以人5型复制缺陷腺病毒为载体构建的表达新型冠状病毒s蛋白的ad5-ncov毒株,接毒培养48
±
6h后,依次加入终浓度为2mm的0.1m mgcl2溶液、终浓度为160
±
40u/g的核酸酶溶液及终浓度为1%(w/w)的10%(w/w)吐温80溶液对细胞进行裂解操作,裂解4h后用5
×
iex buffer(2.7m nacl,300mm hepes,2mm mgcl2,12%蔗糖,ph7.5)调节体系电导至28.0ms/cm~30.0ms/cm,继续孵育3h细胞裂解完成,裂解后的体积为979.38l,将细胞裂解液从反应器转移至收集容器,并将温度控制在4℃。
[0108]
2.碟式离心机离心处理
[0109]
将细胞裂解液通过动力泵传输至碟式离心机(clara 200)进行离心处理,离心机以7500rpm的转速和200l/h~300l/h的进料速度连续处理裂解液,排渣间隔设置为1800s,碟片离心机背压保持在4bar~5bar,操作水压力保持在3bar。收集离心上清液,并采用比浊法检测浊度,结果如表1所示。
[0110]
3.深层过滤收集澄清液
[0111]
预冲水完毕后将深层过滤装置进料口连接至离心收集液出料口并在管道上加蠕动泵,以提供深层过滤的动力。离心处理过后的上清液经15块深层滤膜进行过滤处理,其中,深层滤膜的孔径组成及型号如表2所示。处理过程中监测过滤系统进料口的压力变化,取样检测经深层过滤后的样品中的宿主细胞dna残留和hcp残留。深层过滤处理时间为90分钟,得到并收集澄清液,采用比浊法检测浊度,并计算收率,结果如表1所示。
[0112]
表1
[0113]
实施例离心上清液浊度澄清液浊度收率1246ntu60.6ntu78.94%2257ntu35.7ntu84.80%3284ntu56.2ntu84.76%4324ntu42.8ntu86.73%5263ntu26.1ntu82.72%
[0114]
表1中收率的计算方法为:深层过滤后ifu总数
÷
离心后ifu总数*100%。通过表1中的结果可以看出,应用本发明的方法获得的hek293细胞裂解后的澄清液具有较低的浊度,同时具有较高的收率。本发明的处理方法可以保证离心机在工作过程中处于稳定的状态,并且离心后的裂解液具有较低的浊度以及保证裂解液的内含物稳定性。此外,本发明的方法具有较高的单位处理量,能够批量处理细胞裂解液,使生产更高效。
[0115]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0116]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1