一种改性透明质酸在医美注射填充试剂上的应用的制作方法
1.本发明属于生物医用材料领域,具体为医美填充试剂,特别涉及一种改性透明质酸在医美注射填充试剂上的应用。
背景技术:
2.由于经济的发展,人们越来越注重与外在形象的表达。由于先天畸形以及年龄老化导致的疤痕、皱纹,是医疗美容机构经常遇到的问题,现状是医美填充试剂不能稳定且长时间的保持效果。近年发展起来的组织工程技术在组织修复及器官填充等方面发挥着越来越重要的作用。透明质酸水凝胶具有可降解、生物相容性良好、溶胀比高、结构高度类似于细胞外基质等特点,是很有发展潜力的组织工程支架材料,在生物医用材料领域引起人们巨大兴趣。透明质酸是由(b-1-4)d-葡萄糖醛酸和(-1-3)n-乙酰基-d-氨基葡萄糖为二糖单位的以b-1,3和b-1,4糖苷链交替连接组成的一种线性粘多糖,广泛存在于人体皮肤、关节液、细胞外基质中,在体内具有保持水分、促进细胞自我修复和软骨形成等作用。透明质酸能与众多细胞受体(如cd44cd54等)特异结合,可以调节细胞黏附、增殖与分化。然而,透明质酸在体内吸收速度太快,在组织中易扩散、停留时间短、难以稳定存在,极大限制了透明质酸的实际应用。因此,需要对透明质酸进行功能化修饰改性,拓展其应用范围,最大限度地发挥其价值。
3.传统的透明质酸水凝胶是采用小分子交联剂通过化学交联形成的,普遍存在机械强度低、降解速度可控性差等问题。基于此,本发明在透明质酸的基础上交联丝素蛋白和聚乙烯醇,丝素蛋白与透明质酸的交联能使水凝胶的机械强度得到巨大的改善,同时也使可降解速率有了明显的降低,聚乙烯醇的加入可使在透明质酸和丝素蛋白被人体吸收后,刺激人体细胞分泌胶原蛋白,达到延长填充效果时间的目的。
技术实现要素:
4.针对现有技术的不足,本发明提供了一种改性透明质酸在医美注射填充试剂上的应用,以解决传统的透明质酸水凝胶机械强度低、降解速度可控性差等问题。为实现上述目的,本发明通过以下技术方案来实现:
5.第一方面,本发明公开了一种改性透明质酸水凝胶的制备方法,其包含以下步骤:
6.(1)制备丝素蛋白;
7.(2)将透明质酸和丝素蛋白以及聚乙烯醇粉末采用超声的方式进行混合;
8.(3)将交联剂加入到混合溶液中进行交联;
9.(4)将交联后的溶液倒入培养皿中,冷冻,然后进行冻干,即得到可注射的改性透明质酸。
10.另一方面,本发明公开了这种改性透明质酸水凝胶的具体制备方法,其包括如下步骤:
11.s1、称取一定量的家蚕生丝,将其放入4000-6000ml浓度为0.6%的碳酸钠溶液中,
在90-100℃下煮三次,前两次每次处理20-30min,第三次处理40-60min,每次处理完再用去离子水漂洗以脱去生丝中的丝胶,然后将脱胶之后的蚕丝扯松,放于60-80℃的烘箱中烘干,即可得到丝素纤维。
12.s2、配制无水氯化钙、无水乙醇、水的三元溶液,将烘干后的丝素纤维按照一定的浴比在5-15℃的三元溶液中缓慢搅拌溶解,可事先将丝素纤维剪碎,溶解1-3h,得到丝素纤维和三元溶液的混合溶液,透析、过滤后即可获得质量分数为8-13%的丝素蛋白溶液。
13.s3、向s2制备的丝素蛋白溶液中加入透明质酸粉末以及聚乙烯醇粉末,透明质酸粉末的质量为丝素蛋白质量的0.015-0.1倍,聚乙烯醇粉末的质量为丝素蛋白质量的0.01-0.07倍,并用超声混合的方式将聚乙烯醇粉末和透明质酸粉末分散至丝素蛋白溶液中。
14.s4、选用n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺作为交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占丝素蛋白质量的10-30%、5-15%。
15.s5、真空脱泡:将s3制备的改性透明质酸溶液和s4制备的交联剂混合均匀后倒入直径为60mm玻璃皿中,在-40℃冰箱内冷冻12-36h,然后把所有样品都放到冷冻干燥机中,经12-48h真空冷冻干燥后即可获得在人体内维持效果更久的改性透明质酸。
16.优选的,步骤s1中将碳酸钠溶液在100℃下煮三次;
17.优选的,步骤s2中将烘干后的丝素纤维按照浴比1:10(g:ml)在72℃的三元溶液中缓慢搅拌溶解。
18.优选的,步骤s2中将透析过滤后的丝素蛋白溶液保存于4℃冰箱备用;
19.优选的,步骤s3中透明质酸粉末的质量为丝素蛋白质量的0.05倍;
20.与现有技术相比,本发明具有以下有益效果:
21.1、本发明选用的方法具有反应条件温和、反应时间短、工艺简单等优点。
22.2、本发明制得的改性透明质酸水凝胶的力学性能得到加强,无论是它的拉伸性能还是压缩强度,都在一定程度上得到加强。尤其是,在丝素蛋白:聚乙烯醇=1:0.06下,改性的透明质酸促进胶原蛋白的再生效果更加明显。原因可能是丝素蛋白:聚乙烯醇=1:0.06下改性的透明质酸具有更加稳定的二维空间结构,在二维空间结构以及聚乙烯醇的作用下,诱导胶原酶基因的表达,促进胶原蛋白的生成。
23.3、本发明所用的材料廉价易得。
24.4、本发明改性透明质酸中的聚乙烯醇刺激人体细胞,持续分泌胶原蛋白,使填充效果更持久。
25.5、本发明改性透明质酸时选用的丝素蛋白属于天然添加物,纯绿色无污染。
附图说明
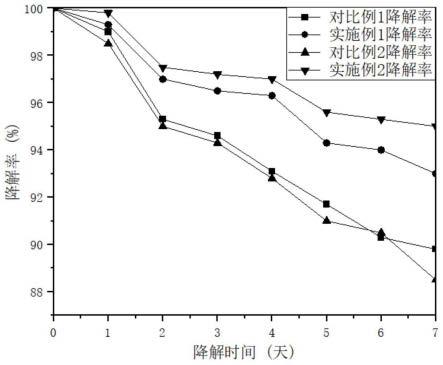
26.图1为本发明实施例1、2和对比例1、2制得的改性透明质酸的降解速率曲线。
27.图2为本发明实施例1、2和对比例1、2制得的改性透明质酸的弹性模量柱状图。
28.图3为本发明实施例1、2和对比例1、2制得的改性透明质酸的压缩强度柱状图。
29.图4为本发明中实施例3制得的透明质酸的扫描图。
30.图5为本发明中实施例4制得的透明质酸的扫描图。
31.图6为本发明实施例1-5在小鼠实验中的胶原蛋白含量图。
具体实施方式
32.实施例1
33.s1、制备天然丝素纤维:称取一定量的家蚕生丝,将其放入4000ml浓度为0.6%的碳酸钠溶液中,在90℃下煮三次,前两次每次处理20min,第三次处理40min,每次处理完再用去离子水漂洗以脱去生丝中的丝胶,然后将脱胶之后的蚕丝扯松,放于60℃的烘箱中烘干,即可得到丝素纤维。
34.s2、配制无水氯化钙、无水乙醇、水的三元溶液,将烘干后的丝素纤维按照一定的浴比在5℃的三元溶液中缓慢搅拌溶解,可事先将丝素纤维剪碎,溶解3h,得到丝素纤维和三元溶液的混合溶液,透析、过滤后即可获得质量分数为8%的丝素蛋白溶液。
35.s3、向s2制备的丝素蛋白溶液中加入透明质酸粉末以及聚乙烯醇粉末,透明质酸粉末的质量为丝素蛋白质量的0.015倍,聚乙烯醇粉末的质量为丝素蛋白质量的0.01倍,并用超声混合的方式将聚乙烯醇粉末和透明质酸粉末分散至丝素蛋白溶液中。
36.s4、选用n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺作为交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占丝素蛋白质量的10%、5%。
37.s5、真空脱泡:将s3制备的改性透明质酸溶液和s4制备的交联剂混合均匀后倒入直径为60mm玻璃皿中,在-40℃冰箱内冷冻12h,然后把所有样品都放到冷冻干燥机中,经12h真空冷冻干燥后即可获得在人体内维持效果更久的改性透明质酸。
38.对比例1:除在步骤s3中不加入聚乙烯醇粉末外,其余步骤与实施例1均相同。
39.实施例2
40.s1、称取一定量的家蚕生丝,将其放入6000ml浓度为0.6%的碳酸钠溶液中,在100℃下煮三次,前两次每次处理30min,第三次处理60min,每次处理完再用去离子水漂洗以脱去生丝中的丝胶,然后将脱胶之后的蚕丝扯松,放于80℃的烘箱中烘干,即可得到丝素纤维。
41.s2、配制无水氯化钙、无水乙醇、水的三元溶液,将烘干后的丝素纤维按照一定的浴比在15℃的三元溶液中缓慢搅拌溶解,可事先将丝素纤维剪碎,溶解3h,得到丝素纤维和三元溶液的混合溶液,透析、过滤后即可获得质量分数为8%的丝素蛋白溶液。
42.s3、向s2制备的丝素蛋白溶液中加入透明质酸粉末以及聚乙烯醇粉末,透明质酸粉末的质量为丝素蛋白质量的0.1倍,聚乙烯醇粉末的质量为丝素蛋白质量的0.07倍,并用超声混合的方式将聚乙烯醇粉末和透明质酸粉末分散至丝素蛋白溶液中。
43.s4、选用n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺作为交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占丝素蛋白质量的30%、15%。
44.s5、将s3制备的改性透明质酸溶液和s4制备的交联剂混合均匀后倒入直径为60mm玻璃皿中,在-40℃冰箱内冷冻36h,然后把所有样品都放到冷冻干燥机中,经48h真空冷冻干燥后即可获得在人体内维持效果更久的改性透明质酸。
45.对比例2
46.将透明质酸粉末溶解于去离子水中,常温下在磁力搅拌器中不停的搅拌使其分散均匀,配制成浓度为7.5%的透明质酸水溶液,然后将其放入4℃的冰箱中备用。向透明质酸
溶液中加入n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占透明质酸质量的37.5%、75%。
47.实施例3
48.s1、称取一定量的家蚕生丝,将其放入4600ml浓度为0.6%的碳酸钠溶液中,在98℃下煮三次,前两次每次处理23min,第三次处理46min,每次处理完再用去离子水漂洗以脱去生丝中的丝胶,然后将脱胶之后的蚕丝扯松,放于68℃的烘箱中烘干,即可得到丝素纤维。
49.s2、配制无水氯化钙、无水乙醇、水的三元溶液,将烘干后的丝素纤维按照一定的浴比在13℃的三元溶液中缓慢搅拌溶解,可事先将丝素纤维剪碎,溶解2h,得到丝素纤维和三元溶液的混合溶液,透析、过滤后即可获得质量分数为8%的丝素蛋白溶液。
50.s3、向s2制备的丝素蛋白溶液中加入透明质酸(透明质酸)粉末以及聚乙烯醇(聚乙烯醇)粉末,透明质酸粉末的质量为丝素蛋白质量的0.07倍,聚乙烯醇粉末的质量为丝素蛋白质量的0.06倍,并用超声混合的方式将聚乙烯醇粉末和透明质酸粉末分散至丝素蛋白溶液中。
51.s4、选用n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺作为交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占丝素蛋白质量的10-30%、5-15%。
52.s5、将s3制备的改性透明质酸溶液和s4制备的交联剂混合均匀后倒入直径为60mm玻璃皿中,在-40℃冰箱内冷冻24h,然后把所有样品都放到冷冻干燥机中,经24h真空冷冻干燥后即可获得在人体内维持效果更久的改性透明质酸。
53.实施例4
54.s1、称取一定量的家蚕生丝,将其放入5000ml浓度为0.6%的碳酸钠溶液中,在95℃下煮三次,前两次每次处理28min,第三次处理50min,每次处理完再用去离子水漂洗以脱去生丝中的丝胶,然后将脱胶之后的蚕丝扯松,放于70℃的烘箱中烘干,即可得到丝素纤维。
55.s2、配制无水氯化钙、无水乙醇、水的三元溶液,将烘干后的丝素纤维按照一定的浴比在10℃的三元溶液中缓慢搅拌溶解,可事先将丝素纤维剪碎,溶解2h,得到丝素纤维和三元溶液的混合溶液,透析、过滤后即可获得质量分数为8%的丝素蛋白溶液。
56.s3、向s2制备的丝素蛋白溶液中加入透明质酸粉末以及聚乙烯醇粉末,透明质酸粉末的质量为丝素蛋白质量的0.08倍,聚乙烯醇粉末的质量为丝素蛋白质量的0.06倍,并用超声混合的方式将聚乙烯醇粉末和透明质酸粉末分散至丝素蛋白溶液中。
57.s4、选用n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺作为交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占丝素蛋白质量的20%、10%。
58.s5、将s3制备的改性透明质酸溶液和s4制备的交联剂混合均匀后倒入直径为60mm玻璃皿中,在-40℃冰箱内冷冻20h,然后把所有样品都放到冷冻干燥机中,经30h真空冷冻干燥后即可获得在人体内维持效果更久的改性透明质酸。
59.实施例5
60.s1、称取一定量的家蚕生丝,将其放入5000ml浓度为0.6%的碳酸钠溶液中,在95
℃下煮三次,前两次每次处理28min,第三次处理50min,每次处理完再用去离子水漂洗以脱去生丝中的丝胶,然后将脱胶之后的蚕丝扯松,放于70℃的烘箱中烘干,即可得到丝素纤维。
61.s2、配制无水氯化钙、无水乙醇、水的三元溶液,将烘干后的丝素纤维按照一定的浴比在10℃的三元溶液中缓慢搅拌溶解,可事先将丝素纤维剪碎,溶解2h,得到丝素纤维和三元溶液的混合溶液,透析、过滤后即可获得丝素蛋白溶液。
62.s3、向s2制备的丝素蛋白溶液中加入透明质酸粉末以及聚乙烯醇粉末,透明质酸粉末的质量为丝素蛋白质量的0.07倍,聚乙烯醇粉末的质量为丝素蛋白质量的0.06倍,并用超声混合的方式将聚乙烯醇粉末和透明质酸粉末分散至丝素蛋白溶液中。
63.s4、选用n-羟基丁二酰亚胺和1-乙基-3-二甲基氨丙基碳化二亚胺作为交联剂,1-乙基-3-二甲基氨丙基碳化二亚胺、n-羟基丁二酰亚胺质量分别占丝素蛋白质量的20%、10%。
64.s5、将s3制备的改性透明质酸溶液和s4制备的交联剂混合均匀后倒入直径为60mm玻璃皿中,在-40℃冰箱内冷冻20h,然后把所有样品都放到冷冻干燥机中,经30h真空冷冻干燥后即可获得在人体内维持效果更久的改性透明质酸。
65.表1实施例1-2和对比例1-2的降解率
[0066][0067][0068]
图1为本发明实施例1、2和对比例1、2制得的改性透明质酸的降解速率曲线,由图可知,随着时间的推移水凝胶的降解速率逐渐下降。实施例1、2的降解速率要慢于对比例1、2,这说明在聚乙烯醇的加入使得透明质酸的网络结构更加稳固,使改性后的透明质酸降解难度增加,被人体吸收后继续在人体内发挥作用时间更长。图2中本发明对比例1和实施例1所制备的透明质酸和改性透明质酸进行拉伸实验得到的弹性模量比较,可以看出普通透明质酸水凝胶的拉伸性能一般,原因是普通透明质酸的二维网络结构不够稳固,透明质酸的机械性能较差;透明质酸水凝胶经过聚乙烯醇改性后,二维网络结构更加稳固,使透明质酸、丝素蛋白、聚乙烯醇三者融合的更加紧密。
[0069]
表2实施例1-2和对比例1-2的弹性模量和压缩强度
[0070] 弹性模量(kpa)压缩强度(kpa)对比例1352
±
120.145
±
0.007实施例1423
±
230.181
±
0.012
对比例2361
±
170.122
±
0.009实施例2431
±
160.185
±
0.011
[0071]
图2为本发明实施例1、2和对比例1、2制得的透明质酸的弹性模量柱状图,从图中可以看出,对比例2制备的普通透明质酸水凝胶的拉伸性能一般,原因是透明质酸都是小分子交联,交联结构不够稳定。透明质酸改性后,拉伸性能的到了一定的改善,和丝素蛋白结合之后,二维网络结构更加稳定。图3为本发明对比例1、2和实施例1、2所制备的透明质酸和改性透明质酸进行压力实验得到的压缩强度图。由图可知,对比例的透明质酸的压缩强度较差,但改性后的透明质酸在压缩强度上有了很大的改善,这说明丝素蛋白与透明质酸结合的更加稳固,增加了改性透明质酸的机械性能,使其发挥更加稳定,也表明聚乙烯醇和丝素蛋白具有一定的协同作用。
[0072]
图4为本发明中实施例3制得的透明质酸的扫描图,从图中可以看出实施例3制得的透明质酸符合多孔支架结构,其中丝素蛋白、聚乙烯醇、透明质酸之间没有明显的相分离,表明这三种组分之间具有良好的相容性。
[0073]
图5为本发明中实施例4制得的透明质酸的扫描图,从图中可以看出实施例4制得的透明质酸符合多孔支架结构,其中丝素蛋白、聚乙烯醇、透明质酸之间没有明显的相分离,表明这三种组分之间具有良好的相容性。
[0074]
表3实施例1-5小鼠实验胶原蛋白含量
[0075] 胶原蛋白含量(ng/mg)实施例110.56
±
0.78实施例211.73
±
0.52实施例39.74
±
0.61实施例48.52
±
0.45实施例514.23
±
1.58
[0076]
图6为实施例1-5在小鼠体内进行实验得到的小鼠局部胶原蛋白的含量图。由图可知,实验例5小鼠局部的胶原蛋白含量大于实验例1-4的含量。在丝素蛋白:聚乙烯醇=1:0.06下,改性的透明质酸促进胶原蛋白的再生效果更加明显。原因可能是丝素蛋白:聚乙烯醇=1:0.06下改性的透明质酸具有更加稳定的二维空间结构,在二维空间结构以及聚乙烯醇的作用下,诱导胶原酶基因的表达,促进胶原蛋白的生成。
[0077]
抗炎症实验
[0078]
使用raw264.7细胞于dmem完全培养基(含10%血清和1%双抗),37℃,5%二氧化碳培养箱中培养48h。添加至1μg
·
ml-1
脂多糖,建立炎症模型。空白组使用完全培养基,阴性对照组添加脂多糖(1μg
·
ml-1
),阳性对照组添加脂多糖(1μg
·
ml-1
)和地塞米松(75μg
·
ml-1
),样品组添加脂多糖(1μg
·
ml-1
)和实施例1-5的样品(75μg
·
ml-1
)。分别进行细胞培养,细胞在6孔板中培养24h后,更换上述各组相应的培养液继续培养24h。以甘油醛-3-磷酸脱氢酶作为内参基因,计算tnf-α、白细胞介素6(il-6)、白细胞介素1β(il-1β)的相对表达量。结果见表4。
[0079]
表4tnf-α、il-6、il-1β三种促炎症因子mrna相对表达含量
[0080]
样品tnf-αil-6il-1β空白对照
‑‑‑
阴性对照82.9
±
2.362325
±
15611409
±
566阳性对照39.7
±
1.634513
±
2584896
±
345实施例1组51.2
±
1.952510
±
3457469
±
236实施例2组53.6
±
2.953498
±
5647897
±
426实施例3组58.5
±
0.951369
±
4477569
±
235实施例4组53.1
±
2.853210
±
2797641
±
254实施例5组45.4
±
1.249316
±
5465321
±
356
[0081]
表1为tnf-α、il-6、il-1β三种促炎症因子mrna相对表达含量。脂多糖可以刺激细胞分泌促炎症因子,而加入了地塞米松得阳性对照组显著下调了tnf-α、il-6、il-1β三种促炎症因子的相对表达量,抑制率分别为51.46、76.8、61.6。加入实施例制备的样品也能降低脂多糖刺激raw264.7细胞的tnf-α、il-6、il-1βmrna的相对表达量。但是从实施例的对比来看,只有实施例5组制备的样品对tnf-α、il-6、il-1β三者的mrna的相对表达量能起到显著的抑制作用,这说明在丝素蛋白:聚乙烯醇=1:0.06下,改性的透明质酸具有显著的抗炎症的作用,这可能与他们的三维网络结构有着密切的关系。
[0082]
综上,本发明制备的可改性透明质酸以透明质酸为基础。丝素蛋白的加入使得透明质酸的二维网络结构更加稳固,结合的更加紧密;聚乙烯醇的掺杂不仅使丝素蛋白和透明质酸交联的更加紧密,增强了水凝胶的机械性能,还在透明质酸和丝素蛋白被降解后,发挥着一定的作用。该方法为医美注射填充剂提供了新的思路,也为改性透明质酸的制备提供了一种新的方法。
[0083]
最后应说明的是:以上所述实施例仅表达了本发明的具体实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1