一种具有形状自适应性的三组分超分子水凝胶及其制备方法与应用
1.本发明属于水凝胶技术领域,具体涉及到一种具有形状自适应性的三组分超分子水凝胶及其制备方法与应用。
背景技术:
2.对于伤口敷料以及创面止血材料而言,敷料与伤口的贴合度是一个非常重要的参考因素。目前为止,许多研究报道的针对创面快速止血的水凝胶材料已经开始有针对性地对水凝胶聚合前体进行修饰(例如多巴胺结构单元修饰),以提高凝胶对皮肤伤口的贴合度。然而,对于传统共价网络构建的水凝胶材料而言,其形状的”自适应性”始终受到一定限制,因此,基于非共价交联作用的水凝胶材料在形状自适应性的需求中体现出了非常大的优势。
3.硼酸酯键作为一种动态可逆的化学键在实际研究中应用非常广泛。在中性条件下,硼酸呈现sp2杂化的平面三角形结构,中心“b”原子与烷基或芳基以及两个羟基键合,而两个羟基能够与顺式邻二醇结构形成可逆的硼酸酯键,这一特性,已成为构建基于硼酸酯键的动态可逆结构的常见手段。通常而言,基于此反应的硼酸酯键的形成条件非常温和,无需外加催化剂即可在水相或者有机溶剂中进行。但是,硼酸酯键的稳定性很大程度上取决于环境的ph值,强酸条件导致硼酸酯键的断裂,生理条件下也会导致该可逆反应往开环的方向进行,而在碱性条件下,能够得到稳定的硼酸酯键(图1)。
4.基于此,研究者们不断对硼酸结构进行修饰,调控整个体系的反应在更倾向于在生理条件下进行,从而得到一系列硼酸基团修饰的化合物,并探究了他们在底物识别与传感、细胞黏附与释放、细胞3d培养以及作为自愈型水凝胶材料等一系列应用。在底物识别与传感的研究中,研究者们主要通过被检测分子(如糖类、糖蛋白和多巴胺等)和顺式二醇结构类分子与硼酸的竞争结合来实现,在检测前后发生某些特定的化学结构或检测信号的变化;而在细胞的黏附与释放领域以及细胞培养的研究中,则是基于硼酸与细胞膜表面的糖蛋白的可逆结合来实现的。糖蛋白是一种含有糖类的蛋白质,在细胞培养、识别、调控和分化中起着重要的作用,其表面含有顺式二羟基能够与硼酸分子进行结合,还在细胞培养操作中得到应用。硼酸酯动态化学键的另一重要应用便是构建”自愈型”的水凝胶材料,研究表明,基于硼酸酯动态化学键构建的水凝胶材料能够在受损的区域周围不断发生动态重排,不断形成新的化学键从而体现出自修复能力。
5.目前,基于硼酸酯动态化学键构建得到的水凝胶用作止血材料的研究报道相对较少,而大多数基于硼酸酯键构建而成的水凝胶或是韧性较差,或是制备过程有较强的ph依赖性,在生理条件下难以调控成胶,亦或是需要通过引入共价化学键来提升整个凝胶材料的强度,因此,开发一种完全基于非共价作用的、生物相容性良好的,同时具有非常好的创面贴合能力的硼酸酯基水凝胶用于创面快速止血具有非常重要的意义。
技术实现要素:
6.本发明的目的是提供一种具有形状自适应性的三组分超分子水凝胶及其制备方法与应用,可以解决现有硼酸酯基水凝胶材料具有一定ph依赖性,需要引入一定共价作用来提升凝胶强度等问题。
7.为达上述目的,本发明提供了一种具有形状自适应性的三组分超分子水凝胶,包括三重网络结构,三重网络结构包括基于pva与硼酸结合形成的第一重网络、基于鸟嘌呤核苷和钾离子自组装得到的第二重网络以及基于鸟嘌呤核苷侧链顺式邻二醇结构和硼酸类分子结合形成的第三重网络。
8.进一步地,第一重网络和第二重网络分别通过非共价自组装连接,第三重网络是通过第一重网络和第二重网络相互缠绕制备得到。
9.进一步地,硼酸类分子的化学结构通式为:
[0010][0011]
其中,r基团为烷基、苯基、羟基、羧基、卤素原子、氰基或氨基。
[0012]
优选的,当r基团为羟基的硼酸分子的结构式为:
[0013][0014]
本发明还提供了一种上述具有形状自适应性的三组分超分子水凝胶的制备方法,为:于水溶液中通过一步法混合预制备液制备得到。预制备液包括预制备液a和预制备液b,预制备液a为将鸟嘌呤核苷溶于钾离子溶液得到,预制备液b为将聚乙烯醇溶于硼酸类分子溶液得到。
[0015]
进一步地,预制备液a通过以下方法制备得到:于浓度为0.05-0.15mol/l的钾离子溶液中溶解鸟嘌呤核苷,其中预制备液a的鸟嘌呤核苷的浓度为18-22mg/ml,热溶解的温度为37-100℃。
[0016]
进一步地,预制备液b通过以下方法制备得到:将聚乙烯醇于加热状态下完全溶解于硼酸分子溶液中,其中硼酸类分子溶液的浓度为35-45mmol/l,加热温度为95-105℃,优选为100℃。
[0017]
进一步地,包括以下步骤:
[0018]
(1)稀释预制备液a,得到溶液a;
[0019]
(2)然后制备预制备液b后,立刻在涡旋状态下向溶液a中加入预制备液b,制得混合溶液,快速混匀后混合溶液静置数秒,冷却后制得具有形状自适应性的三组分超分子水凝胶。其中优选的静置时间为60s。
[0020]
进一步地,混合溶液中鸟嘌呤核苷的反应浓度为3-10mg/ml,硼酸类分子的浓度为2-30mmol/l。优选的,硼酸类分子(b)的成胶浓度为22.86mmol/l,鸟嘌呤核苷(g)的成胶浓度为5.71mg/ml。
[0021]
优选的,上述制备方法包括以下具体步骤:
[0022]
(1)以0.1mol/l的kcl溶液溶解鸟嘌呤核苷(g)得到预制备液a(g=20mg/ml)。
[0023]
(2)将pva在100℃的加热状态下完全溶解于硼酸类分子溶液中得到预制备液b(硼酸类分子的浓度为40mm)。
[0024]
(3)将预制备液a经不同体积的超纯水稀释,得到不同浓度的溶液a,随后在涡旋状态下向溶液a中加入预制备液b,快速混匀后静置,得到基于超分子作用的三组分凝胶tri-ba@pva/g。其中,成胶单体硼酸b的浓度为22.86mmol/l,鸟嘌呤核苷g的成胶浓度为5.71mg/ml,凝胶成胶总体积为1.4ml,成胶温度为25℃。
[0025]
本发明还提供了一种上述具有形状自适应性的三组分超分子水凝胶在制备创面快速止血药剂中的应用。
[0026]
综上,本发明具有以下优点:
[0027]
1、本发明制备的具有形状自适应性的三组分超分子水凝胶,其制备过程简单、反应过程迅速,而且有着良好的生物相容性,对伤口出血部位有着非常好的贴合能力,能够实现创面部位的快速止血,并且对出血部位的愈合有着一定的促进作用。
[0028]
2、本发明合成了完全基于超分子作用的硼酸酯基水凝胶,该水凝胶由三重网络交联得到,在成功合成此三组分超分子水凝胶的基础上,实现水凝胶的细胞层面的生物相容性表征、体外溶血实验表征以及体外形状自适应性表征等。
[0029]
3、本发明利用完全非共价作用制备的三组分超分子硼酸酯基水凝胶,制备简便快速、凝胶透明度高、形状适应性强、经体外细胞实验验证其生物相容性良好,且不会引发机体溶血现象。本发明优选的超分子硼酸酯基水凝胶有效弥补了常见硼酸酯基水凝胶韧性差、制备过程中ph依赖性等缺陷。
[0030]
4、本发明反应条件温和、高效快速,有效拓展了硼酸基超分子水凝胶在创面快速止血领域的应用,也为完全基于超分子作用的形状自适应性的硼酸基水凝胶的设计合成提供了新思路。
附图说明
[0031]
图1为硼酸与顺式邻二醇的可逆化学键的形成;
[0032]
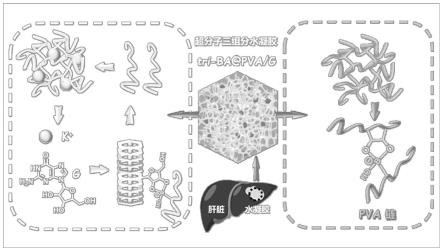
图2为基于超分子相互作用的硼酸酯基三组分水凝胶超分子tri-ba@pva/g的制备过程示意图;
[0033]
图3为鸟嘌呤核苷的析出临界值拟合曲线,其中图3(a)为水凝胶中鸟嘌呤核苷少量析出/大量析出临界值拟合曲线;图3(b)为水凝胶稳定存在与水凝胶中鸟嘌呤核苷少量析出的临界值拟合曲线;
[0034]
图4为水凝胶tri-ba@pva/g的扫描隧道显微镜形貌表征结果;
[0035]
图5为水凝胶tri-ba@pva/g的eds能谱结果;
[0036]
图6为水凝胶tri-ba@pva/g的失水以及吸水溶胀性质测试结果;
[0037]
图7为水凝胶tri-ba@pva/g的形状自适应性测定结果;
[0038]
图8为不同凝胶组材料在不同浓度下的溶血现象;
[0039]
图9为不同凝胶组材料在不同浓度下的溶血率测定计算结果;
[0040]
图10为不同浓度的w8凝胶浸提液的细胞毒性试验测定结果;
[0041]
图11为不同浓度w8凝胶浸提液的细胞培养、细胞骨架-细胞核染色以及细胞成像试验结果;
[0042]
图12为不同浓度w8凝胶浸提液的细胞培养、细胞骨架-细胞核染色以及细胞成像放大后的试验结果;
[0043]
图13为sd大鼠肝脏止血模型建立以及凝胶止血试验结果;
[0044]
图14为sd大鼠肝脏组织病理结果分析;
[0045]
图15为三组分超分子水凝胶tri-ba@pva/g的结构特征。
具体实施方式
[0046]
本发明中的下列实施例中,在步骤(1)中0.1mol/l的kcl溶液溶解鸟嘌呤核苷(g)时,溶解温度为100℃;步骤(2)将pva在加热状态下完全溶解于硼酸溶液时,先用去离子水配制得到40mmol/l硼酸母液,随后用此硼酸母液在回流状态下完全溶解pva,所用溶剂为去离子水。
[0047]
本发明的具有形状自适应性的硼酸基三组分超分子水凝胶,主要通过简单的预制备液a和预制备液b混合静置得到,下面结合实施例对本发明进行详细说明。
[0048]
本发明中的具有形状自适应性的三组分超分子水凝胶也可以称之为具有形状自适应性的基于硼酸酯键的三组分超分子水凝胶或基于超分子相互作用的硼酸酯基三组分水凝胶超分子tri-ba@pva/g。
[0049]
以下结合实施例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0050]
实施例1
[0051]
如图2所示,本实施例提供了一种具有形状自适应性的三组分超分子水凝胶的制备方法,包括以下步骤:
[0052]
(1)以0.1mol/l的kcl溶液溶解鸟嘌呤核苷(g)得到预制备液a(g=20mg/ml)。
[0053]
(2)将pva在加热状态下完全溶解于硼酸溶液中得到预制备液b(硼酸=40mm)。
[0054]
(3)将预制备液a经不同体积的超纯水稀释,得到不同浓度的溶液a,随后在涡旋状态下向溶液a中加入不同体积的预制备液b,快速混匀后静置,冷却后得到9组基于超分子作用的三组分凝胶tri-ba@pva/g。其中,成胶单体硼酸b的浓度、鸟嘌呤核苷g的成胶浓度、凝胶成胶总体积如表1所示,成胶温度为25℃。
[0055]
表1不同配比条件下的凝胶成胶情况
[0056][0057][0058]
实验结果:按照上述条件筛选过程,共计制备了5*9=45个凝胶样品用于成胶条件的筛选以及后续性质的考察。其中,凝胶制备模具为2.0ml ep管,采用倒转法判定是否成胶,制备完成的凝胶经25℃放置24h后进行凝胶稳定性的考察,主要分析凝胶网络中鸟苷的析出情况。
[0059]
首先考察不同浓度g下凝胶的成胶情况,结果如表2所示。
[0060]
表2成胶情况
[0061][0062]
注:-为不成胶,+为成胶。
[0063]
从表2中可以发现,当[g]=3.33mg/ml时(对应表1中样品q1~q9),不论硼酸浓度为何种比例,均无法形成凝胶;分析原因可能是g浓度过低,与体系中“k
+”和硼酸分子的结合作用都不够强,因此无法形成稳定的凝胶;而当g浓度范围在“5.71~10.00mg/ml”时(对应表1中样品编号w~y,1~9),可形成稳定凝胶(共计36个凝胶样品)。进一步地,详细分析不同g浓度下,成胶后的凝胶放置24小时后,凝胶网络中g的析出情况,结果如表3所示。
[0064]
表3不同g浓度下,成胶后的凝胶放置24小时后,凝胶网络中g的析出情况
[0065][0066][0067]
注:++为g大量析出,+为g少量析出,-为g不析出。
[0068]
由表1-3可以看出,本发明最佳的实例中,硼酸的成胶浓度为22.86mmol/l,鸟嘌呤核苷g的成胶浓度为5.71mg/ml,凝胶成胶总体积为1.4ml。
[0069]
值得说明的是:本发明通过上述方法和对应浓度进行凝胶制备,本领域技术员可以对所用浓度以及凝胶体积进行调整。
[0070]
实施例1制得的具有形状自适应性的三组分超分子水凝胶tri-ba@pva/g具有如图15所示的结构特征:
[0071]
图15中,pva中侧链的顺式邻二醇结构和硼酸交联形成第一重凝胶网络,g和钾离子通过自组装作用形成第二重凝胶网络,g结构单元中的顺式邻二醇结构和硼酸形成硼酸酯键构建成为水凝胶的第三重网络。第一重网络和第二重网络分别通过非共价自组装形成得到,第三重网络进一步通过第一重网络和第二重网络相互缠绕(非共价作用)得到。单纯g和钾离子自组装可以成胶,但是非常不稳定;同时单纯pva和硼酸成胶对成胶环境的ph依赖性很强,本发明通过简单混合预制备液在生理条件下即可快速制备得到三重网络结构的稳定凝胶。
[0072]
关于本技术文件制备的tri-ba@pva/g弥补ph依赖性缺陷的原理如下:
[0073]
如图1所示,在中性条件下,硼酸呈现sp2杂化的平面三角形结构,中心“b”原子与
烷基或芳基以及两个羟基键合,而两个羟基能够与顺式邻二醇结构形成可逆的硼酸酯键,这一特性,已成为构建基于硼酸酯键的动态可逆结构的常见手段。通常而言,基于此反应的硼酸酯键的形成条件非常温和,无需外加催化剂即可在水相或者有机溶剂中进行。但是,硼酸酯键的稳定性很大程度上取决于环境的ph值,强酸条件导致硼酸酯键的断裂,生理条件下也会导致该可逆反应往开环的方向进行,而在碱性条件下,能够得到稳定的硼酸酯键。
[0074]
基于以上反应条件的限制,许多基于硼酸酯键构建得到水凝胶材料都需要将成胶ph调节至碱性条件,从而使得整个凝胶体系更加稳定。而在本发明中,由于凝胶内部既有pva与硼酸自组装形成的第一重网络,又贯穿鸟嘌呤核苷和钾离子自组装形成的第二重网络,且两重网络之间进一步通过硼酸酯动态化学键的形成进一步交联,使得整个凝胶体系能在中性条件下稳定形成,从而弥补传统硼酸酯键水凝胶制备过程中的ph依赖性等缺陷。
[0075]
试验例1
‑‑‑
基于预制备液a中鸟嘌呤核苷溶解温度的调整
[0076]
1、实验方法:
[0077]
在凝胶制备过程中,首先配制0.1mol/l的kcl母液,随后在不同温度下以此母液溶解相同质量的鸟嘌呤核苷(g),观察g的溶解情况。
[0078]
2、实验结果:
[0079]
表4温度与溶解情况
[0080][0081]
如表4所示,在鸟嘌呤核苷溶解温度的筛选过程中发现,以0.1mol/l的kcl溶液溶解g,当温度为37℃和50℃时,g只能部分溶解,整个体系为悬浮液;继续升高温度至70℃,鸟苷发生溶解,但降温很快析出,影响后续凝胶制备。只有在温度为100℃的情况下,g能够完全溶解且保证长时间不析出,因此确定最佳的凝胶制备温度为100℃。
[0082]
试验例2
‑‑‑
不同比例下凝胶成胶情况结果分析与讨论
[0083]
根据表1的结果,以坐标形式(a,b)(其中a代表g的浓度,b代表硼酸b浓度)表示g少量析出和大量析出的临界值,以及表示稳定成胶与少量析出的临界值,可以发现g少量析出与大量析出的临界坐标值为(5.71,5.71)、(7.5,7.5)、(8.89,8.89)以及(10.00,10.00),刚好处在硼酸摩尔浓度与鸟嘌呤核苷质量浓度数值相等的临界线上;而稳定成胶与鸟苷少量析出的临界坐标值为(5.71,17.14)、(7.5,17.50)、(8.89,17.78)以及(10.00,18.00)。随后根据此临界数据值进行线性拟合,结果如图3所示。
[0084]
由图3可知,在图3(a)中,当选择的浓度(a,b)正好位于拟合曲线上时,预期凝胶性质可能为g大量析出的情况,整个图像上方区域的浓度分布,鸟嘌呤核苷少量析出;而整个图像下方区域,凝胶中g预期大量析出且凝胶经放置后发生坍塌。在图3(b)中,当在曲线下方区域进行凝胶制备中的浓度选择时,预期凝胶性质表现为鸟苷少量析出,但是凝胶整体较为稳定;若想制备出性质稳定并且鸟苷不发生析出的凝胶,则应尽量在该拟合曲线上方区域进行浓度选择。
[0085]
总的来说,上述实验结果表明,此基于超分子作用的三组分凝胶,各个组分需要控制在相对适当的比例,以保证凝胶的稳定性。拟合结果,对后续的基于超分子作用的三组分凝胶的合成、浓度选择以及后续凝胶性质预测是具有一定启发意义的。
[0086]
试验例3
‑‑‑
三组分凝胶tri-ba@pva/g的形貌表征以及eds能谱分析
[0087]
1、实验方法:
[0088]
基于超分子作用的三组分凝胶tri-ba@pva/g的形貌通过sem进行表征,具体操作步骤为:样品经冻干后粘贴置导电胶上,置于载物台,表面喷金后观察形貌;凝胶断面形貌观察:样品经冻干、脆断暴露出断面,随后置于载物台上经表面喷金后进行断面形貌观察随后采用x射线能谱(eds)对凝胶tri-ba@pva/g中的微观区域元素分布进行定量分析。
[0089]
2、实验结果:
[0090]
在上述凝胶的制备过程以及条件筛选过程中可以发现,不同浓度比例所合成的凝胶的基本性质主要分为三种。因此在形貌表征部分,选取表1中w-y组中的部分具有代表性的样品进行观察,结果如图4所示。
[0091]
根据各组的扫描电镜结果,分析对比发现,鸟苷浓度与硼酸浓度均较小的凝胶样品图4(a1~d1),内部孔隙较为疏松,并且在脆断过程中,我们发现其韧性较低;随着硼酸浓度增大,各组中凝胶内部孔隙逐渐趋于有序,且凝胶韧性也逐渐增加,对应凝胶的稳定性较好,内部无鸟嘌呤核苷的析出图4(a2~d2,a3~d3),充分证明凝胶的组分浓度对凝胶内部结构以及性能有着非常重要的影响。
[0092]
随后,用eds能谱,考察了凝胶网络中,“b、c、n、o、cl和k”各元素的分布,如图5和表5所示。
[0093]
表5不同组分比例下的凝胶tri-ba@pva/g的元素含量以及分布
[0094][0095]
表5中给出的各元素的相对百分含量中可以看出,作为凝胶基本骨架,碳元素的分布在各个样品中分布最多,从样品w8-y8,“n”元素的相对百分含量增加,这正是由于样品中鸟苷浓度逐渐增加引起的。
[0096]
从图5中能够清晰地观察到各个元素在凝胶中的分布情况,表明基于超分子相互
作用的交联是充分进行的。
[0097]
试验例4
‑‑‑
凝胶tri-ba@pva/g的失水以及吸水溶胀性质测试
[0098]
1、实验方法:
[0099]
在圆柱形容器中平行制备6个凝胶样本,待凝胶稳定形成后,将其中三个凝胶样本进行冷冻干燥,用于溶胀性质测定;剩余三个凝胶样本置于37℃摇床中,其中凝胶样本与空气接触的面积为1.0cm2,并在初始时刻以及规定的时间间隔对凝胶进行称重,计算不同时刻凝胶的失水率。
[0100]
凝胶吸水溶胀实验:首先对冷冻干燥的凝胶样本进行称重,记录完全干燥条件下初始时刻凝胶的重量。随后迅速将凝胶样本完全浸泡在pbs溶液中,其中凝胶的厚度约为2cm,浸泡液的总体积为10ml,将其置于恒温恒湿箱中,温度设定37℃,湿度60%,每隔12h,取出凝胶样本,将其倾斜放在表面皿边缘,待凝胶底部不再渗出pbs溶液时,对凝胶进行称重,记录对应时刻的重量,直到凝胶重量不再明显增加为止。根据初始以及结束时刻凝胶的重量计算凝胶的吸水率。
[0101]
2、实验结果:
[0102]
凝胶作为具有三维网络特性的材料,内部能够维持大量水分,因此,凝胶的吸水以及失水特性是水凝胶材料一项重要的评价参数。然而,水凝胶的失水能力不仅仅受到自身固有性质的影响,往往也与实验过程中,凝胶与空气接触的表面积大小有着很大的关系。当凝胶在空气中暴露的面积增加,凝胶失水率随之升高,因此,分析计算前120min时三组分凝胶的失水行为,并且发现,其每平方厘米的失水率(%)与时间(min)符合图6中的多项式拟合函数关系(r2=0.9976),表明凝胶整个失水行为是缓慢进行的,不会在短时间内表现出瞬间脱水的现象。同时,平行测定三个样本,收集凝胶样本重量达到平台的数据,计算得到该三组分凝胶的最大含水量约为89.10%(error bar:1.17%)。在溶胀性质测定实验中,根据公式凝胶含水量=(w
t-w0)/w0*100%(其中,w
t
为凝胶达到溶胀平衡时的重量;w0为初始时刻凝胶在完全干燥的条件下时的重量)计算得到三个凝胶样本的平均溶胀率高达549.33%(error bar:38.51%),该实验结果充分表明,凝胶有着非常好的吸水能力,并且在长时间pbs浸泡下凝胶网络并不会发生坍塌,证明该凝胶在作为伤口止血材料时,能够快速吸液从而达到快速止血的效果。
[0103]
试验例5
‑‑‑
水凝胶tri-ba@pva/g的形状自适应性能力考察
[0104]
1、实验方法:
[0105]
在1.5ml ep管中分别制备凝胶tri-ba@pva/g并着色,随后将凝胶从ep管中取出并碾压以破坏原有形状,并置于称量纸上静置30min;30min后,再次将凝胶放入ep管中,倒置ep管观察凝胶的形成情况。此外,准备形状各异的模具,将凝胶从ep管中取出后,放入模具当中,观察凝胶对不同形状模具的贴合能力。
[0106]
2、实验结果:
[0107]
鉴于此三组分凝胶完全通过超分子作用自组装而成,有可能在形状自适应性上体现出较大的优势,在应用过程中完美贴合伤口,因此,本试验例对凝胶的形状变化能力进行了考察,为了更清楚地观察凝胶的形状变化,分别用黄色和红色的染料对不同的凝胶样本进行着色。
[0108]
从图7中可以明显观察到,初始时刻稳定成胶的两个样本,从ep管中取出后,经外
部机械力碾压可完全涂抹在称量纸上,此时仍然呈凝胶状;在滤纸上静置30min后,将红色和黄色的凝胶重新转移至ep管中,倒置ep管发现两个样本均完全重塑而不发生坍塌;此外,将滤纸上的凝胶转移至形貌不规则的模具当中,发现凝胶能够完全贴合模具边缘而不发生坍塌,充分展示出该三组分凝胶的形状自适应性,有望对伤口进行完美贴合。
[0109]
试验例6
‑‑‑
凝胶材料体外溶血试验测定
[0110]
1、实验方法:
[0111]
(1)红细胞悬液的制备:取新鲜兔血20ml,加入抗凝剂肝素钠,随后加入生理盐水200ml,摇匀后在1000~1500rpm下离心15分钟,离心温度为4℃,随后除去上清液,沉淀的红细胞再用生理盐水按照同样的方法洗涤2~3次,直到上清液不显红色为止。将所得红细胞用生理盐水配成10%的红细胞悬液(其中红细胞1ml,加生理盐水至10ml),供试验用。
[0112]
(2)实验准备以及实验分组设计:取1.5ml干净ep管并编号,其中0至5号管为实验组,6号管为阴性对照组(加入生理盐水),7号管为阳性对照组(完全溶血对照,加入蒸馏水)。随后,按表6所示,向各ep管中依次加入10%红细胞悬液,含有材料的0.9%氯化钠(即生理盐水)溶液,生理盐水以及蒸馏水,混匀后,立即将样品置于(37
±
0.5)℃的恒温水浴中进行温育,观察并记录各管的溶血情况。每隔1h观察1次,观察3h,并拍照记录各组溶血情况。
[0113]
表6体外溶血实验记录
[0114][0115]
(3)酶标仪测定紫外吸收并计算溶血率:拍照记录完成以后,取上清液,加入96孔板中(100μl/孔,n=3),用酶标仪测定上清液在570nm处的紫外吸收,并根据如下公式计算得到材料的溶血率(溶血率超过5%视为溶血):
[0116]
溶血率(%)=(样品吸收-阴性照吸收)/(阳性对照吸收-阴性对照吸收)
×
100%
[0117]
2、实验结果:
[0118]
从图8的实验结果中可以发现,各个凝胶材料组,在浓度0.1mg/ml~8.0mg/ml的范围内,均未发生溶血现象,红细胞全部下沉,上清液澄清透明,与阴性对照-生理盐水组的红细胞聚集行为相同,而此时阳性对照组红细胞已经完全发生破裂,整个ep管中溶液呈澄清透明的红色。上述实验结果初步表明,凝胶材料r-y组,均不会引发溶血效应。
[0119]
根据上述试验结果,进一步利用多功能酶标仪,对各材料组的上清液的紫外吸收进行测定,并对不同浓度下各组材料的溶血率进行计算,实验结果如图9所示。以溶血率=5%作为临界溶血值参照,可以发现图9(a-c)对应的材料w8、r8以及t8,计算所得溶血率均远远小于5%;而图9(d)组中测定的溶血率表现出较大的误差,可能是由于凝胶材料y8在短暂放置后,表现出“g”少量析出的现象。因此,在紫外测定中,对整个上清液的测定结果产生干扰。但是,每组材料,各个浓度范围,整体溶血率均远小于5%。上述定性以及定量实验均表明,各个投料比下的三组分凝胶材料并不会使机体发生溶血现象。
[0120]
试验例7
‑‑‑
凝胶tri-ba@pva/g浸提液的细胞毒性试验
[0121]
1、实验方法:
[0122]
浸提液的体外细胞毒性实验通过cck-8法测定。采用人神经胶质瘤(u87)细胞测试,细胞生长至一定密度后,消化接种到96孔培养板中,细胞密度为10000个/孔,在37℃下,5%co2的孵箱中培养24h至大约70-80%的细胞密度后,移去原有培养基,加入100μl含不同降解液浓度的dmem完全培养液,继续培养24h。随后移去培养液,向每孔中加入cck-8溶液(按10%比例在pbs溶液稀释得到),在37℃孵箱中作用30min。用酶标仪测定每个孔在450nm处的吸光值i。细胞相对存活率计算公式为:细胞存活率(%)=(i
样品
/i
对照
)
×
100%,其中,i的测量值为其中3个独立平行样品所测得的值,细胞存活率表示为平均值
±
标准偏差(sd)。对照组设置为不加入凝胶材料浸提液的空白对照,只有细胞。
[0123]
2、实验结果:
[0124]
对凝胶材料的生物学应用可能性进行了初步的考察,首先进行了不同浓度凝胶浸提液的细胞毒性实验。从图10中可以看出,当浸提液浓度高达10.0000mg/ml时,细胞存活率接近80%,而浓度较小时几乎不表现出细胞毒性,充分证明该凝胶材料浸提液有着良好的生物相容性。因此,可尝试将材料运用于进一步的细胞培养以及动物实验当中。
[0125]
试验例8
‑‑‑
不同浓度w8凝胶浸提液的细胞培养、细胞骨架-细胞核染色以及细胞成像试验
[0126]
1、实验方法:
[0127]
将人神经胶质瘤(u87)细胞接种到玻底24孔细胞培养板内,细胞密度为100000个/孔,在37℃下,5%co2的孵箱中培养24h至大约70-80%的细胞密度,再更换500μl不同浸提液浓度的含fbs的dmem培养基,在孵箱中继续培养24h后,移去含有材料的培养液,进一步进行细胞染色成像。细胞核与细胞骨架染色步骤:在进行细胞骨架荧光成像实验之前,细胞经
①
4%多聚甲醛室温固定30min;
②
pbs浸泡10min(3次);
③
0.5%triton-x100透膜15min;
④
pbs浸泡10min(3次);
⑤
tritc phalloidin(200nm)37℃避光染色60min;
⑥
pbs浸泡10min;
⑦
洗去;
⑧
采用细胞核染料hoechst 33342(1μg/ml)避光室温染色15min;
⑨
pbs洗一次;
⑩
在激光共聚焦荧光成像仪下成像。
[0128]
2、实验结果:
[0129]
根据上述细胞毒性实验结果,分别设置了空白对照组以及不同浓度(2mg/ml;4mg/ml;6mg/ml;8mg/ml;10mg/ml)的浸提液组与细胞共同培养24h后,对细胞骨架与细胞核进行同时成像,图11为经染色后的细胞的共聚焦成像试验结果。从图11可以看出,当浸提液的浓度范围为0~6mg/ml时(图13(a
1-a4,b
1-b4,c
1-c4,d
1-d4)),视野中细胞数目较多,并且骨架结构清晰,细胞核形态完好,结合图12中的细胞毒性实验结果,表明此浓度下的浸提液几乎不表现出细胞毒性;当浸提液浓度增加至8mg/ml以及10mg/ml时(图11(e
1-e4,f
1-f4),视野中的细胞数目略微减少,但是仍然能够观察到清晰的骨架与细胞核结构,可能是由于在高浓度下,材料对于细胞产生一定毒性,导致在染色过程中被洗去。同时,可以看出,在对细胞骨架与细胞核同时成像的过程当中,由于骨架与核并非处在同一个焦平面,因此当对骨架进行清晰成像的同时,细胞核形态变得模糊;同样的,当对细胞核进行清晰成像时,细胞骨架的形态变得不那么清晰,因此,选取大视野中的部分区域进行局部放大,选取不同的焦平面对骨架与核同时进行清晰成像,结果如图12所示。在放大的视野中,能够非常清晰地观察到
细胞骨架的丝状结构,叠加场骨架与核的形态都清晰可见。
[0130]
上述浸提液与细胞共培养后的成像实验结果表明,该凝胶的生物相容性非常好,即使在较大的浓度下也能保持较高的细胞存活,并且对细胞的形态不会产生影响。
[0131]
试验例9
‑‑‑
sd大鼠肝脏止血模型的建立,材料的体内止血性能评价以及肝脏组织病理检测试验
[0132]
1、实验方法:
[0133]
通过本试验例建立sd大鼠肝脏出血模型来评估凝胶tri-ba@pva/g的止血能力。将10只sd大鼠(雄性,200-250g),将大鼠随机分为空白对照组(n=3)和实验组(n=7)。用8%水合氯醛溶液麻醉sd大鼠,然后打开大鼠腹部使肝脏充分暴露,将干燥的滤纸预先置于肝脏下方,并垫上一层硅酮橡胶。使用5mm活检穿孔器在肝脏上制造一个2cm深的创孔引起出血,小心移除肝脏周围的浆液,防止滤纸所获得的血液重量不准确。在实验中,空白组的伤口不做任何处理;对于实验组,每只大鼠,分别用灭菌的湿润状态的凝胶以及冻干凝胶对伤口进行处理,并且开始记录止血时间,直到血液不再流出即为止血完成。通过对比各组的止血时间长短以及计算滤纸在止血前后的重量计算失血总量。止血实验完成以后,重新将肝脏置入小鼠体内,饲养三天,随后处死大鼠,取实验的肝脏组织,对实验伤口部位进行切片染色,观察伤口部位的愈合情况。he染色试验样本处理与图像采集:固定组织经全自动脱水机脱水,包埋,切片后如下操作:
[0134]
①
切片脱蜡至水;
②
苏木精染色10-20min;
③
自来水冲洗1-3min;
④
盐酸酒精分化5-10s;
⑤
自来水冲洗1-3min;
⑥
放入50℃的温水中或弱碱性水溶液返蓝,直到出现蓝色为止;
⑦
自来水冲洗1-3min;
⑧
放入85%的酒精3-5min;
⑨
伊红染色3-5min;
⑩
水洗3-5s;然后再依次进行梯度酒精脱水、二甲苯透明、中性树胶封固(注:以上标本均按病理检验sop程序进行);图像采集时先将切片于
×
40下观察全部组织和大体病变,再选择要观察的区域采集
×
50和
×
200图片,观察具体病变。
[0135]
上述动物实验方案已通过四川大学实验动物伦理委员会审核批准,实验过程遵循了国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规。实验动物在麻醉下进行所有的手术,并尽一切努力最大限度地减少其疼痛、痛苦和死亡。
[0136]
2、实验结果:
[0137]
在凝胶应用领域的考察时,建立了大鼠肝脏损伤模型评价三组分凝胶的止血性能(图13)。利用灭菌后的注射器针头对大鼠肝脏造成伤口,其中,空白组的伤口不经任何处理,伤口自由出血;而材料组中的大鼠左右两页肝脏分别经未冻干与冻干的凝胶进行止血,湿润状态下凝胶可通过注射方式置于出血部位,并且分别在0s、30s、60s、90s以及120s时记录伤口出血量,实验完成后,重新将sd大鼠的肝脏植入体内,观察肝脏创面的愈合情况。接下来,根据滤纸在吸血前后重量的差值计算分别计算出空白组、湿润凝胶处理组以及冻干凝胶处理组的大鼠肝脏总出血量,绘制成图13(b)中的柱状图,从图13中可以看出,未经处理的空白组,大鼠肝脏出血量高达30mg以上,并且明显观察到滤纸上有大量血液渗出(图13(c)(a1-a5));经湿润凝胶处理以及冻干凝胶止血处理的肝脏,总出血量明显降低(图13(b),p《0.001),其中湿润凝胶处理的样本总出血量略高于干燥凝胶处理的样品。这可能是由于:1、湿润的凝胶材料,其网络中仍然维持大量水分,材料本身的吸水能力小于冻干凝胶;2、湿润凝胶网络中含有的部分水分被滤纸吸收,导致整体实验结果偏大,从图13(c)
(b1-b5)中可以明显观察到,肝脏创伤造成后的30s,滤纸中有少量血迹,随着时间延长,血液面积并未增加,只观察到滤纸被凝胶中水分所浸湿的面积不断增大,说明湿润凝胶,对肝脏创面在短时间内有良好的止血效果。而冻干凝胶的止血能力相较于湿润凝胶最好,结合凝胶溶胀性质测定结果,可以推断出干燥凝胶有着非常好的吸水性能,即使完全浸泡在溶液当中,其快速吸水后也能够维持自身的网络结构完整。从图13(c)(c1-c5)中可以看出,滤纸上并没有血液的渗出,伤口产生的血液完全被干燥凝胶所吸收。
[0138]
综上所述,两种状态下的凝胶材料均对大鼠创面具有明显的止血能力,在实际运用过程中,可以根据需求,选取湿润状态或是冻干状态的凝胶进行止血。湿润状态的凝胶,虽然吸水能力相对较弱,但流动性非常好,能够充分贴合伤口的形状,实现可注射式的止血;而冻干状态的凝胶,其吸水能力非常好,易于保存,能够充分吸收伤口处渗出的血液,在短时间内达到非常好的止血效果。
[0139]
进一步地,分别对空白组以及实验组(凝胶材料止血)肝脏作病理切片观察伤口病变情况,结果如图14所示。从图中可以明显观察到,空白组100倍镜下有大量肝细胞坏死部分(绿色箭头),进一步放大该区域,可见肝细胞坏死区域伴随大量炎症细胞浸润(蓝色区域);图14(b1-b2)为经湿润凝胶止血的肝脏切片染色结果,在整个视野中,几乎没有观察到肝细胞坏死,在放大视野中观察到明显纤维组织增生,整体愈合情况相较于空白组更好;图14(c1-c2)为冻干凝胶止血后的肝脏组织,在大视野中,可以发现小部分肝细胞坏死区域(绿色箭头),坏死部分同样有大量炎细胞浸润(蓝色区域),同时边缘有纤维组织增生(黄色箭头),纤维组织增生处,观察到成纤维细胞的聚集(黑色区域),证明整体病变程度较空白组更轻。结合图13中的止血实验结果,充分证明该凝胶不仅能够实现伤口快速止血,同时还能对伤口的愈合有一定促进作用。
[0140]
综上所述,本发明合成所得具有形状自适应性的硼酸酯基三组分超分子水凝胶tri-ba@pva/g(即具有形状自适应性的三组分超分子水凝胶),制备条件温和,反应简单快速,在前期制备条件的筛选中,通过大量不同的组分比例的严格考察对不同组分对凝胶成胶的影响,同时模拟出组分含量与凝胶稳定性的拟合曲线,为后期稳定性凝胶的合成工作具有重要的指导意义。同时扫描电镜等凝胶基本性质表征,也充分展示出不同组分比例合成所得凝胶的性能以及内部结构差异性。在优化出最佳的成胶比例后,体外溶血实验结果表明,凝胶降解液并不会使机体产生溶血现象,并且以不同浓度的浸提液进行细胞毒性以及细胞共培养实验,均展示出材料良好的生物相容性。进一步建立起的大鼠伤口止血模型证实了湿润状态下的凝胶tri-ba@pva/g表现出良好的形状适应性,通过可注射的方式完美贴合出血部位,实现快速止血的效果;另外,干燥状态下的凝胶tri-ba@pva/g同样以其快速的吸液能力在用作伤口止血材料时表现出良好的止血效果,同时伤口病理分析试验结果证明凝胶对于伤口愈合有着一定的促进作用,这为非ph依赖型的简单高效的非共价作用构建形状自适应性水凝胶材料提供了新的思路。
[0141]
虽然对本发明的具体实施方式进行了详细地描述,但不应理解为对本专利的保护范围的限定。在权利要求书所描述的范围内,本领域技术人员不经创造性劳动即可作出的各种修改和变形仍属本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1