一种多取代吲哚化合物的制备方法及其应用
1.本专利申请涉及有机化合物合成反应领域,更具体地,涉及一种多取代吲哚化合物的制备方法及其应用。
背景技术:
2.吲哚,作为天然产物(如生物碱)、药物分子(如吲哚美辛)以及荧光探针、染料等功能材料中无处不在的核心骨架,其简捷构建也吸引了合成化学家的持续关注。经典的吲哚合成方法有:fischer吲哚合成法(j.am.chem.soc.,2002,124,11342-11348.)、bartoli吲哚合成法(j.org.chem.,1996,61,9055-9059.),hemetsberger吲哚合成法(j.chem.soc.,perkin trans.1,2000,1045-1075.)。上述策略为吲哚类天然产物、药物以及功能材料等的高效合成提供了重要途径。
3.但究其合成方法本身来说,上述方法仍存在着一些局限有待解决:
4.1)往往需要预先制备的多官能团化的原料,例如对于fischer吲哚合成来说,当使用底物含有两个α位不同取代基的羰基类化合物时,所获得的产物的选择性较差;对于bartoli吲哚合成法,其底物硝基苯邻位必须含有取代基,且取代基的位阻对反应产率有直接影响;对于hemetsberger吲哚合成法,其底物叠氮基丙烯酸酯本身复杂的制备工艺,限制了该方法的应用潜能。
5.2)传统反应中使用化学计量的质子酸或格氏试剂,这也导致后处理时需要额外添加化学计量的碱或酸,因此,该过程不符合当代绿色化学的理念;
6.3)操作过程冗长且存在危险隐患,如当投入大量叠氮化合物参与反应时,若没有严格控制加料速度,体系内会迅速释放大量氮气,有潜在的爆炸风险。
7.因此,发展更具原子、步骤经济性以及选择性的绿色高效合成方法仍是非常值得期待的。近些年来,人们发展了基于过渡金属催化的碳氢键活化反应,来扩宽吲哚合成分子库,这些反应的优势在于较高的原子经济性,以及吲哚分子的快速简捷构建;但是上述过渡金属催化的吲哚合成,往往还存在着以下的挑战:
8.1)底物往往需要预先修饰,且反应后不易离去和转化。例如,2016年,glorius在二价钴催化的条件下,实现了nh-boc苯肼衍生物与内炔合成吲哚的反应(angew.chem.int.ed.2016,55,3208-3211.),但是此类nh-boc苯肼不易合成,且产物当中存在该底物的“足迹”,不易除去。因此这类不易后续转化的官能团,阻碍了该类方法在合成生物活性分子中的持续应用潜能;
9.2)难以调控合成吲哚的区域选择性。例如,2013年,朱进课题组报道了n-亚硝基苯胺与1,2-二取代内炔合成吲哚的反应(j.am.chem.soc.2013,135,16625-16631)。而该类内炔化合物,在金属催化碳氢键活化合成吲哚的类型中,往往面临着难以调控的区域选择性的问题,从而导致当使用不对称内炔时,反应获得区域异构体;
10.3)上述金属催化氧化碳氢键活化合成吲哚的过程中,往往需要向催化体系中额外引入化学计量的非环境友好的氧化剂,比如二价铜盐,一价银盐,这也限制了其在大规模生
产中的应用。
11.专利申请内容
12.为克服上述现有技术存在的至少一个问题,本专利申请提供了一种多取代吲哚化合物的制备方法。本专利申请中的制备方法在分子氧与分子内氧化剂的协助下,通过三价铑催化的n-芳基亚硝酰胺与芳基乙烯的多次脱氢反应,释放小分子的同时,合成多取代吲哚化合物。(间位被官能团取代的底物,存在多个化学环境不同且活性不同的碳氢键,常规难以以良好的区域选择性实现吲哚的合成,此外,对于传统金属催化碳氢键活化中极具挑战的吡啶类底物,其反应活性和位点选择性往往难以获得,而在本技术当中,我们不仅实现了多取代n-芳基亚硝酰胺与芳基乙烯的多次脱氢反应,并且能够实现兼容吡啶底物的氮杂吲哚的合成,其也是抗疟抑制剂和有机发光半导体材料的核心骨架)
13.本专利申请的又一目的在于,提供上述多取代吲哚化合物的应用。
14.为解决上述技术问题,本专利申请采用的技术方案是:
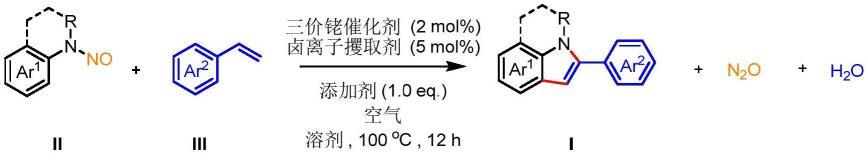
15.一种多取代吲哚化合物的制备方法,其特征在于:在惰性溶剂中,且在三价铑催化剂的作用下,将n-芳基亚硝酰胺化合物(式ii)与芳基乙烯化合物(式iii)进行反应,得到多取代吲哚化合物(式i):
[0016][0017]
其中ar1为对位、间位、邻位等多取代的苯环或杂环类化合物,ar2为对位、间位取代的苯环或稠环,r为官能团取代的苯环或烷基。
[0018]
优选的,所述惰性溶剂为甲苯、四氢呋喃、1,4-二氧六环、n,n
’‑
二甲基甲酰胺、n,n
’‑
二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、乙腈、1,2-二氯乙烷、乙醇、水中的任一种或几种。
[0019]
优选的,所述三价铑催化剂为五甲基环戊二烯基氯化铑二聚体、五甲基环戊二烯氯化铱二聚体、三乙腈-五甲基环戊二烯基氯化铑二聚体中的任一种或几种。
[0020]
优选的,所述反应还需加入卤离子攫取剂,所述卤离子攫取剂为六氟锑酸银、双三氟甲磺酰亚胺银中的任一种或几种。
[0021]
优选的,所述反应还需加入添加剂,所述添加剂为醋酸钠、三氟乙酸钠、特戊酸钠、甘氨酸钠、丙酸钠、2,4,6-三甲基苯甲酸钠中的任一种或几种。
[0022]
优选的,所述n-芳基亚硝酰胺化合物(式ii)与末端烯烃化合物(式iii)的反应摩尔比为1:1.5~1:2。
[0023]
优选的,所述三价铑催化剂的用量是所述n-烷基-n-芳基亚硝酰胺化合物(式ii)用量的2mol%。
[0024]
优选的,所述反应在80~120℃下进行;所述反应进行12~24小时。
[0025]
本专利申请的一些优选实施例中的多取代吲哚化合物的制备方法包括以下具体步骤:
[0026]
s1:在反应器,空气中,依次加入2.5mg五甲基环戊二烯二氯化铑二聚体,3.9mg三氟甲磺酰亚胺银,27.2mg三氟乙酸钠,1.0ml 1,2-二氯乙烷,27.2mg n-甲基-n-苯基亚硝酰
胺,31.2mg苯乙烯;
[0027]
s2:将反应液在100℃下反应12小时;
[0028]
s3:反应结束后用柱层析分离技术分离上述混合物,得到目标化合物。
[0029]
本专利申请还提供了一种太阳能电池,所述太阳能电池为钙钛矿太阳能电池,且所述钙钛矿太阳能电池中的空穴传输材料采用如权利要求1所述制备方法制备的多取代吲哚化合物。
[0030]
本专利申请在惰性溶剂条件下,通过三价铑催化,分子氧协助下,使用简单易得的n-芳基亚硝酰胺与芳基乙烯作为反应底物,实现化学选择性(本技术的实例能以良好的产率得到产物结构单一的目标分子,具有较好的化学选择性)、区域选择性(当本技术的反应底物间位被官能团取代时,具有多种反应活性位点,反应依然能够得到选择性单一产物,证明其区域选择性好,详见实例3、4)地模块化合成在生物、药物及光电材料领域具有良好的应用前景的多取代的吲哚化合物。
[0031]
与现有技术相比,本专利申请的有益效果是:
[0032]
本专利申请提供的多取代吲哚化合物的制备方法具有无痕导向、绿色氧化、多次脱氢的特点,所获得的吲哚产物在太阳能电池中的空穴传输层材料中表现出良好的性能(本技术中的吲哚骨架可获得功率转化效率为17.59%)。
附图说明
[0033]
图1为本专利申请实施例1制备的化合物1a的核磁共振氢谱图;
[0034]
图2为本专利申请实施例1制备的化合物1a的核磁共振碳谱图;
[0035]
图3为本专利申请实施例2制备的化合物1b的核磁共振氢谱图;
[0036]
图4为本专利申请实施例2制备的化合物1b的核磁共振碳谱图;
[0037]
图5为本专利申请实施例3制备的化合物1c的核磁共振氢谱图;
[0038]
图6为本专利申请实施例3制备的化合物1c的核磁共振碳谱图;
[0039]
图7为本专利申请实施例4制备的化合物1d的核磁共振氢谱图;
[0040]
图8为本专利申请实施例4制备的化合物1d的核磁共振氟谱图;
[0041]
图9为本专利申请实施例4制备的化合物1d的核磁共振碳谱图;
[0042]
图10为本专利申请实施例5制备的化合物1e的核磁共振氢谱图;
[0043]
图11为本专利申请实施例5制备的化合物1e的核磁共振碳谱图;
[0044]
图12为本专利申请实施例6制备的化合物1f的核磁共振氢谱图;
[0045]
图13为本专利申请实施例6制备的化合物1f的核磁共振碳谱图;
[0046]
图14为本专利申请实施例7制备的化合物1g的核磁共振氢谱图;
[0047]
图15为本专利申请实施例7制备的化合物1g的核磁共振碳谱图;
[0048]
图16为本专利申请实施例8制备的化合物1h的核磁共振氢谱图;
[0049]
图17为本专利申请实施例8制备的化合物1h的核磁共振碳谱图;
[0050]
图18为本专利申请实施例9制备的化合物1i的核磁共振氢谱图;
[0051]
图19为本专利申请实施例9制备的化合物1i的核磁共振碳谱图;
[0052]
图20为本专利申请实施例9制备的化合物li作为钙钛矿太阳能电池空穴传输材料时,对应的前线轨道分布图。
[0053]
图21为本专利申请实施例9制备的化合物li作为钙钛矿太阳能电池空穴传输材料时,对应的j-v测试曲线图。
具体实施方式
[0054]
下面将结合实施例对本专利申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本专利申请,而不应视为限制本专利申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0055]
需要说明的是:
[0056]
本专利申请中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。
[0057]
本专利申请中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。
[0058]
本专利申请中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。
[0059]
本专利申请中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“12~24”表示本文中已经全部列出了“12~24”之间的全部实数,“12~24”只是这些数值组合的缩略表示。
[0060]
本专利申请所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。
[0061]
本专利申请中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行。优选地,本文中的反应方法是顺序进行的。
[0062]
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本专利申请中。
[0063]
本专利申请提供了一种多取代吲哚化合物的制备方法:在惰性溶剂中,且在三价铑催化剂的作用下,将n-芳基亚硝酰胺化合物(式ii)与芳基乙烯化合物(式iii)进行反应,得到多取代吲哚化合物(式i):
[0064][0065]
其中ar1为对位、间位、邻位等多取代的苯环或杂环类化合物,ar2为对位、间位取代的苯环或稠环,r为(环)烷基或官能团取代的苯环。
[0066]
本专利申请公开了一种首例金属催化无痕(此处的“无痕”是指n-亚硝基作为无痕导向基,导向c-h活化后,自身又转化成目标分子中的一部分)、分子内氧化剂(指n-亚硝基)促进的经多次脱氢策略实现的吲哚合成反应。具体地,在惰性溶剂条件下,空气中的氧气作为共氧化剂,通过三价铑催化的n-芳基亚硝酰胺与芳基乙烯的多次脱氢反应,释放小分子(一氧化二氮、水)的同时,快速构建各种多取代吲哚化合物。这种方法具有绿色氧化、化学选择性、良好的区域选择性等特点。另外,本专利申请的卤离子攫取剂是一价银盐,但其用
量只有5mol%,并不作为化学当量氧化剂参与反应,仅作为催化剂配体交换作用。因此。本专利申请中涉及到的合成反应整体上是绿色环保的。
[0067]
同时该方法仅使用简单易得的芳胺衍生物作为无痕的内氧化性导向基,与大宗化学品末端烯烃实现多次脱氢反应。该转化步骤少、操作简便,所获得的产物易于进一步地后续转化,更为重要的是,我们还将该策略所获得的多取代吲哚产物经偶联反应,构建成钙钛矿太阳能电池空穴传输层材料,其功率转化效率可达17.6%。
[0068]
在一些实施例中,所述惰性溶剂为甲苯、四氢呋喃、1,4-二氧六环、n,n
’‑
二甲基甲酰胺、n,n
’‑
二甲基乙酰胺、n-甲基吡咯烷酮、二甲亚砜、乙腈、1,2-二氯乙烷、乙醇、水中的任一种或几种。
[0069]
在一些实施例中,所述三价铑催化剂为五甲基环戊二烯基氯化铑二聚体、五甲基环戊二烯氯化铱二聚体、三乙腈-五甲基环戊二烯基氯化铑二聚体中的任一种或几种。
[0070]
在一些实施例中,所述反应还需加入卤离子攫取剂,所述卤离子攫取剂为六氟锑酸银、双三氟甲磺酰亚胺银中的任一种或几种。
[0071]
在一些实施例中,所述反应还需加入添加剂,所述添加剂为醋酸钠、三氟乙酸钠、特戊酸钠、甘氨酸钠、丙酸钠、2,4,6-三甲基苯甲酸钠中的任一种或几种。
[0072]
在一些实施例中,所述n-芳基亚硝酰胺化合物(式ii)与末端烯烃化合物(式iii)的反应摩尔比为1:1.5~1:2。
[0073]
在一些实施例中,所述三价铑催化剂的用量是所述n-芳基亚硝酰胺化合物(式ii)用量的2mol%。
[0074]
在一些实施例中,所述反应在80~120℃下进行;所述反应进行12~24小时。
[0075]
接下来,以具体实施例对本专利申请多取代吲哚化合物的制备方法进行详细说明。
[0076]
1、制备例
[0077]
实施例1 1-甲基-2-苯基-1h-吲哚(1a)的制备
[0078][0079]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-甲基-n-苯基亚硝酰胺2a(27.2mg,0.20mmol),苯乙烯3a(31.3mg,0.30mmol),三价铑催化剂[cp*rh(ch3cn)3cl2]2(3.3mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),三氟乙酸钠(27.2mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以46%的产率得到产物1-甲基-2-苯基-1h-吲哚(1a)。
[0080]
实施例1制备的化合为的核磁氢谱、碳谱图如图1和图2所示。从图1可看出1h nmr(400mhz,cdcl3)δ7.63(d,j=8.0hz,1h),7.52-7.50(m,2h),7.46(t,j=7.2hz,2h),7.41-7.37(m,1h),7.36(d,j=8.4hz,1h),7.26-7.22(m,1h),7.15-7.11(m,1h),6.55(s,1h),3.74(s,3h)。分子氢谱波峰能与目标产物一一对应,数量合理。从图2可看出:
13
c nmr
(100mhz,cdcl3)δ141.6,138.3,132.9,129.4,128.5,128.0,127.8,121.6,120.5,119.8,109.6,101.6,31.1。分子碳谱波峰能与目标产物一一对应,数量合理。结合以上核磁氢谱、碳谱图的结果可知,实施例1制得的产物为1-甲基-2-苯基-1h-吲哚(1a)。
[0081]
实施例2 5-氯-1-甲基-2-苯基-1h-吲哚(1b)的制备
[0082][0083]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-(4-氯苯基)-n-甲基亚硝酰胺2b(34.0mg,0.20mmol),苯乙烯3a(31.3mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),六氟锑酸银(3.6mg,0.01mmol),三氟乙酸钠(27.2mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以61%的产率得到产物5-氯-1-甲基-2-苯基-1h-吲哚(1b)
[0084]
实施例2制备的化合物的核磁氢谱图和核磁碳谱图如图3和图4所示。从图3可看出:1h nmr(400mhz,cdcl3)δ7.59(d,j=2.0hz,1h),7.51-7.46(m,4h),7.44-7.42(m,1h),7.28(s,1h),7.19(dd,j=2.0hz,8.8hz,1h),6.50(s,1h),3.73(s,3h)。从图4可看出:
13
c nmr(100mhz,cdcl3)δ142.9,136.7,132.4,129.3,128.9,128.6,128.1,125.5,121.8,119.8,110.6,101.2,31.3。结合以上核磁氢谱、碳谱图的结果可知,实施例2制得的产物为5-氯-1-甲基-2-苯基-1h-吲哚(1b)。
[0085]
该实施例中的化学转化可以快速构建多取代的吲哚类分子,且环上含有易转化的卤素官能团,从而为更复杂的分子的构建提供平台。
[0086]
实施例3 2-(4-(叔丁基)苯基)-5,6-二氢-4h-吡咯并[3,2,1-ij]喹啉(1c)的制备
[0087]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入1-亚硝基-1,2,3,4-四氢喹啉2c(52.0mg,0.20mmol),4-叔丁基苯乙烯3b(32.0mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),六氟锑酸银(3.6mg,0.01mmol),三氟乙酸钠(27.2mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以42%的产率得到产物2-(4-(叔丁基)苯基)-5,6-二氢-4h-吡咯并[3,2,1-ij]喹啉(1c)。
[0088]
实施例3制备的化合物的核磁氢谱、碳谱图如图5和图6所示。从图5可看出:1h nmr(400mhz,cdcl3)δ7.61
–
7.50(m,5h),7.16
–
7.07(m,1h),7.04
–
6.97(m,1h),6.62(s,1h),4.28(t,j=6.0hz,2h),3.08(t,j=6.1hz,2h),2.25(p,j=5.9hz,2h),1.46(s,9h)。从图6可看出:
13
c nmr(100mhz,cdcl3)δ150.6,139.9,135.2,131.6,129.8,128.3,128.2,126.0,
125.5,121.9,119.8,118.4,117.7,100.2,77.3,77.0,76.7,43.7,34.6,31.4,31.3,31.3,25.0,23.1。结合以上核磁氢谱、碳谱图的结果可知,实施例3制得的产物为2-(4-(叔丁基)苯基)-5,6-二氢-4h-吡咯并[3,2,1-ij]喹啉(1c)。
[0089]
该实施例中的化学转化可以应用于稠环类材料、生物活性分子。
[0090]
实施例4 6-氯-5-氟-1-甲基-2-(萘-2-基)-1h-吲哚(1d)的制备
[0091]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-(3-氯-4-氟苯基)-n-甲基亚硝酰胺2d(37.6mg,0.20mmol),4-叔丁基苯乙烯3c(32.0mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),特戊酸钠(28.4mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以42%的产率得到产物6-氯-5-氟-1-甲基-2-(萘-2-基)-1h-吲哚(1d)。
[0092]
实施例4制备的化合物的核磁氢谱、氟谱和碳谱图依次表示如图7、图8和图9所示。从图7可看出:1h nmr(400mhz,cdcl3)δ7.96
–
7.89(m,4h),7.60(dd,j=1.7hz,8.5hz,1h),7.57
–
7.53(m,2h),7.41
–
7.36(m,2h),6.60(s,1h),3.77(s,3h);从图8可看出:
19
f nmr(376mhz,cdcl3)δ-127.0;从图9可看出:
13
c nmr(100mhz,cdcl3)δ153.2(d,j=238.0hz),143.6,135.0,133.2,132.9,129.4,128.6,128.4(d,j=13.0hz),128.0(d,j=37.0hz),126.8,126.7(d,j=4.0hz),115.2(d,j=21.0hz),110.8,110.5(d,j=25.0hz),108.5(d,j=9.0hz),106.3(d,j=23.0hz),102.0(d,j=5.0hz),100.7(d,j=5.0hz),31.6。结合以上核磁氢谱、氟谱和碳谱图的结果可知,实施例4制得的产物为6-氯-5-氟-1-甲基-2-(萘-2-基)-1h-吲哚(1d)。
[0093]
该实施例中的化学转化可以兼容广泛应用于材料、医药领域的氟元素。更为重要的是,该转化对于有多个潜在活性位点的n-亚硝酰胺化合物,具有极好的位点选择性。对于多取代(间、对位含有官能团)的n-亚硝基苯胺底物,其官能团邻位c-h键会受影响,表现出不同活性。上述所称的“活性位点”是指苯环上不同化学环境的c
sp2-h键。多取代n-亚硝基苯胺,虽然含有不同活性的c-h键,但依旧能够定点活化n-no导向基邻位的c-h键,得到单一的目标产物,因此具有极好的位点选择性(区域选择性)。
[0094]
实施例5 2-(4-(叔丁基)苯基)-1-甲基-1h-吡咯并[2,3-b]吡啶(1e)的制备
[0095]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-甲基-n-(吡啶-2-基)亚硝酰胺2e(27.4mg,0.20mmol),4-叔丁基苯乙烯3b(32.0mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),三氟乙酸钠
(27.2mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以31%的产率得到产物2-(4-(叔丁基)苯基)-1-甲基-1h-吡咯并[2,3-b]吡啶(1e)。
[0096]
实施例5制备的化合物的核磁氢谱、碳谱图依次表示如图10和图11所示。从图10可看出:1h nmr(400mhz,cdcl3)δ8.34(dd,j=1.6hz,4.8hz,1h),7.90(dd,j=1.6hz,7.8hz,1h),7.54
–
7.46(m,4h),7.08(dd,j=4.8hz,7.7hz,1h),6.50(s,1h),3.89(s,3h),1.39(s,9h)。从图11可看出:
13
c nmr(100mhz,cdcl3)δ151.4,149.1,142.3,141.9,129.4,128.8,128.0,125.5,120.7,116.0,99.1,34.7,31.3,29.9。结合以上核磁氢谱、碳谱图的结果可知,实施例5制得的产物为2-(4-(叔丁基)苯基)-1-甲基-1h-吡咯并[2,3-b]吡啶(1e)。
[0097]
值得一提的是,对于常规导向策略实现的金属催化惰性键活化反应中,强配位的化合物由于其易与金属络合且难以解离的特性,难以合成具有选择性的目标产物。而在本技术中,强配位杂环如吡啶、喹啉均可以较好地参与该吲哚合成,并实现了常规策略难以简捷合成的氮杂吲哚衍生物。
[0098]
现有技术中,强配位的化合物由于其易与金属络合且难以解离的特性,难以合成具有选择性的目标产物,而该该实施例中的实现是由于反应中释放小分子(n2o,h2o),芳构化作为驱动力,克服了强配位杂环与金属的络合,即克服了常规导向策略协助的金属催化芳环碳氢键活化反应中强配位杂环的局限,这也是首例应用金属催化芳胺衍生物碳氢键活化策略构建氮杂吲哚的方法。并且,该实施例中的化学转化可以广泛应用于氮杂吲哚类的生物医药领域。
[0099]
实施例6 2-(3-氯苯基)-1-甲基-1h-吲哚(1f)的制备
[0100][0101]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-甲基-n-苯基亚硝酰胺2a(27.4mg,0.20mmol),3-氯苯乙烯3d(40.8mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),乙酸钠(16.4mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以61%的产率得到产物2-(3-氯苯基)-1-甲基-1h-吲哚(1f)。
[0102]
实施例6制备的化合物的核磁氢谱、碳谱图依次表示如图12和图13所示。从图12可看出:1h nmr(400mhz,cdcl3)δ7.63(d,j=8.0hz,1h),7.50(s,1h),7.40-7.35(m,1h),7.28-7.24(m,1h),7.14(t,j=7.2hz,2h),7.14-7.10(m,1h),6.57(s,1h),3.74(s,3h).;从图13可看出:
13
c nmr(100mhz,cdcl3)δ139.9,138.5,134.6,134.4,129.7,129.2,127.9,127.8,127.4,122.1,120.6,120.0,109.7,102.3,31.2。结合以上核磁氢谱、碳谱图的结果可知,实施例6制得的产物为2-(3-氯苯基)-1-甲基-1h-吲哚(1f)。
[0103]
该实施例中的化学转化可以快速构建多取代的吲哚类分子,且兼容易转化的卤素官能团,从而为更复杂的分子的构建提供平台。
[0104]
实施例7 5-碘-1-甲基-2-(萘-2-基)-1h-吲哚(1g)的制备
[0105][0106]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-(4-碘苯基)-n-甲基亚硝酰胺2f(52.2mg,0.20mmol),2-乙烯基萘3c(46.2mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),2,4,6-三甲基苯甲酸钠(37.2mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以67%的产率得到产物5-碘-1-甲基-2-(萘-2-基)-1h-吲哚(1g)。
[0107]
实施例7制备的化合物的核磁氢谱、碳谱图依次表示如图14和图15所示。从图14可看出:1h nmr(400mhz,cdcl3)δ7.99
–
7.89(m,5h),7.64
–
7.59(m,2h),7.56
–
7.53(m,1h),7.51(dd,j=1.7hz,8.6hz,1h),7.17(d,j=8.6hz,1h),6.58(s,1h),3.78(s,3h);从图15可看出:
13
c nmr(100mhz,cdcl3)δ142.3,140.6,137.8,137.6,133.2,132.7,131.9,130.0,129.2,128.5,128.2,128.1,127.8,127.0,126.7,126.6,111.6,101.2,77.3,77.0,76.7,31.4。结合以上核磁氢谱、碳谱图的结果可知,实施例7制得的产物为5-碘-1-甲基-2-(萘-2-基)-1h-吲哚(1g)。
[0108]
该实施例中的化学转化可以兼容常规碳氢键活化反应难以兼容的芳基碘,而芳基碘具有良好的化学活性,如可进行钯催化的偶联反应,乌尔曼反应(ullmann)偶联反应等,从而为更复杂的分子的构建提供平台。
[0109]
实施例8 5-甲氧基-1-(4-甲氧基苯基)-2-(萘-2-基)-1h-吲哚(1h)的制备
[0110]
在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n、n-双(4-甲氧基苯基)亚硝酰胺2g(78.3mg,0.20mmol),2-乙烯基萘3c(46.2mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),甘氨酸钠(gly-na,19.4mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以52%的产率得到产物5-甲氧基-1-(4-甲氧基苯基)-2-(萘-2-基)-1h-吲哚(1h)。
[0111]
实施例8制备的化合物的核磁氢谱、碳谱图依次表示如图16和图17所示。从图16可看出:1h nmr(400mhz,cdcl3)δ7.81
–
7.76(m,2h),7.74
–
7.67(m,2h),7.48
–
7.43(m,2h),7.36(dd,j=1.8hz,8.6hz,1h),7.23
–
7.19(m,2h),7.19
–
7.16(m,2h),6.94
–
6.90(m,2h),6.87(dd,j=2.4hz,9.0hz,1h),6.84(s,1h),3.91(s,3h),3.83(s,3h).;从图17可看出:
13
c nmr(100mhz,cdcl3)δ158.5,154.8,141.2,134.9,133.2,132.3,131.5,130.1,129.0,128.5,
128.1,127.7,127.6,126.7,126.2,126.1,114.5,112.5,111.4,103.3,102.0,55.9,55.4。结合以上核磁氢谱、碳谱图的结果可知,实施例8制得的产物为5-甲氧基-1-(4-甲氧基苯基)-2-(萘-2-基)-1h-吲哚(1h)。
[0112]
二芳胺作为有机合成砌块,有机砌块是一类有机的官能团化分子,即有机合成的基本成分。它们可用于分子结构的自下而上模块化组装,例如超分子复合物、金属有机框架、有机分子构建体和纳米颗粒。因此,它们在药物化学、有机化学和材料化学中起到了基础性的作用。该实施例中的化学转化使用合成砌块二芳胺基为原料,因此本反应为苯胺类大宗化学品的高附加值转化提供了一种新策略,该类n-芳基吲哚产物可应用于生物医药、有机光电材料等领域。
[0113]
2、应用例
[0114]
实施例9钙钛矿太阳能电池空穴传输材料分子:5,5
’‑
(4,8-双(己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2,6-二基)双(1-甲基-2-(萘-2-基)-1h-吲哚)(1i)的制备以及材料表征
[0115][0116]
中间体5-溴-1-甲基-2-(萘-2-基)-1h-吲哚(1ii)的制备:在一个大气压空气氛围下,向15ml schlenk反应管中依次加入n-(4-溴苯基)-n-甲基亚硝酰胺2h(43.0mg,0.20mmol),2-乙烯基萘3c(46.2mg,0.30mmol),三价铑催化剂[cp*rhcl2]2(2.5mg,0.004mmol),三氟甲磺酰亚胺银(3.9mg,0.01mmol),乙酸钠(16.4mg,0.2mmol),1,2-二氯乙烷(dce,1.0ml),在温度为100℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与乙酸乙酯的体积比99:1,以63%的产率得到中间体5-溴-1-甲基-2-(萘-2-基)-1h-吲哚(1ii)。
[0117][0118]
目标化合物(1i)的制备:通过本专利申请制备方法所获得的吲哚衍生物,经偶联反应,简捷合成了以二苯并噻吩为π单元的材料分子,具体方法如下:在氮气氛围下,向15ml schlenk反应管中依次加入5-溴-1-甲基-2-(萘-2-基)-1h-吲哚1ii(83.8mg,0.25mmol),4,8-双(己氧基)苯并[1,2-b:4,5-b']二噻吩(39.1mg,0.1mmol),醋酸钯催化剂pd(oac)2(4.5mg,0.02mmol),四氟硼酸二叔丁基甲基膦鎓盐(14.9mg,0.06mmol),碳酸钾(82.9mg,0.8mmol),三氟甲烷磺酸银(102.8mg,0.4mmol),n,n-二甲基乙酰胺(dma,1.0ml),在温度为150℃中反应12小时。粗产物用制备的硅胶板进行层析色谱分离,所选展开剂或洗脱剂为石油醚与二氯甲烷的体积比1.5:1,以56%的产率得到产物5,5
’‑
(4,8-双(己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2,6-二基)双(1-甲基-2-(萘-2-基)-1h-吲哚)(1i)。
[0119]
在对1i分子进行材料表征时,我们发现其表现出了良好的空穴传输材料的性能,具体地,由图20得知,1i的最高占据分子轨道(homo)在整个分子内离域,有利于电荷传输,最低未占据分子轨道(lumo)主要位于核心骨架上,homo轨道和lumo轨道的重叠有利于空穴提取,且由密度泛函理论(简称dft)计算得到1i的e
homo
或e
lumo
值为-5.05/-1.52ev,符合钙钛矿太阳能电池的空穴传输材料的要求,让我们惊喜的是,该类分子在测试中,表现出了良好的性能。接下来,将该吲哚衍生物应用到钙钛矿太阳能电池进行详细说明。
[0120]
将2.5mg化合物1i溶于1ml氯苯溶剂中,以4000rpm的转速旋涂在清洗过的导电玻璃上,然后在100℃下退火10分钟。冷却后,将钙钛矿前驱体溶液依次以1000rpm和5000rpm的转速旋涂在基底上,在100℃下退火30min。冷却至室温后将[6,6]-苯基-c61-丁酸异甲酯(pcbm)的氯苯溶液旋涂在钙钛矿层上,在65℃下退火10min,冷却后再将浴铜灵(bcp)旋涂至pcbm上,在65℃下退火5min。最后在高真空条件下蒸镀金属电极。在1个太阳光下测得j-v曲线,最佳器件性能为:短路电流密度为23.25ma cm-2
,开路电压为0.98v,填充因子为77.42%,功率转换效率为17.6%。通过以上相应的光伏参数可以分析出,1i可以实现界面载流子的转移,与预期一致。
[0121][0122][0123]
综上所述,本专利申请提供的在惰性溶剂条件下,通过三价铑催化,分子氧协助下,使用简单易得的n-烷基-n-芳基亚硝酰胺与芳基乙烯作为反应底物,实现化学选择性、区域选择性地模块化合成在生物、药物及光电材料领域具有良好的应用前景的多取代的吲哚化合物。该申请中的多取代吲哚合成方法不需要预先制备的多官能团化的原料,并且具有内氧化性、无痕导向的特点,且本吲哚合成方法不需要使用化学计量的质子酸或格氏试剂,空气中的氧气作为共氧化剂,具备绿色氧化的特点,另外本专利申请的合成方法还具备多次脱氢、兼容强配位的特点,所获得的吲哚产物在太阳能电池中的空穴传输层中表现出良好的性能(本技术中的吲哚骨架可获得功率转化效率为17.59%)。
[0124]
在本说明书的描述中,参考术语“一个实施方式”、“一些实施方式”、“示意性实施方式”、“示例”、“具体示例”、或“一些示例”等的描述意指结合实施方式或示例描述的具体特征、结构、材料或者特点包含于本专利申请的至少一个实施方式或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施方式或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施方式或示例中以合适的方式结合。
[0125]
尽管已经示出和描述了若干个本专利申请的实施方式,本领域的普通技术人员可以理解:在不脱离本专利申请的原理和宗旨的情况下可以对这些实施方式进行多种变化、修改、替换和变型,本专利申请的范围由权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1