奈玛特韦有关物质及其制备方法和应用与流程
1.本发明属于药物化学技术领域,具体涉及一种奈玛特韦有关物质及其制备方法和应用。
背景技术:
2.美国辉瑞公司(pfize)开发的帕罗韦德(paxlovid)是治疗新冠病毒的特效药,帕罗韦德由奈玛特韦(nirmatrelvir)和利托那韦片(ritonavir)两部分组成,前者抑制一种sars-cov-2蛋白以阻止病毒复制,后者减缓奈玛特韦的分解,以帮助其在体内保持较高浓度的时间。奈玛特韦分子式为c
23h32
f3n5o4,结构式如下所示:
[0003][0004]
研究表明杂质是药品的一项关键质量属性,在整个化学药研发流程中属于重点研究对象。其中降解杂质的存在尤其是疑似基因毒性杂质会极大地影响用药安全,“基因毒性杂质”(例如n-亚硝基取代物)在很低的浓度下即可诱导基因突变并导致染色体的断裂和重排,因此具有潜在的致癌性,近年来广受关注。其中n-亚硝基取代物,例如n-二甲基亚硝胺(分子式c2h6n2o,结构简式(ch3)2nno,分子量74.08,缩写为ndma),该物质属于n-亚硝胺类化合物中毒性最强的一种化学物质,国际癌症研究机构(iarc)将其列为2a级致癌物。考虑到药品中相关杂质对人体的危害,欧盟、美国药品监管机构相继发布了遗传毒性和致癌性杂质的指导原则。在此基础上,ich(人用药物注册技术要求国际协调会)也针对基因毒性杂质制订了m7指导原则。2020年5月8日,我国国家药品监督管理局药品审评中心发布了《化学药物中亚硝胺类杂质研究技术指导原则(试行)》,要求药企应充分评估药品中亚硝胺类杂质的风险,并将亚硝胺类杂质水平控制在安全限度以下。目前,尚无文献专利报道关于奈玛特韦相关亚硝胺物质的研究,同时市面上也缺乏奈玛特韦相关亚硝胺物质的制备方法。因此,通过定向制备目标杂质,建立相应分析方法,对原料药及其相关制剂的疑似基因毒性杂质进行有效控制具有重要的意义。
[0005]
在按既定工艺进行生产和正常贮藏过程中,不可避免地可能含有或产生需要控制的杂质。目前,通过查询文献以及专利数据库可知,对奈玛特韦降解杂质研究很少见报道。考虑到奈玛特韦在新冠病毒治疗中的巨大用途,对奈玛特韦降解杂质的研究在目前显得尤为重要。申请人发现在奈玛特韦降解过程中存在一个全新的化合物,含量大于0.1%,超出了奈玛特韦的杂质限量要求。确认该化合物的化学结构及制备方法,对建立检测方法,提高
和完善奈玛特韦的质量标准以及临床用药安全监测均有着至关重要的作用。
技术实现要素:
[0006]
针对现有技术中的不足,本发明提供一种奈玛特韦有关物质及其制备方法和应用。
[0007]
为实现上述目的,本发明采用如下技术方案:
[0008]
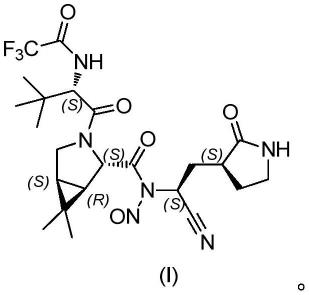
本发明提供一种奈玛特韦有关物质,其结构如式(i)所示:
[0009][0010]
本发明还提供一种上述奈玛特韦有关物质的制备方法,包括如下步骤:
[0011]
将奈玛特韦溶解在酸性溶剂中,加入亚硝酸盐,发生氧化反应,直至奈玛特韦消失;而后过滤、减压除溶剂,得粗品;纯化,得所述奈玛特韦有关物质。
[0012]
优选的,所述酸性溶剂为冰醋酸或浓盐酸。
[0013]
优选的,所述奈玛特韦与酸性溶剂的比例为每100mg奈玛特韦加入10ml酸性溶剂。
[0014]
优选的,所述亚硝酸盐为亚硝酸钠。
[0015]
优选的,所述亚硝酸盐与奈玛特韦的摩尔比为1:1。
[0016]
优选的,所述氧化反应在0℃下进行。
[0017]
优选的,所述纯化的具体步骤为:将粗品用体积比二氯甲烷:甲醇=20:1体系过柱纯化。
[0018]
本发明还提供上述奈玛特韦有关物质在药品质量控制或药品研究中作为对照品的应用。
[0019]
本发明的有益效果在于:
[0020]
(1)本发明提供了一种新的奈玛特韦有关物质,可以作为奈玛特韦杂质定性及定量分析标准品,用于奈玛特韦原料药及其相关制剂的质量研究,为进一步提高奈玛特韦的质量标准提供了重要的物质保障。
[0021]
(2)本发明提供的奈玛特韦有关物质的制备方法具有路线简洁、工艺简单可靠、综合成本低、产率较高和纯度高的优点。
附图说明
[0022]
图1为实施例1中奈玛特韦氧化降解杂质的高效液相检测谱图。
[0023]
图2为实施例1中奈玛特韦氧化降解杂质的质谱检测谱图。
[0024]
图3为实施例2中化合物(i)的高效液相检测谱图。
[0025]
图4为实施例2中化合物(i)的1hnmr检测谱图。
具体实施方式
[0026]
以下结合具体实施例对本发明作进一步的详细说明,以使本领域的技术人员更加清楚地理解本发明。所举实例只用于解释本发明,并非用于限定本发明的范围。在本发明实施例中,若无特殊说明,所有原料组分均为本领域技术人员熟知的市售产品;若未具体指明,所用的技术手段均为本领域技术人员所熟知的常规手段。
[0027]
本发明反应的进程可采用本领域中的常规监测方法(例如tlc、lcms或nmr)进行监测,一般以反应底物消失时为反应终点。
[0028]
下列实施例中,对制备化合物检测鉴定的液相条件为:岛津lcms2020,g1322a脱气机,g1312二元高压泵,g1329a自动进样器,g1316a柱温箱,g4212b二极管阵列检测器。色谱柱为xbridgec18(50mm
×
4.6mm,5.0μm),以去离子水为流动相a,以含0.05%的三氟乙酸的乙腈为流动相b,按下表进行梯度洗脱:
[0029]
时间(min)流动相a(%)流动相b(%)0.019551.509553.005953.5059549555955
[0030]
流速为1.5ml/min,柱温为40℃,检测波长为220nm。
[0031]
实施例1
[0032]
申请人通过氧化强制降解实验(实验条件:醋酸作溶剂,亚硝酸钠作为氧化剂,25℃反应1小时)考察奈玛特韦稳定性,研究团队检测发现如下情况:
[0033]
如图1所示,出峰时间为3.256min的杂质i含量大于0.1%,超出了奈玛特韦的杂质限量要求。
[0034]
如图2的负离子质谱所示,结果显示:该杂质i的分子离子峰为529.40。综合反应机理和质谱结果,推测该化合物结构极大可能为式(i)所示化合物。
[0035]
实施例2
[0036]
本实施例提供一种式(i)所示奈玛特韦有关物质,其合成路线如下反应式所示:
[0037][0038]
本实施例化合物(i)的具体合成方法,包括如下步骤:
[0039]
s1,制备化合物(i)粗品:
[0040]
将化合物ii(100mg,200.19μmml)溶于冰醋酸(10ml)中,在0℃下,分批次加入亚硝
mix)的组成:s9 3.0ml,mgcl2-kcl盐溶液2.0ml,磷酸盐缓冲液25ml,1mol/l g-6-p 0.5ml,0.1mol/l nadp 3ml和无菌蒸馏水25ml,s9混合液在临用前配制)加入试管内。振荡混悬管中成份后,铺至底层培养基平皿表面。待顶层琼脂凝固后,将平皿倒置放入培养箱中,37℃培养约48小时。显微镜下确认细菌背景菌苔生长良好,与溶媒对照相比无明显稀疏的条件下进行回变菌落计数。
[0055]
表1化合物i ames试验结果
[0056][0057]
注:(1)a为三个平皿的平均值;
[0058]
(2)*与溶媒对照相比p《0.05。
[0059]
由表1结果可知,化合物(i)在500和1000μg/皿剂量下,无论有无s9活化系统,均观察到测试菌株ta97、ta98回变菌落数明显增加,表明本试验条件下化合物(i)对鼠沙门氏菌有致突变性。以上结果表明,化合物(i)的存在对人体有潜在毒副作用,需要控制该杂质。
[0060]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1