结核分枝杆菌融合蛋白BfrB-GrpE及制备方法和应用
本发明属于生物医药工程,尤其是应用基因工程的方法进行新型结核亚单位疫苗的构建。
背景技术:
1、结核病是由结核分枝杆菌(mycobacteriumtuberculosis,m.tuberculosis)感染引起,是感染单一病原菌导致死亡人数最多的传染疾病之一。目前,卡介苗(bacillecalmette-guérin,bcg)是唯一用于临床预防结核病疫苗,但其对成人结核病的保护效果不佳。大量研究表明结核亚单位疫苗可提供长期的免疫保护效果且安全性好,因而具有较好的应用开发前景。结核分枝杆菌感染机体后,在宿主体内存在不同的代谢状态,如复苏期(resuscitation)、复制期(replication)和休眠期(dormancy)多个阶段,且不同代谢状态在一定条件下可以相互转换。因此,新型结核亚单位疫苗应该包含有不同代谢阶段的免疫优势抗原,构成多阶段疫苗,可有效提高抗结核保护效果。
2、结核亚单位疫苗是结核分枝杆菌中的一些具有免疫活性成分物质(如蛋白质、多肽、糖脂等),相比于活疫苗其成分明确、成本低、产量高、安全性好、制备较容易、质量控制好以及通过接种疫苗可以增强t细胞的免疫记忆。与全细胞疫苗相比,亚单位疫苗靶向少数选定抗原,通常为六种甚至更少。到目前为止,只有少数被鉴定为有希望的结核病亚单位疫苗候选抗原。在各种动物模型中,主要根据抗原性、免疫原性和抗感染保护性来选择合适的抗原。由于结核病的发病机制复杂,上述方法可能具有局限性。因此,开发蛋白亚单位疫苗主要的挑战是确定此类疫苗中包含抗原的种类及数量。一些研究人员根据结核分枝杆菌感染机体的代谢状态,筛选不同生长阶段的免疫优势抗原纳入候选疫苗。此外,与卡介苗相比,结核病亚单位疫苗面临着一些不可避免的挑战,包括免疫原性差、免疫记忆持续时间较短,因此需要与佐剂联合使用才能产生较好的免疫保护效果。
3、将结核分枝杆菌休眠期抗原hspx和rv2626与复制期免疫优势抗原esat-6、mtb8.4、mtb10.4、ag85b融合,构建的mh(mtb10.4-hspx)、lt69(esat-6-ag85b-mpt64190-198-mtb8.4-hspx)和lt70(esat-6-ag85b-mpt64190–198-mtb8.4-rv2626c)等多阶段疫苗显示出比单一时期抗原构建疫苗具有更好的抗结核分枝杆菌毒株h37rv感染保护效果。发明人通过大量文献查阅及计算机对抗原表位的预测筛选出免疫优势抗原—bfrb和grpe。结核分枝杆菌bfrb(rv3841)是铁储存蛋白,具有较强的免疫原性,在小鼠体内可以诱导同结核分枝杆菌经典抗原ag85b相当的免疫应答;grpe(rv3051)是hsp70复合蛋白的组分之一,具有较强的免疫原性,在小鼠体内诱导的免疫记忆反应与esat6相当,单个抗原对抗结核分枝杆菌毒株的能力与结核传统疫苗bcg相当。因此,将bfrb和grpe抗原联合构建无标签融合蛋白bfrb-grpe(简称bg),旨在开发更有效的多阶段亚单位疫苗。
技术实现思路
1、本发明提供了一种融合了结核分枝杆菌复制和休眠期免疫优势抗原bfrb和休眠期免疫优势抗原grpe的新型融合蛋白bg,并提出了该融合蛋白的构建表达纯化方法。
2、本发明所提供的新型融合蛋白bg和佐剂进行联合构建结核亚单位疫苗,该疫苗诱导了偏向th1型细胞免疫反应,后期有望成为更为有效的结核病新型候选疫苗。
3、本发明采用以下技术方案:结核分枝杆菌融合蛋白bfrb-grpe,由结核分枝杆菌复制和休眠期免疫优势抗原bfrb和休眠期免疫优势抗原grpe联合构建而成,氨基酸序列为:
4、mteyegpktkfhalmqeqihneftaaqqyvaiavyfdsedlpqlakhfysqaveernhammlvqhlldrdlrveipgvdtvrnqfdrprealalaldqertvtdqvgrltavardegdflgeqfmqwflqeqieevalmatlvrvadraganlfelenfvarevdvapaasgaphaaggrlggggsggggsggggsvtdgnqkpdgnsgeqvtvtdkrridpetgevrhvppgdmpggtaaadaahtedkvaeltadlqrvqadfanyrkralrdqqaaadrakasvvsqllgvlddlerarkhgdlesgplksvadkldsaltglglvafgaegedfdpvlheavqhegdggqgskpvigtvmrqgyqlgeqvlrhalvgvvdtvvvdaaelesvddgtavadtaendqadqgnsadtsgeqaesepsgs。
5、结核分枝杆菌融合蛋白bfrb-grpe的制备方法,包括以下步骤:一、融合蛋白bg的构建,二、融合蛋白bg小批量表达,三、融合蛋白bg发酵表达,四、融合蛋白bg的工业化发酵,五、融合蛋白bg的纯化。
6、可选地,所述步骤一具体为:设计bfrb-grpe融合基因,两个基因之间加linker,翻译成氨基酸序列为:
7、mteyegpktkfhalmqeqihneftaaqqyvaiavyfdsedlpqlakhfysqaveernhammlvqhlldrdlrveipgvdtvrnqfdrprealalaldqertvtdqvgrltavardegdflgeqfmqwflqeqieevalmatlvrvadraganlfelenfvarevdvapaasgaphaaggrlggggsggggsggggsvtdgnqkpdgnsgeqvtvtdkrridpetgevrhvppgdmpggtaaadaahtedkvaeltadlqrvqadfanyrkralrdqqaaadrakasvvsqllgvlddlerarkhgdlesgplksvadkldsaltglglvafgaegedfdpvlheavqhegdggqgskpvigtvmrqgyqlgeqvlrhalvgvvdtvvvdaaelesvddgtavadtaendqadqgnsadtsgeqaesepsgs*
8、下划线为linker
9、将pet30a(+)-bfrb-grpe基因优化并合成,得到pet30a(+)-bfrb-grpe载体。
10、可选地,所述步骤二具体为:将构建成功的pet30a(+)-bfrb-grpe载体转化入大肠杆菌e.colibl21(de3)-plyss感受态细胞中用于后期目的蛋白表达;将表达菌株活化后接种37℃震荡培养过夜,取2ml活化后菌体加入200mllb培养基中37℃震荡培养6h;加入蛋白诱导剂iptg至终浓度为0.5mmol/l,37℃诱导振荡培养6h;4℃,8000rpm,离心20min收获湿菌;菌体重悬于pb缓冲液10ml/g湿菌,冰浴下超声破碎细菌3遍;4℃,8000rpm,离心20min后分别收集上清和沉淀,将上清和沉淀分别进行丙烯酰胺凝胶电泳。
11、可选地,所述步骤三具体为:
12、bg在e.colibl21(de3)-plyss菌株中发酵表达,通过三区划线培养后获得单个菌落,挑取单个菌落接种于含有氯霉素和卡那抗生素的lb液体培养基中37℃、180rpm培养12-16h,作为一级种子;将一级种子按1:1000的接种比进行转接,37℃、180rpm振荡培养12-16h,作为二级种子;将70ml的二级种子菌液接种到含有2l培养基的发酵罐中,再分别加入2ml的卡那霉素溶液和氯霉素溶液,调节ph至6.8-7.4之间,增菌阶段设置溶氧为20%左右,关联转速;第6h开始,根据溶氧进行补料;第7h加入1ml iptg诱导剂至终浓度为1.0mmol/l,培养5h后停止发酵;经过12h的发酵,获得的菌体依次经洗涤、重悬、高压匀浆裂解和离心处理;取bg全菌、bg上清液和bg沉淀重悬液,进行15%sds-page凝胶电泳分析。
13、可选地,所述步骤四具体为:
14、结核分枝杆菌融合蛋白bfrb-grpe用30l的发酵罐来发酵表达目的蛋白,发酵培养参数如表1,
15、表1 bg-20200909发酵培养参数
16、
17、可选地,所述步骤五具体为:
18、将发酵培养的大肠杆菌按10%的比例重悬在20mm pb(ph=7.4)缓冲液中,高压匀浆裂解,12000rpm 20min离心后收集含有目的蛋白的上清;首先,该上清用体积分数35%的饱和硫酸铵溶液进行盐析,盐析出的蛋白用pb缓冲液进行重悬;然后,离心收取上清进行疏水层析,选用5ml的butyl sepharose high performance进行纯化,最终确定上样缓冲体系为20mm pb(ph=8.0)+2m nacl;上样后设置100-0%b泵【20mm pb(ph=8.0)+2m nacl】,40min进行线性洗脱;uv值大于40收集,小于100停止;最终纯化物进行sds-page电泳分析,电泳胶图通过image lab软件灰度扫描来分析蛋白纯度,设置检测灵敏度50%,融合蛋白bg的纯度大于95%。
19、结核分枝杆菌融合蛋白bfrb-grpe亚单位疫苗的制备方法,包括以下步骤:用pbs配制1mg/ml polyi:c;用pbs配制阳离子脂质体二甲基三十六烷基铵和胆固醇混合液,此混合液中dda浓度为5mg/ml,胆固醇浓度为0.5mg/ml,80℃水浴10min助溶,冷却至室温备用;将bg融合蛋白用pbs缓冲液稀释至所需浓度;将蛋白和poly i:c溶液以体积比1:1充分混匀,室温放置1min;再将二者混合液等体积的dda溶液逐滴加入,乳化,使疫苗呈均一的乳油状,即得到亚单位疫苗。
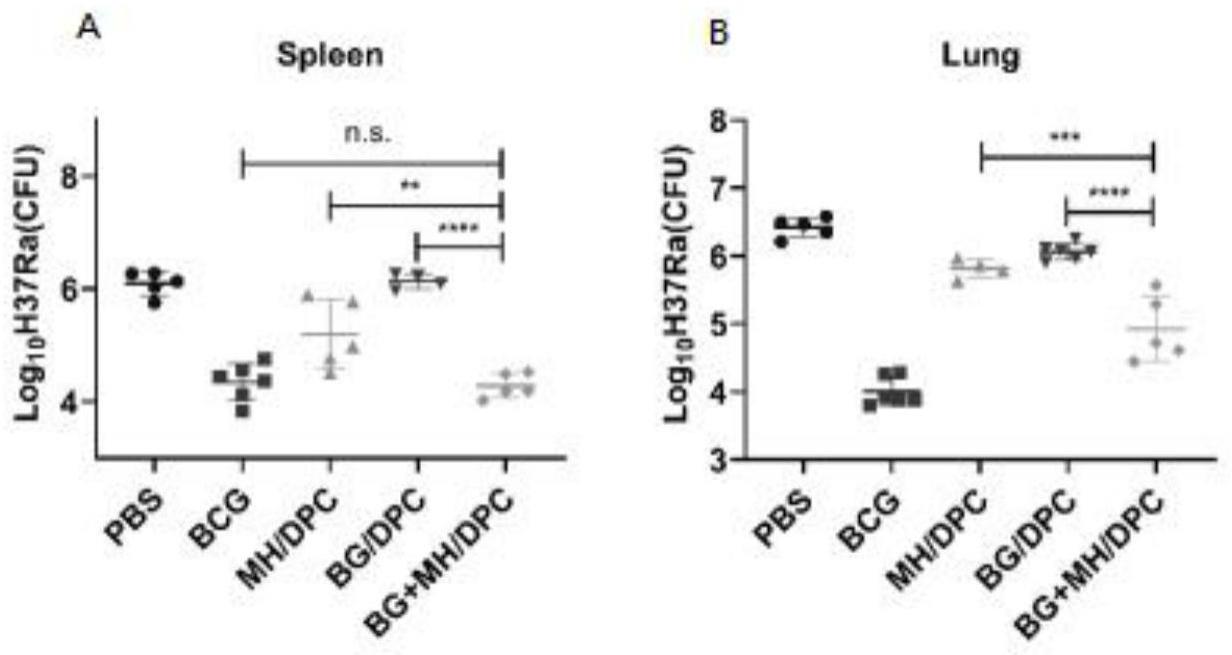
20、本发明的有益效果在于:本发明利用基因工程技术,成功构建、表达和纯化了不带有任何标签的结核分枝杆菌融合蛋白bg,解决了融合蛋白所带有的标签可能会影响到动物实验以及后期临床试验的后续问题,并且通过盐析与疏水层析相结合的方法使该无标签融合蛋白得到了有效的纯化。而且其具有表达产量高,表达稳定,对温度及盐离子浓度不敏感且在上清表达等优点,能进行工业发酵;本发明中的新型融合蛋白bg和佐剂联合构建结核亚单位疫苗,该疫苗诱导了偏向th1型细胞免疫反应。该疫苗早期融合蛋白mh免疫小鼠,提供抗结核分枝杆菌的保护效果优于单一融合疫苗组。该疫苗在小鼠免疫过程中未见明显毒副作用;本发明有望成为临床结核病预防和治疗的候选疫苗。
- 还没有人留言评论。精彩留言会获得点赞!