一种吖啶衍生物及其合成方法
1.本发明属于有机合成领域,具体涉及一种吖啶衍生物及其合成方法。
背景技术:
2.吖啶衍生物是一类具有特殊催化功能的分子,其不仅可以用作金属催化,而且能够作为光催化,在生物催化方面也拥有十分重要的地位。将吖啶衍生物引入催化剂体系,会显著增强其在催化领域中的应用前景。传统合成吖啶衍生物的结构主要依赖于团簇的pd固定在聚苯乙烯上作为催化剂,然而该方法需使用高昂的催化剂,合成步骤过于繁琐。[ryo n.,stephane w.,sh
ū
kobayashi,.j.comb.chem.2006,8,459-461]。此外一些合成吖啶衍生物需要用到氢气等危险气体来进行还原,使得反应环境具有一定的未知性。[fiorio,jhonatanl,.rossi,liane m,.catal.sci.technol.2020,2021,11,312-318]。甚至一些合成吖啶衍生物需要用到叠氮化钠是具有剧毒、爆炸性、在空气中易生成活泼金属钠,具有一定的危险性。[wang,ming.,fan,qiaoling,.jiang,xuefeng,.org.lett.2018,20,1216
–
219.]。因此,现有的吖啶衍生物的制备工艺复杂,试剂不环保,且存在安全隐患的问题。
技术实现要素:
[0003]
针对现有技术中存在的问题,本发明提供一种吖啶衍生物及其合成方法,开发了一种用简单的lewis acid和碱即可合成相应的吖啶衍生物的方法,制备的吖啶衍生物高效且经济,所使用的试剂绿色环保,符合绿色化学的研究理念,还降低了作业人员的存在安全隐患问题。
[0004]
本发明是通过以下技术方案来实现:
[0005]
一种吖啶衍生物的合成方法,包括以下步骤:
[0006]
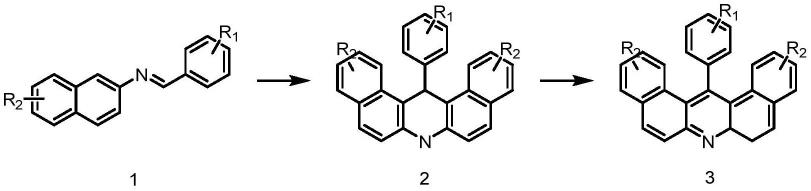
步骤1,在有机溶剂中加入亚胺类化合物和lewis acid,在惰性气体的环境下加热反应后,经分离纯化得到2h-吖啶衍生物;
[0007]
步骤2,将所述的2h-吖啶类化合物和脱氢剂在惰性气体的环境下加热反应后,经分离纯化得到吖啶衍生物。
[0008]
优选的,所述吖啶衍生物的反应式为:
[0009][0010]
其中,r1为氢、烷基、烷氧基、卤素、硝基、三氟甲基、杂环或苯基;r2为氢、烷基、苯基、硫杂环或卤素,所述r1取代苯基中的取代基为烷基、烷氧基或卤素。
[0011]
优选的,所述亚胺类衍生物、lewis acid、2h-吖啶衍生物与脱氢剂的物质量之比为1:1~5:1:1~3。
[0012]
优选的,所述亚胺类化合物与2h-吖啶衍生物在溶剂中的浓度为0.1-0.5摩尔/升。
[0013]
优选的,所述溶剂采用二氯甲烷、乙醇、六氟异丙醇、甲苯或1,4-二氧六环中的一种或多种。
[0014]
优选的,所述lewis acid采用氯化铝、三氟化硼、五氯化铌或五氟化锑中的任意一种。
[0015]
优选的,所述脱氢剂采用氧化铬或氧化铁中的任意一种。
[0016]
优选的,所述步骤1中的反应温度为60℃-140℃,搅拌时间为4h-24h,所述惰性气体采用氩气;
[0017]
一种吖啶衍生物,由上述的吖啶衍生物的合成方法制得。
[0018]
优选的,所述吖啶衍生物的结构式为:
[0019][0020]
其中,r1为氢、烷基、烷氧基、卤素、硝基、三氟甲基、杂环或苯基;r2为氢、烷基、苯基、硫杂环或卤素,所述苯基中的取代基为烷基、烷氧基或卤素。
[0021]
与现有技术相比,本发明具有以下有益的技术效果:
[0022]
本发明开创性的使用简便易得的亚胺类化合物为原料,在lewis acid催化下发生环化反应,进一步与脱氢剂作用生成吖啶衍生物。相比于传统合成吖啶骨架的方法,该方法操作简单,催化剂廉价易得,无需多种添加剂,且目标化合物的收率较高。除此之外,本发明的方法底物的普适性较好,且原料来源广泛,在优化的反应条件下,目标产物易于分离,在材料及医药领域具有潜在的应用价值。
[0023]
进一步,本发明制备的吖啶衍生物高效且经济,所使用的试剂绿色环保,符合绿色化学的研究理念,还降低了作业人员的存在安全隐患问题。
附图说明
[0024]
图1为实施例1所制备的反应物的1h nmr谱图;
[0025]
图2为实施例1所制备的反应物的
13
c nmr谱图;
[0026]
图3为实施例1所制备的产物的1h nmr谱图;
[0027]
图4为实施例1所制备的产物的
13
c nmr谱图;
[0028]
图5为实施例2所制备的反应物的1h nmr谱图;
[0029]
图6为实施例2所制备的反应物的
13
c nmr谱图;
[0030]
图7为实施例2所制备的产物的1h nmr谱图;
[0031]
图8为实施例2所制备的产物的
13
c nmr谱图;
[0032]
图9为实施例3所制备的反应物的1h nmr谱图;
[0033]
图10为实施例3所制备的反应物的
13
c nmr谱图;
[0034]
图11为实施例3所制备的产物的1h nmr谱图;
[0035]
图12为实施例3所制备的产物的
13
c nmr谱图;
[0036]
图13为实施例4所制备的反应物的1h nmr谱图;
[0037]
图14为实施例4所制备的反应物的
13
c nmr谱图;
[0038]
图15为实施例4所制备的产物的1h nmr谱图;
[0039]
图16为实施例4所制备的产物的
13
c nmr谱图;
[0040]
图17为实施例5所制备的反应物的1h nmr谱图;
[0041]
图18为实施例5所制备的反应物的
13
c nmr谱图;
[0042]
图19为实施例5所制备的产物的1h nmr谱图;
[0043]
图20为实施例5所制备的产物的
13
c nmr谱图;
[0044]
图21为实施例6所制备的反应物的1h nmr谱图;
[0045]
图22为实施例6所制备的反应物的
13
c nmr谱图;
[0046]
图23为实施例6所制备的产物的1h nmr谱图;
[0047]
图24为实施例6所制备的产物的
13
c nmr谱图;
[0048]
图25为实施例7所制备的反应物的1h nmr谱图;
[0049]
图26为实施例7所制备的反应物的
13
c nmr谱图;
[0050]
图27为实施例7所制备的产物的1h nmr谱图;
[0051]
图28为实施例7所制备的产物的
13
c nmr谱图;
[0052]
图29为实施例8所制备的反应物的1h nmr谱图;
[0053]
图30为实施例8所制备的反应物的
13
c nmr谱图;
[0054]
图31为实施例8所制备的产物的1h nmr谱图;
[0055]
图32为实施例8所制备的产物的
13
c nmr谱图;
[0056]
图33为实施例9所制备的反应物的1h nmr谱图;
[0057]
图34为实施例9所制备的反应物的
13
c nmr谱图;
[0058]
图35为实施例9所制备的产物的1h nmr谱图;
[0059]
图36为实施例9所制备的产物的
13
c nmr谱图;
[0060]
图37为实施例10所制备的反应物的1h nmr谱图;
[0061]
图38为实施例10所制备的反应物的
13
c nmr谱图。
具体实施方式
[0062]
下面结合具体的实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。
[0063]
本发明以亚胺类化合物为反应原料,以lewis acid作为催化剂,ddq作为脱氢剂,在有机溶剂中加热反应后经分离纯化得到吖啶衍生物。
[0064]
实施例1
[0065]
14-phenyl-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备将0.3mmol的(e)-n-(萘-2-基)-1-苯基甲亚胺、0.3mmol lewis acid(氯化铝)的溶于装有3ml乙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌8h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到107mg固体化合物,产率为87%,所得产品结构式如下:
[0066][0067]
如图1和图2所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.50(d,j=8.5hz,2h),7.85(d,j=8.1hz,2h),7.75(d,j=8.7hz,2h),7.65(t,j=7.8hz,2h),7.59(d,j=7.8hz,2h),7.42(t,j=7.6hz,2h),7.20(t,j=7.7hz,2h),7.12(d,j=8.7hz,2h),7.06(t,j=7.5hz,1h),6.80(s,1h),6.46(s,1h).
13
c nmr(100mhz,cdcl3):δ146.1,136.0,132.2,130.3,128.8,128.4,128.3,127.9,126.9,126.2,123.0,122.2,116.8,114.6,39.1.
[0068]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0069]
14-phenyldibenzo[a,j]acridine的制备
[0070]
将0.3mmol的14-苯基-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.3mmol ddq(二氯二氰基苯醌)的溶于装有2ml乙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌8h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到62.6mg固体化合物,产率为87%,所得产品结构式如下:
[0071][0072]
如图3和图4所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.11(d,j=9.3hz,2h),8.02(d,j=8.8hz,2h),7.90(d,j=7.8hz,2h),7.78
–
7.68(m,3h),7.55
–
7.46(m,4h),7.24(d,j=8.7hz,2h),7.11(t,j=7.9hz,2h).
13
c nmr(100mhz,cdcl3):δ148.4,143.3,133.5,132.5,130.8,130.6,130.0,128.9,128.8,128.7,128.3,126.4,125.3,122.5.
[0073]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0074]
实施例2
[0075]
14-(p-tolyl)-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0076]
将0.3mmol的(e)-n-(萘-2-基)-1-(对甲苯基)甲亚胺、0.6mmol lewis acid(三氟化硼)的溶于装有0.9ml二氯甲烷的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于90℃下加热搅拌7h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到73.8mg固体化合物,产率为66%,所得产品结构式如下:
[0077][0078]
如图5和图6所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.47(d,j=8.5hz,2h),
7.84(d,j=8.1hz,2h),7.75(d,j=8.6hz,3h),7.63(t,j=7.8hz,3h),7.45(d,j=7.8hz,2h),7.40(t,j=7.6hz,2h),6.99(d,j=7.7hz,3h),6.75(s,1h),6.51(s,1h),2.19(s,3h).
13
c nmr(100mhz,cdcl3):δ143.2,135.9,135.6,132.1,130.3,129.0,128.8,128.2,127.6,126.8,123.0,122.1,116.7,114.8,38.6,20.9.
[0079]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0080]
14-(p-tolyl)dibenzo[a,j]acridine的制备
[0081]
将0.3mmol的14-(对甲苯基)-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.4mmol氯化铬的溶于装有0.6ml二氯甲烷的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于90℃下加热搅拌7h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到46.9mg固体化合物,产率为66%,所得产品结构式如下:
[0082][0083]
如图7和图8所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.16(d,j=9.1hz,2h),8.01(d,j=9.2hz,2h),7.87(d,j=7.8hz,2h),7.54
–
7.45(m,4h),7.36(d,j=8.6hz,2h),7.30(d,j=8.6hz,2h),7.11(t,j=8.7hz,2h),2.66(s,3h).
13
c nmr(100mhz,cdcl3):δ147.9,147.4,140.0,138.9,133.4,133.0,131.6,130.6,129.6,128.9,128.8,127.1,126.5,125.4,122.9,21.6.
[0084]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0085]
实施例3
[0086]
14-(4-methoxyphenyl)-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0087]
将0.3mmol的(e)-1-(4-甲氧基苯基)-n-(萘-2-基)甲亚胺、0.45mmol lewis acid(五氯化铌)的溶于装有2.5ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于110℃下加热搅拌4h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到77mg固体化合物,产率为66%,所得产品结构式如下:
[0088][0089]
如图9和图10所示,产品核磁表征:1h nmr(400mhz,dmso):δ9.56(s,1h),8.56(d,j=8.5hz,2h),7.85
–
7.71(m,4h),7.57
–
7.46(m,4h),7.38(d,j=8.7hz,2h),7.29(t,j=7.5hz,2h),6.71
–
6.59(m,3h),3.52(s,3h).
13
c nmr(100mhz,dmso):δ157.7,140.3,136.7,132.2,129.9,128.9,128.3,127.0,122.9,122.8,117.7,114.3,113.9,55.2,37.9.
[0090]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0091]
14-(4-methoxyphenyl)dibenzo[a,j]acridine的制备
[0092]
将0.3mmol 14-(4-甲氧基苯基)-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶的、0.45mmol氧化铁的溶于装有0.6ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于110℃下加热搅拌4h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到51.3mg固体化合物,产率为66%,所得产品结构式如下:
[0093][0094]
如图11和图12所示,产品核磁表征:1h nmr(400mhz,10%cf3cood in cdcl3):δ8.07(d,j=8.9hz,2h),7.99(d,j=9.2hz,2h),7.89(d,j=7.7hz,2h),7.54
–
7.45(m,2h),7.44
–
7.33(m,4h),7.29
–
7.21(m,2h),7.21
–
7.10(m,2h),4.06(s,3h).
13
c nmr(100mhz,10%cf3cood in cdcl3):δ160.3,148.4,146.3,135.3,133.5,132.5,131.0,130.8,128.9,128.8,128.2,126.4,125.4,122.9,116.4,55.6.
[0095]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0096]
实施例4
[0097]
14-(4-chlorophenyl)-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0098]
将0.3mmol的(e)-1-(4-氯苯基)-n-(萘-2-基)甲亚胺、1.5mmol lewis acid(五氟化锑)的溶于装有1.5ml甲苯的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于60℃下加热搅拌24h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到74.3mg固体化合物,产率为63%,所得产品结构式如下:
[0099][0100]
如图13和图14所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.37(d,j=8.4hz,2h),7.82(d,j=8.0hz,2h),7.75(d,j=8.7hz,2h),7.60(t,j=8.6hz,2h),7.44(d,j=7.4hz,2h),7.39(t,j=7.5hz,2h),7.17(d,j=8.6hz,2h),7.10(d,j=8.8hz,2h),6.72(s,1h),6.55(s,1h).
13
c nmr(100mhz,cdcl3):δ144.5,135.9,131.9,131.7,130.2,129.1,128.9,128.6,128.4,127.0,123.1,121.8,116.7,114.1,38.4.
[0101]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0102]
14-(4-chlorophenyl)dibenzo[a,j]acridine的制备
[0103]
将0.3mmol的14-(4-氯苯基)-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.9mmol ddq(二氯二氰基苯醌)的溶于装有0.67ml甲苯的耐压管内(配有磁力搅拌子),用气球充氩
气至少3次,直至空气全部排空,封闭耐压管,于60℃下加热搅拌24h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到49.5mg固体化合物,产率为63%,所得产品结构式如下:
[0104][0105]
如图15和图16所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.13
–
7.88(m,6h),7.76
–
7.68(m,2h),7.58
–
7.46(m,4h),7.30
–
7.14(m,4h).
13
cnmr(100mhz,10%cf3cood in cdcl3):δ147.5,145.9,141.3,135.2,133.4,133.3,131.5,131.1,130.0,128.9,128.6,126.8,126.5,125.5,122.5.
[0106]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0107]
实施例5
[0108]
14-(4-nitrophenyl)-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0109]
将0.3mmol的(e)-n-(萘-2-基)-1-(4-硝基苯基)甲亚胺、0.5mmol lewis acid(氯化铝)的溶于装有3.0ml 1,4-二氧六环的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于140℃下加热搅拌4h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到76.4mg固体化合物,产率为63%,所得产品结构式如下:
[0110][0111]
如图17和图18所示,产品核磁表征:1h nmr(400mhz,dmso):δ9.71(s,1h),8.61(d,j=8.6hz,2h),8.03(d,j=8.5hz,2h),7.91(d,j=8.4hz,2h),7.87
–
7.78(m,4h),7.57(t,j=7.9hz,2h),7.41(d,j=8.8hz,2h),7.34(t,j=7.6hz,2h),6.94(s,1h).
13
c nmr(100mhz,dmso):δ154.9,146.1,136.9,132.0,129.9,129.0,128.9,127.3,124.0,123.2,122.5,117.7,112.7,38.7。
[0112]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0113]
14-(4-nitrophenyl)dibenzo[a,j]acridine的制备将0.3mmol的14-(4-硝基苯基)-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.3mmol ddq(二氯二氰基苯醌)的溶于装有1.5ml1,4-二氧六环的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于140℃下加热搅拌4h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到50.9mg固体化合物,产率为63%,所得产品结构式如下:
[0114][0115]
如图19和图20所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.45(d,j=8.0hz,2h),7.96(d,j=9.6hz,2h),7.90(d,j=9.1hz,2h),7.80(d,j=7.8hz,2h),7.64(d,j=8.2hz,2h),7.40(t,j=7.4hz,2h),7.03
–
6.93(m,4h).
13
cnmr(100mhz,cdcl3):δ148.4,133.7,132.8,131.7,129.7,129.1,128.6,128.2,127.0,125.9,125.5,121.6。
[0116]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0117]
实施例6
[0118]
14-(3,4-dimethylphenyl)-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0119]
将0.3mmol的(e)-1-(3,4-二甲基苯基)-n-(萘-2-基)甲亚胺、0.5mmol lewis acid(氯化铝)的溶于装有1.5ml乙醇与1.5ml二氯甲烷的耐压管内(配有磁力搅拌子),用气球充氩气至少3,直至空气全部排空,封闭耐压管,于100℃下加热搅拌15h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到73mg固体化合物,产率为62%,所得产品结构式如下:
[0120][0121]
如图21和图22所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.56
–
8.44(m,2h),7.84(t,j=7.7hz,2h),7.77(t,j=7.6hz,2h),7.70
–
7.57(m,2h),7.46
–
7.36(m,2h),7.36
–
7.26(m,2h),7.25
–
7.13(m,2h),7.01
–
6.90(m,1h),6.73(s,1h),6.51(s,1h),2.21
–
2.06(m,6h).
13
c nmr(100mhz,cdcl3):δ143.6,136.3,135.9,134.3,132.2,130.3,129.4,129.1,128.7,128.1,126.8,125.2,122.9,122.2,116.7,115.0,38.7,19.9,19.1.
[0122]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0123]
14-(3,4-dimethylphenyl)dibenzo[a,j]acridine的制备
[0124]
将0.3mmol的14-(3,4-二甲基苯基)-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.6mmol ddq(二氯二氰基苯醌)的溶于装有1.5ml乙醇与1.5ml二氯甲烷的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌15h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到48.7mg固体化合物,产率为62%,所得产品结构式如下:
[0125][0126]
如图23和图24所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.09(d,j=9.0hz,2h),7.99(d,j=9.0hz,2h),7.87(d,j=7.8hz,2h),7.48(t,j=7.0hz,3h),7.38(d,j=8.7hz,2h),7.29
–
7.20(m,2h),7.12(t,j=7.5hz,2h),2.59(s,3h),2.39(s,3h).
13
c nmr(100mhz,cdcl3):δ148.5,146.9,140.5,139.3,137.2,133.5,132.4,132.0,130.9,130.8,129.1,128.6,128.4,127.1,126.3,125.2,122.7,19.8,19.8.
[0127]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0128]
实施例7
[0129]
14-(3,4-dimethoxyphenyl)-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0130]
将0.3mmol的(e)-1-(3,4-二甲氧基苯基)-n-(萘-2-基)甲亚胺、0.6mmol lewis acid(氯化铝)的溶于装有1.2ml乙醇与1.2ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌10h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到109.6mg固体化合物,产率为87%,所得产品结构式如下:
[0131][0132]
如图25和图26所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.48(d,j=8.6hz,2h),7.84(d,j=8.1hz,2h),7.72(d,j=8.7hz,2h),7.62(t,j=7.8hz,2h),7.40(t,j=7.5hz,2h),7.13(d,j=8.7hz,2h),7.10
–
6.99(m,2h),6.75(s,1h),6.66(d,j=8.1hz,1h),6.59(s,1h),3.72(s,3h),3.70(s,3h).
13
c nmr(100mhz,cdcl3):δ149.0,147.4,138.8,136.1,132.2,130.3,128.8,128.2,126.8,123.0,122.1,119.8,116.7,114.7,111.8,111.0,55.7,55.7,38.3.
[0133]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0134]
14-(3,4-dimethoxyphenyl)dibenzo[a,j]acridine的制备
[0135]
将0.3mmol的14-(3,4-二甲氧基苯基)-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.6mmol氯化铬的溶于装有1.2ml乙醇与1.2ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌10h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到73mg固体化合物,产率为87%,所得产品结构式如下:
[0136][0137]
如图27和图28所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.04(d,j=9.0hz,2h),7.92(d,j=9.0hz,2h),7.81(d,j=7.7hz,2h),7.44(t,j=7.4hz,2h),7.38(d,j=8.7hz,2h),7.18
–
7.10(m,3h),7.02
–
6.94(m,2h),4.08(s,3h),3.73(s,3h).
13
c nmr(100mhz,cdcl3):δ151.5,149.9,148.4,146.2,135.4,133.4,132.5,130.7,128.9,128.7,128.3,126.5,125.4,122.8,122.2,113.6,113.1,56.2,56.2.
[0138]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0139]
实施例8
[0140]
3,11-dimethyl-14-phenyl-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0141]
将0.3mmol的(e)-n-(6-甲基萘-2-基)-1-苯基甲亚胺、0.55mmol lewis acid(五氟化锑)的溶于装有1.5ml二氯甲烷与1.5ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌12h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到101.3mg固体化合物,产率为87%,所得产品结构式如下:
[0142][0143]
如图29和图30所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.34(d,j=8.6hz,2h),7.66(d,j=8.6hz,2h),7.59(s,2h),7.50(d,j=7.7hz,2h),7.43(d,j=8.7hz,2h),7.17
–
7.10(m,4h),7.01(t,j=7.2hz,1h),6.70(s,1h),6.44(s,1h),2.52(s,6h).
13
c nmr(100mhz,cdcl3):δ146.2,135.4,132.3,130.4,130.3,128.9,128.2,127.9,127.8,127.6,126.0,122.0,116.8,114.6,39.1,21.3.
[0144]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0145]
3,11-dimethyl-14-phenyldibenzo[a,j]acridine的制备
[0146]
将0.3mmol的3,11-二甲基-14-苯基-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.55mmol氯化铬的溶于装有1.5ml二氯甲烷与1.5ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌12h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到67.3mg固体化合物,产率为87%,所得产品结构式如下:
[0147]
[0148]
如图31和图32所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.06(d,j=9.1hz,2h),7.91(d,j=9.1hz,2h),7.76
–
7.63(m,5h),7.50(d,j=6.2hz,2h),7.11(d,j=8.8hz,2h),6.93(d,j=8.8hz,2h),2.48(s,6h).
13
c nmr(100mhz,cdcl3):δ148.1,145.7,143.6,136.3,133.7,132.2,130.8,130.0,128.7,128.7,128.6,128.4,128.4,126.9,122.6,21.0.
[0149]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
[0150]
实施例9
[0151]
3,11,14-triphenyl-6a,14a-dihydro-14h-7λ
2-dibenzo[a,j]acridine的制备
[0152]
将0.3mmol的(e)-1-苯基-n-(6-苯基萘-2-基)甲亚胺、0.5mmol lewis acid(五氟化锑)的溶于装有1.6ml甲苯与1.3ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌8h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到101.7mg固体化合物,产率为66%,所得产品结构式如下:
[0153][0154]
如图33和图34所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.52(d,j=8.8hz,2h),8.02(d,j=2.0hz,2h),7.88(d,j=8.6hz,2h),7.80(d,j=8.7hz,2h),7.76(d,j=9.6hz,4h),7.57(d,2h),7.52(t,j=7.7hz,4h),7.44
–
7.37(m,2h),7.22
–
7.15(m,4h),7.04(t,j=6.9hz,1h),6.79(s,1h),6.56(s,1h).
13
cnmr(100mhz,cdcl3):δ146.0,141.1,135.9,135.7,131.4,130.6,128.8,128.7,128.4,127.8,127.1,127.0,126.6,126.4,126.2,122.7,117.1,114.6,39.3.
[0155]
本实施例中亚胺类化合物和lewis acid也可按照摩尔比1.0:2.0进行称量。
[0156]
3,11,14-triphenyldibenzo[a,j]acridine的制备
[0157]
将0.3mmol的3,11,14-三苯基-6a,14a-二氢-14h-7λ
2-二苯并[a,j]吖啶、0.3mmol氧化铁的溶于装有1.6ml甲苯与1.3ml六氟异丙醇的耐压管内(配有磁力搅拌子),用气球充氩气至少3次,直至空气全部排空,封闭耐压管,于100℃下加热搅拌8h,反应完全后将反应物冷却至室温,经硅藻土过滤掉后留滤液,并减压旋蒸除去溶剂,粗产物经硅胶柱层析分离,得到67.6mg固体化合物,产率为66%,所得产品结构式如下:
[0158][0159]
如图35和图36所示,产品核磁表征:1h nmr(400mhz,cdcl3):δ8.18
–
8.00(m,6h),7.82
–
7.69(m,7h),7.58(d,j=7.1hz,2h),7.51(t,j=7.5hz,4h),7.45
–
7.36(m,4h),7.31
–
7.28(m,2h).
13
c nmr(100mhz,cdcl3):δ148.5,146.4,143.2,140.0,138.9,133.9,132.9,131.0,129.9,129.7,129.4,128.9,128.7,127.7,127.2,126.7,124.4,122.6.
[0160]
本实施例中吖啶类化合物和ddq也可按照摩尔比1.0:2.0进行称量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1