一种真菌Talaromycesendophyticus及其应用
一种真菌talaromyces endophyticus及其应用
技术领域
1.本发明属于微生物技术领域,具体涉及种真菌talaromyces endophyticus及其应用。
背景技术:
2.我国是农业大国,秸秆产量每年在7亿吨以上,居世界第一位,秸秆的有效利用急需解决。采用微生物及其纤维素酶降解秸秆制备还原糖等高附加值产品,进而生产生物能源乙醇,是国内外关注的焦点。但目前菌株产纤维素酶能力仍然较低,造成生产成本较高,成为制约秸秆等生物质生产纤维素乙醇的瓶颈问题。我国山东大学筛选获得野生型penicillium oxalicum 114-2,以麦麸为最佳碳源,野生型菌株生产纤维素酶约为内切葡聚糖酶(4.0u/ml),β-葡萄糖苷酶(0.8u/ml),外切葡聚糖酶(0.3u/ml)。目前,由野生型菌株经过物理和化学诱变处理及基因工程技术改造的突变菌株,在我国现已实现产业化生产纤维素酶。日本东京meiji seika公司使用talaromyces cellulolyticus(原称acremonium cellulolyticus)规模化生产纤维素酶。fujii等报道t.cellulolyticus scf-2612在以微晶纤维素为碳源培养时,其生产纤维素酶的能力分别为内切葡聚糖酶4.52u/mg,β-葡萄糖苷酶1.20u/mg。
技术实现要素:
3.本发明的目的是为了提供一种高产纤维素酶的野生型真菌。
4.本发明提供一种真菌talaromyces endophyticus,所述talaromyces endophyticus的于2022年1月5日保藏于中国典型培养物保藏中心,保藏号为cctcc no:m 2022024,命名为neau-6。
5.本发明提供含有上述真菌talaromyces endophyticus的微生物制剂。
6.本发明提供含有上述的真菌talaromyces endophyticus或上述的微生物制剂在生产纤维素酶中的应用。
7.进一步地限定,所述纤维素酶为内切纤维素酶、外切纤维素酶和β-葡萄糖苷酶。
8.本发明提供一种制备内切纤维素酶的方法,将上述的talaromyces endophyticus在30℃发酵至少5天。
9.进一步地限定,用于发酵的发酵培养基以玉米秸秆粉为碳源;用于发酵的发酵培养基以蛋白胨为氮源。
10.进一步地限定,用于发酵的发酵培养基含有na2hpo4·
12h2o、(nh4)2so4、kh2po4、mgso4·
7h2o、cacl2、微量元素、尿素、tween-80、蛋白胨和玉米秸秆粉,ph至5.5。
11.进一步地限定,所述微量元素feso4·
7h2o、mnso4·
h2o、znso4·
7h2o和cocl2·
2h2o。
12.进一步地限定,用于发酵的发酵培养基含有17.90g的na2hpo4·
12h2o、1.4g的(nh4)2so4、2.0g的kh2po4、0.6g的mgso4·
7h2o、0.6g的cacl2、微量元素1ml、0.3g的尿素、
0.5ml的tween-80、2.0g的蛋白胨和1g的玉米秸秆粉,ph至5.5。
13.本发明提供上述的真菌talaromyces endophyticus产的纤维素酶在提高纤维素酶对离子液体1-乙基-3甲基咪唑醋酸盐的耐受性中的应用。
14.本发明提供上述的真菌talaromyces endophyticus产的纤维素酶与离子液体协同处理生物质中的应用。
15.有益效果:本发明提供talaromyces endophyticus neau-6。由广东省微生物分析检测中心对该菌株发酵液进行了安全性评估,经《食品安全国家标准》急性经口毒性试验gb15193.3-2014检测,根据急性毒性剂量分级标准判定,属实际无毒级别。未经任何物理和化学诱变处理及基因工程技术改造,以玉米秸秆为最佳碳源,野生型菌株生产纤维素酶为内切纤维素酶(20.03u/ml),β-葡萄糖苷酶(2.01u/ml),外切葡聚糖酶(0.84u/ml)。来源于talaromyces endophyticus neau-6的内切纤维素酶,β-葡萄糖苷酶,外切纤维素酶在10%-20%(w/v)1-乙基-3甲基咪唑醋酸盐能够保持85%-100%酶活力。因此talaromyces endophyticus neau-6高产纤维素酶,并且该菌株的纤维素酶在10%-20%(w/v)[emim][ch3coo]中较稳定。
[0016]
【生物保藏信息】:真菌talaromyces endophyticus,于2022年1月5日保藏于中国典型培养物保藏中心,保藏号为cctcc no:m 2022024,命名为neau-6,保藏地址为:中国武汉大学。
附图说明
[0017]
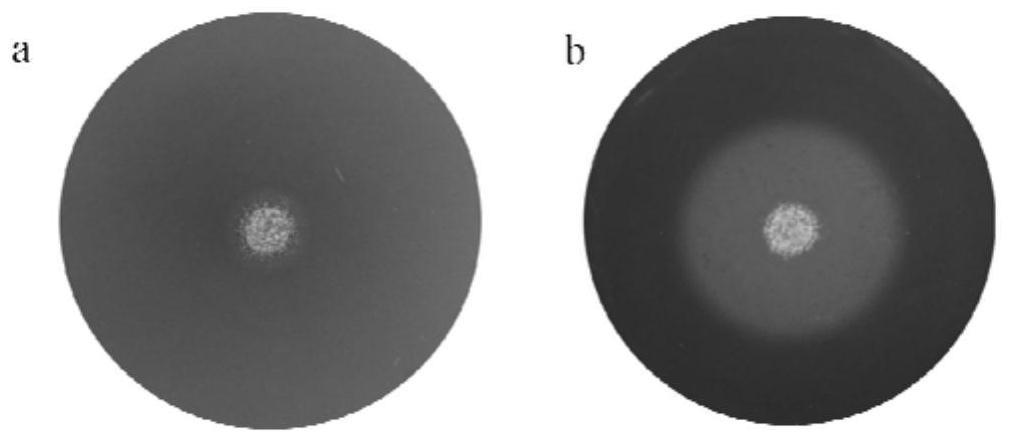
图1为菌株neau-6在cmc固体培养基上培养5天的菌落形态及降解圈;其中,a是菌落形态,b是菌株降解圈;
[0018]
图2为不同培养时间条件下菌株neau-6产纤维素酶能力测定结果;其中,横坐标是时间,纵坐标是酶活力;
[0019]
图3为菌株neau-6在不同培养基上30℃培养7天后的菌落形态,a是pda马铃薯葡萄糖琼脂培养基;b是mea麦芽提取物培养基;c是cya玉米粉琼脂培养基;d是oa燕麦片琼脂培养基;
[0020]
图4为菌株neau-6的分生孢子头及分生孢子的显微形态;
[0021]
图5为菌株neau-6的系统发育树分析结果,a是its建树结果,b是bena建树结果,c是rpb1建树结果,d是cam建树结果。
具体实施方式
[0022]
cmc固体培养基:cmc-na 10g,(nh4)2so
4 2.0g,k2hpo
4 1.0g,nacl 0.5g,mgso
4 0.5g,agar 15g,蒸馏水定容至1000ml。
[0023]
pda培养基:马铃薯洗净去皮,称取200g切成块状,放入水中煮沸20min左右,用八层纱布过滤,加入葡萄糖20g和琼脂15g,加热溶解后定容至1000ml。
[0024]
pd培养基:马铃薯洗净去皮,称取200g切成块状,放入水中煮沸20min左右,用八层纱布过滤,加入葡萄糖20g,加热溶解后定容至1000ml。
[0025]
mendel’s无机盐培养基:na2hpo4·
12h2o 17.907g,(nh4)2so
4 1.4g,kh2po
4 2.0g,mgso4·
7h2o 0.6g,cacl
2 0.6g,trace elements 1ml,urea 0.3g,tween-80 0.5ml,蛋白胨
2.0g,加柠檬酸调节ph至5.5,蒸馏水定容至1000ml。
[0026]
trace elements:feso4·
7h2o 0.5g,mnso4·
h2o 0.16g,znso4·
7h2o 0.14g,cocl2·
2h2o 0.2g,蒸馏水定容至100ml。
[0027]
液体产纤维素酶培养基:100ml mendel’s无机盐培养基中添加1g的玉米秸秆粉。
[0028]
1-乙基-3-甲基咪唑醋酸盐([emim][ch3coo],货号:w131887)购买自上海阿拉丁生化科技股份有限公司。
[0029]
实施例1.分离菌株
[0030]
1.菌株的初筛:称取10g土样于100ml无菌生理盐水中,振荡混匀后取1ml土壤悬液按照梯度稀释涂布法进行梯度稀释,选取10-3
,10-4
,10-5
三个梯度涂布于cmc固体培养基平板,每梯度涂布三个,涂布后正向静置1h,30℃下倒置培养3-5天。
[0031]
挑选菌落形态不同的真菌菌株,编号并进行初次纯化,采用菌丝挑取法进行分离得到纯种菌株,倒置培养5天,备用。将培养5天后的菌种,接种于cmc固体培养基平板,30℃下倒置培养5天。
[0032]
5天后,用1mg/ml的刚果红溶液对平板进行染色1h,随后用1mol/l的nacl脱色三次,每次15min左右。筛选出具有明显降解圈的菌株neau-6,记录降解圈直径及菌落直径。图1为筛选到的菌株neau-6在cmc固体培养基平板上的菌落形态及降解圈。
[0033]
2.菌株的复筛:将初步筛选到的产纤维素酶真菌菌株neau-6,接种于试管斜面pda培养至产孢,将孢子用生理盐水洗下,制备1
×
106个/ml的孢子悬液。取1ml孢子悬液接种于液体pd培养基,30℃,200rpm培养2天,制备湿菌丝。按照1%(v/v)的接种量,取1ml湿菌丝接种至液体产纤维素酶培养基。30℃,150rpm培养不同天数,测定菌株产纤维素酶的酶活力(图2)。发现菌株neau-6在第5天具有最高的产酶能力,三种酶活力分别为内切葡聚糖酶20.03u/ml,β-葡萄糖苷酶2.01u/ml,外切葡聚糖酶0.84u/ml。
[0034]
3.菌株的形态学特征及分子生物学鉴定
[0035]
结果如图3所示,在30℃下培养7d后,菌株生长速度较为缓慢,其菌落直径在pda培养基上达到20mm,在mea培养基上达到23mm,在cma培养基上达到19mm,在oa培养基上达到20mm。pda上的菌落呈青色,边缘新生菌丝呈白色,边缘较不规则,平面,菌落背面呈淡黄色。菌丝较不发达,透明至亚透明,光滑至粗糙,有分隔,分枝,多为1-4μm(2
±
0.5μm)宽。菌柄从表面或气生菌丝产生,透明至亚透明或褐色。分生孢子近透明至绿色,光滑至粗糙,椭圆形至梭形。其分生孢子头及分生孢子显微形态如图4所示。
[0036]
将上述筛选得到的产内切纤维素酶真菌菌株,按照真菌基因组提取试剂盒(omega,usa)说明书提取基因组dna。以基因组dna为模板,以通用引物its1(5
’‑
tccgtaggtgaacctgcgg-3’,seq id no.1)和its4(5
’‑
tcctccgcttattgatatgc-3’,seq id no.2)扩增真菌的rdna的内部转录间隔区(its)。以通用引物bt2a(5
’‑
ggtaaccaaatcggtgctgctttc-3’,seq id no.3)和bt2b(5
’‑
accctcagtgtagtgacccttggc-3’,seq id no.4)用于扩增部分β-微管蛋白基因(bena)。以通用引物cmd5(5
’‑
ccgagtacaaggargccttc-3’,seq id no.5)和cmd6(5
’‑
ccgatrgaggtcatracgtgg-3’,seq id no.6)用于扩增部分钙调蛋白基因(cam)。以通用引物f1843(5
’‑
atttygayggtgaygaratgaac-3’,seq id no.7)和r3096(5
’‑
gracrgtdccrtcatayttracc-3’,seq id no.8)用于扩增部分rna聚合酶ii最大亚基基因(rpb1)。聚合酶链式反应(pcr)在25
μl反应体系中进行,其中含有1.0μl dna模板,正向和反向引物各1.0μl(10μmol/l),12.5μl 2
×
mastermix(北京天根生物科技有限公司)和10.5μl ddh2o,使用以下参数:94℃预变性3min;94℃变性40s,退火温度取决于扩增的基因(its为54℃,tub为58℃,cam为55℃,rpb1为48℃),退火时间60秒,72℃延伸2min,共35个循环;最后在72℃终延伸10min。将pcr扩增产物送至北京华大基因进行测序。将所测得的序列在genbank中进行blast比对,根据比对结果找到同源性序列,使用mage 11按照neighbor-joining算法(nj)和1000次的自举分析构建系统发育树(如图5所示),菌株neau-6经分子生物学鉴定为talaromyces endophyticus。
[0037]
its序列:
[0038]
seq id no.9:
[0039]
ccgtgtttactgttaccgcgttgcctcggcgggcccactggggcctggccccggtcgccggggggcttctgcccccgggcccgcgcccgccgaagcgccctggaaccctgtctgaatagtgagtctgagtgggatattgaatcattaaaactttcaacaacggatctcttggttccggcatcgatgaagaacgcagcgaaatgcgataagtaatgtgaattgcagaattccgtgaatcatcgaatctttgaacgcacattgcgccccctggcattccggggggcatgcctgtccgagcgtcatttctgccctccagcacgcctgggtgttgggtgctgtccccccggggacacgccccaaaagcagtggcggcgccgcgtcgggtcctcgagcgtatggggctctgtcacccgctcgggagggactcggtcggcgctggtc
[0040]
bena序列:
[0041]
seq id no.10:
[0042]
ggcaaactatctctggcgagcacggcctcgatggttccggagtgtgagtaatgcgggattgtcaaattttcaagaataaaccctgatcgtatccagttacaatggctcctccgacctccagttggagcgtatgaacgtctacttcaacgaggtgcgttgaacctcccccacgacatttggaaacgtactcatatcgtataggctagcggcaacaagtacgtcccccgtgccgtcctcgtcgatttggagcctggcaccatggacgctgtccgttccggtcccttcggtcagctcttccgtcccgacaacttcgtcttcggccagtctggtgccggtaacaactggg
[0043]
rpb1序列:
[0044]
seq id no.11:
[0045]
ttatcagcatgattcttccccccggactgaatcttttgcgtgtcgataaagacagtgcgccgctttcagagaaattctccccactggcagatggaggagtgctcgttcatggcggtcagctgctttatggtatgttttccaagaaaaccgttggtgcttcaggaggtggtgtcatccatatcatctttaacgagtacggcacggaagctgctgtgtctttctttaatggtgctcaacgagtcgtcaattattggctgttgcacaatggcttttcaattggtatcggtgacacaattcccgatcagaaaaccattgagcgcatcgagatcgctgttcgcaaaggaaaggaagaggttgagcaactctctactagtgcttactccaacgaattggagcccctgcccggtatgaatattcgagagacttttgaaagcaaagtatcaagggctttgaacaatgctcgtgaagaggctggtagtgagacggaaaagagtc
[0046]
cam序列:
[0047]
seq id no.12:
[0048]
gacaaggatggtgatggtgagtgaccgacattccaacgaacgatgctactcgacattatgatcttgcaatattcgatatacgttagctgtgtctgacatattttcgttcaggccaaatcaccaccaaggaattgggcaccgtcatgcgttccctcggccagaacccttccgaatccgaactgcaggacatgatcaacgaggtcgatgctgacaacaacggcacaatcgatttccccggtatggtttatcgtgaagtgttttcggcactaaagctgattgttgcagaattcttgaccatgatggcccgcaagatgaaggacaccgactcggaggaggaaatccgcgaggccttcaaggtctttgaccgcgacaacaac
ggattcatctcggccgccgaactgcgcc
[0049]
实施例2.获得纤维素酶
[0050]
1.获得纤维素酶
[0051]
将t.endophyticus neau-6在发酵培养基(17.90g的na2hpo4·
12h2o、1.4g的(nh4)2so4、2.0g的kh2po4、0.6g的mgso4·
7h2o、0.6g的cacl2、微量元素1ml、0.3g的尿素、0.5ml的tween-80、2.0g的蛋白胨和1g的玉米秸秆粉),初始ph至5.5,培养5天。在4℃、10000
×
g下离心5min获得培养上清液,用于后续纤维素酶活力的测定。
[0052]
2.纤维素酶活力的测定
[0053]
(1)内切葡聚糖酶(cmcase)活力的测定
[0054]
取1%cmc-na溶液1.5ml,加入0.5ml稀释后的粗酶液,对照组加入灭活的粗酶。50℃条件下水浴30min,加入1.5ml dns显色剂。沸水浴5min终止反应,在540nm波长处测定吸光度,根据葡萄糖标准曲线计算酶活力。
[0055]
(2)外切葡聚糖酶(pnpcase)活力的测定
[0056]
取50μl 0.1%pnpc溶液,加入100μl稀释后的粗酶液,对照组加入灭活的粗酶。50℃条件下水浴反应30min,加入150μl 10%na2co3溶液终止反应,测定420nm波长下的吸光度值,根据对硝基苯酚标准曲线计算酶活力。
[0057]
(3)β-葡萄糖苷酶活力的测定
[0058]
取0.5%水杨苷溶液,加入0.5ml稀释后的粗酶液,对照组加入灭活的粗酶,50℃条件下水浴30min,加入1.5ml dns显色剂,沸水浴5min终止反应,在540nm波长处测定吸光度,根据葡萄糖标准曲线计算酶活力。
[0059]
3.以上酶活力均将上述条件下每分钟水解底物产生1μmol还原糖或对硝基苯酚所需的酶量定义为1u。
[0060]
菌株neau-6在第5天具有最高的产酶能力,三种酶活力分别为内切葡聚糖酶20.03u/ml,β-葡萄糖苷酶2.01u/ml,外切葡聚糖酶0.84u/ml。
[0061]
4.纤维素酶的离子液体耐受性
[0062]
在室温(25℃)下,对于上述菌株发酵产生的纤维素酶粗酶液在10.0%(w/v)或20.0%(w/v)[emim][ch3coo]下孵育1h。
[0063]
按照上述方法中的酶活力测定方法测定内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的剩余酶活力。分别将在0%离子液体浓度下的三种酶活力定义为100%,以相对酶活力=剩余酶活力
÷
原酶活力
×
100%为计算方法,计算内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的相对酶活力。发现菌株所产的三种纤维素酶在离子液体中具有良好的稳定性,在10%(w/v)[emim][ch3coo]条件下,内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶的酶活力均能够保留100%酶活力。在20%(w/v)[emim][ch3coo]条件下,内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶的酶活力仍能够保留96%、87%和93%以上。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1