苯并异噻唑化合物及其药物组合物和应用的制作方法
1.本发明属于医药技术领域,具体涉及一种苯并异噻唑化合物及其药物组合物和应用。
背景技术:
2.早泄(premature ejaculation,早泄)是最常报告的男性性功能障碍之一,全球成年男性早泄发病率为20%~30%,严重影响夫妻感情和家庭和谐。2014年,国际性医学会(the international society for sexual medicine,issm)提出了第一个基于证据的原发性早泄的全面定义。目前临床应用的药物主要为达泊西汀、局部麻醉药等,已为早泄的药物治疗开辟了新的道路。但是这些药物存在疗效差、不良反应多、停药率高等问题。达泊西汀是目前全球唯一上市治疗早泄的药物,临床常见不良反应包括恶心、腹泻、头痛、失眠等,也有极低的严重不良反应,如晕厥。达泊西汀临床停药率很高,累积停用率随时间增加。局部麻醉药可通过降低阴茎头的敏感性延迟射精时间,但常见不良反应是可引起阳痿,性满意度较差。
3.临床医生经常超适应症的使用5-ht再摄取抑制剂(ssris)药物,但患者不能突然停药,需在2~3月内逐渐减量,防止ssris停药综合征,因此临床使用受限,依从性很低。长期应用精神类药物,患者本身接受性较差。因此研究新的治疗早泄药具有临床意义。
技术实现要素:
4.针对上述问题,本发明公开一种新型结构2h-苯并三氮唑取代的苯并异噻唑化合物,以及包含该化合物的药物组合物和其在制备治疗或预防早泄药物中的应用。
5.本发明公开的式(i)所示的苯并异噻唑化合物及其药学上可接受的盐,所述的盐包括盐酸盐、溴氢酸盐、硫酸盐、三氟醋酸盐、甲磺酸盐、酒石酸盐、苹果酸盐、枸橼酸盐、琥珀酸盐等,其盐可含有0.5-3分子的结晶水:
[0006][0007]
一种药物组合物,包含所述的苯并异噻唑化合物或其在药学上可接受的盐,以及药学上可接受的载体;所述及的载体是指药学领域常规的载体,包括:稀释剂、赋形剂如水;粘合剂如纤维素衍生物、明胶、聚乙烯吡咯烷酮;填充剂如淀粉;崩裂剂如碳酸钙、碳酸氢钠;润滑剂如硬脂酸钙或硬脂酸镁。另外,还可以在所述药物组合物中加入其他辅助剂如香味剂和甜味剂。所述药物组合物在用于口服时,可将其制备成常规的固体制剂如片剂、粉剂、口溶膜剂或胶囊;用于外用时,将其制备成喷雾剂、擦剂、膏剂;用于注射时,可将其制备成注射液。
[0008]
本发明所述的药物组合物的各种剂型依据本领域常规的方法进行制备,其中活性成分的含量为0.1%~99.5%(重量比)。
[0009]
本发明所述的苯并异噻唑化合物,或其药学上可接受的盐,或包含所述化合物的药物组合物在制备治疗和/或预防早泄的药物中的应用。
[0010]
本发明的有益效果:
[0011]
本发明所述化合物具有显著的抗早泄作用,本品与临床现有唯一批准上市药物达泊西汀相比,具有显著的治疗特点和实质性的技术进步。
[0012]
本发明所述化合物或其药学上可接受的盐,为一类全新结构的2h-苯并三氮唑取代的苯并异噻唑化合物。经体内活性试验研究,该化合物的抗早泄活性明显强于在售药物达泊西汀。
附图说明
[0013]
图1:pca诱导后30min内wistar大鼠射精总次数柱状图,one-way anova,dunnett post hoc,***p《0.001,与pe model组比较,n=5。
[0014]
图2:pca诱导后30min内wistar大鼠初次射精潜伏期柱状图,one-way anova,dunnett post hoc,*p《0.05,**p《0.01,***p《0.001,与pe model组比较,n=5。
[0015]
图3:pca诱导后30min内wistar大鼠储精囊收缩次数柱状图,one-way anova,dunnett post hoc,***p《0.001,与pe model组比较,n=5。
[0016]
图4:pca诱导后30min内wistar大鼠初次储精囊收缩潜伏期柱状图,one-way anova,dunnett post hoc,**p《0.01,***p《0.001,与pe model组比较,n=5。
[0017]
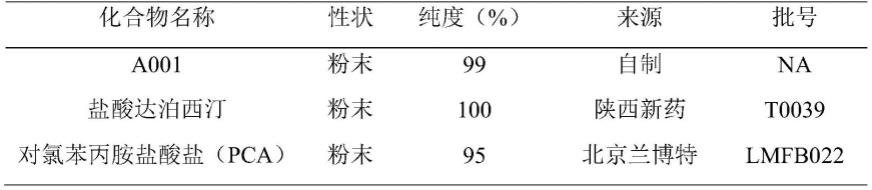
图5:pca诱导后30min内wistar大鼠储精囊基础压力柱状图,one-way anova,dunnett post hoc,***p《0.001,与pe model组比较,n=5。
[0018]
图6:pca诱导后30min内wistar大鼠储精囊压力峰值柱状图,one-way anova,dunnett post hoc,***p《0.001,与pe model组比较,n=5。
具体实施方式
[0019]
试剂和溶剂购自sigma-aldrich或fisher scientific,无需进一步纯化即可使用。所有反应进行薄层色谱分析(硅胶gf-254薄层板)和lc-ms监测。柱层析纯化使用300-400目硅胶(青岛海洋化工有限公司)。1h和
13
c nmr光谱记录在bruker av-400核磁共振仪测定,以tms作为内标。通过lc-ms分析确定的化合物纯度大于95%,并同时用于记录化合物的ms光谱。lc-ms分析使用shimadzu lcms-2020。
[0020]
实施例1
[0021]
(1)关键中间体:1-(4-氯丁基)-2h-苯并三氮唑的制备
[0022][0023]
苯并三氮唑30.0g(251mmol)、1-溴-4-氯丁烷39.3g(229mmol)、四丁基溴化铵1.85g(6mmol)、氢氧化钠水溶液240g(20%)置于500ml单口瓶中,充分搅拌至物料完全溶解。升温至60℃,搅拌反应2h,tlc监控反应进程。反应完毕后,二氯甲烷240ml
×
3萃取,无水
硫酸钠干燥后减压蒸馏除去溶剂,经硅胶层析柱分离纯化得淡黄色油状液体10.23g(产率19.44%)。
[0024]
(2)目标化合物的制备
[0025]
将3-(1-哌嗪基)-1,2-苯并异噻唑1.88g,三乙胺(3.3g)、碘化钾(1.4g)、乙腈15ml加入到50ml单口瓶中,充分搅拌至原料完全溶解。加入1-(4-氯丁基)-2h-苯并三氮唑(1.8g)并升温至81℃回流反应18h。经tlc检测反应结束后,将反应液冷却至室温,抽滤,滤液经减压蒸馏除去溶剂得到黄色油状物。饱和食盐水洗涤,二氯甲烷萃取,减压蒸馏除去溶剂得到油状物,油状物用无水乙醇溶解,加盐酸乙醇溶液调节ph=1,滴毕,室温搅拌1h,析出固体,过滤。滤饼经无水乙醇重结晶得到终产物,记为a001。
[0026]
经无水乙醇重结晶,得到1.64g白色粉末状固体(产率49%)。1h nmr(400mhz,dmso-d6)δ10.62(s,1h),8.12(dd,j=11.4,8.2hz,2h),7.94(dd,j=6.6,3.1hz,2h),7.63
–
7.54(m,1h),7.50
–
7.37(m,3h),4.84(t,j=6.8hz,2h),4.06(d,j=13.6hz,2h),3.57(d,j=12.0hz,2h),3.50
–
3.39(m,2h),3.32
–
3.19(m,4h),2.19
–
2.06(m,2h),1.77(tt,j=6.6,2.5hz,2h).
13
c nmr(100mhz,dmso-d6)δ162.11,152.06,143.63,128.09,126.89,126.31,124.58,123.96,121.14,117.75,55.27,54.86,50.57,46.36,26.50,20.43.lc-ms(esi)m/z:393.15[m+1]
+
。
[0027]
实施例2
[0028]
化合物a001对早泄模型的体内活性研究
[0029]
2.1材料与方法
[0030]
2.1.1化合物信息
[0031][0032]
2.2实验方案
[0033]
2.2.1动物信息
[0034][0035]
2.2.2动物适应
[0036]
动物到达动物设施后,至少适应性喂养一周。在此期间,对动物健康和是否有任何
生理、行为异常进行监测,并将所有出现异常的动物从研究中移除。
[0037]
2.2.3饲养环境
[0038]
动物房的环境控制在温度18-26℃,湿度30-70%,并给予12h光照/12h黑暗循环。12h的黑暗周期可能会被暂时中断,以适应研究方案。
[0039]
2.2.4食物和水
[0040]
大鼠维持饲料(由江苏省协同医药生物工程有限责任公司提供)以及反渗透水在研究过程中都是随时可用的。
[0041]
2.2.5动物选择和禁食
[0042]
本研究中使用的动物是根据动物的健康状况和对笼养的适应能力选择的。实验前,动物不禁食不禁水。
[0043]
2.2.6动物分组
[0044]
实验前对动物称取体重,并根据体重进行随机分组,具体如下:
[0045][0046][0047]
注:p.o.表示口服;i.p.表示腹腔注射;pca表示对氯苯丙胺盐酸盐。
[0048]
2.2.7实验步骤:
[0049]
雄性wistar大鼠,体重300g左右,适应一周后开始实验。实验当天,使用舒泰50 20mg/kg i.p.联合噻拉嗪8mg/kg i.p.麻醉动物后,用保温毯维持体温37℃。暴露颈总动脉用pe50插管以监测实时动脉压力(收缩压、舒张压以及平均动脉压)。暴露动物储精囊及海绵体肌。记录储精囊的压力和海绵体肌电稳定基线10min。达泊西汀组尾静脉给予药物,待测化合物组口服给予待测化合物(pe model组用溶媒代替),1min后诱导pe造模时腹腔注射pca5mg/kg,继续记录精囊压力图和球海绵体肌emg变化30min。
[0050]
实验终点:
[0051]
a.30min内,动物实际射精次数及第一次射精潜伏期
[0052]
b.30min内,储精囊收缩的次数,第一次收缩潜伏期,基础压力及峰值压力
[0053]
2.2.8数据分析
[0054]
实验数据采用mean
±
s.e.m.表示,graphpad prism 7.0软件进行统计分析。多组间比较采用单因素方差分析(one-way anova),post hoc test采用dunnett’t-test进行统计分析;两组间比较采用student's t-test进行统计分析。p<0.05为具有显著性差异。
[0055]
2.3结果
[0056]
表1 pca诱导后30min内wistar大鼠各项早泄指标原始数据表
[0057]
[0058][0059]
从本研究中得出,wistar大鼠在pca诱导后30min内射精次数基本维持约18次,所有剂量组别均较pe model组在射精次数上呈现极为显著的下降(均p《0.05)。低、中、高剂量均优于达泊西汀。(图1)
[0060]
从初次射精潜伏期结果可得,均较pe model组在初次射精潜伏期时间上呈现极为显著的延长(分别p《0.05,p《0.01,p《0.001)(图2)。此外,pca诱导后30min内,pe model组大鼠的储精囊收缩次数约为22.4次,储精囊的收缩次数均在6次以下,所有组别均较pe model组在储精囊收缩次数上呈现极为显著的下降(均p《0.05)(图3)2mg/kg剂量下优于达泊西汀。
[0061]
同时,观察大鼠储精囊初次收缩潜伏期可得,sham组、达泊西汀组、中剂量组、高剂量组均在初次储精囊收缩潜伏期上较pe model组存在显著的上升(分别p《0.01,p《0.001)(图4)。并且,根据储精囊基础压力监测的数据表明,所有组别均能有效降低pca诱导后引起的基础储精囊压力(均p《0.001)(图5)。相似的是,储精囊峰值压力监测的数据表明,所有组别均能极为有效降低pca诱导后引起的峰值储精囊压力(均p《0.001)(图6)。
[0062]
2.4结论
[0063]
通过pca诱导wistar大鼠早泄模型,监测不同剂量下的本专利受试药物和达泊西汀的潜在效果。从大鼠射精次数、初次射精潜伏期、储精囊压力、海绵体肌肉收缩等相关指标统计分析,揭示达泊西汀和本化合物均能够有效延长射精潜伏期,并且大幅减少射精次数、降低储精囊压力和海绵体肌肉收缩次数。与达泊西汀治疗pe的药效相比,本化合物口服2mg/kg剂量优于盐酸达泊西汀静脉注射剂量2mg/kg。参照达泊西汀生物利用度42%,在相同剂量下,本化合物抗早泄活性显著优于达泊西汀。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1