基于细胞阻抗传感的雌激素受体拮抗剂的定量筛选方法
1.本公开涉及生物芯片传感检测技术领域,尤其涉及一种基于细胞阻抗传感的雌激素受体拮抗剂的定量筛选方法。
背景技术:
2.运动性是活细胞的基本特征。细胞迁移参与伤口愈合、胚胎发育、免疫反应和许多病理过程,如癌症转移和炎症反应。因此,研究细胞迁移行为的方法对于生命医学科学、生物学、生物工程和相关领域的广泛学科都是非常有用的研究工具。细胞迁移在癌症研究中是特别有趣的,因为癌症患者的死亡原因主要与转移进展有关。肿瘤要向全身扩散,癌细胞必须通过细胞外基质迁移侵袭,注入血液循环,附着在远处,最后外溢形成远处病灶。可以采用各种生物学方法来详细研究这些事件。细胞培养、创口闭合和transwell迁移和侵袭试验在科学界被广泛应用。这些测试可以提供必要的数据,可以让我们了解某种特定类型的细胞自发迁移或对化学引诱剂作出反应以及定向迁移的能力。几种迁移表型已被描述包括:细胞可以以单细胞形式迁移,如间充质或变形运动,或通过标记为集体迁移或细胞流动的多细胞运动。细胞的迁移和侵袭为诸如伤口愈合和肿瘤转移等关键的生理和病理现象提供了丰富的干预靶点。随着高通量和高含量成像系统的出现,在测试范式中已经出现了使用生理学相关的基于细胞的分析方法的趋势。这使得在药物发现筛选过程中更有效地识别先导化合物和不良影响。
3.癌症严重危害人类生命健康,是导致人类死亡的第一大原因。癌症发病率和死亡率在世界范围内快速增加,不仅与人口老龄化和人口数量增加有关,也体现了癌症主要危险因素的流行及其分布的变化。随着人口增加和全球老龄化,癌症成为许多国家过早死亡和预期寿命降低的主要原因。在男性中肺癌的死亡率最高,而在女性中乳腺癌的死亡率最高。雌激素受体属于类固醇激素受体超家族成员之一,是一种配体依赖性转录因子,它能与雌激素特异性结合,通过雌激素应答元件调节基因的转录,为雌激素发挥生物学效应提供保证。由于在许多乳腺癌患者中均发现有雌激素受体(er),且肿瘤生长受到雌激素的刺激,因此降低雌激素的浓度是目前治疗乳腺癌的主要方法之一。免疫检查点抑制剂的应用开创了癌症治疗的新纪元,但还有很多问题悬而未决。进一步了解肿瘤与人体免疫系统之间的相互作用,有助于探索更加有效的针对癌症的免疫治疗方案,从而使癌症的治疗迎来新的突破。
技术实现要素:
4.有鉴于此,本公开的主要目的在于提供了一种基于细胞阻抗传感的雌激素受体拮抗剂的定量筛选方法,以解决传统方法对细胞活体产生破坏,需要标记或终点非定量检测,进而大大局限了生物信息的全程动态收集等技术问题。
5.根据本公开的一个方面,提供了一种基于细胞阻抗传感的雌激素受体拮抗剂的定量筛选方法,该方法包括:制备高通量叉指电极阵列导电芯片;对高通量叉指电极阵列导电
芯片进行表面处理;在高通量叉指电极阵列导电芯片表面铺满乳腺癌细胞并进行饥饿处理;对乳腺癌细胞进行雌激素受体拮抗剂处理;在乳腺癌细胞上形成聚合细胞外基质并加入趋化因子;实时进行细胞阻抗检测,获取细胞的阻抗信息;根据阻抗信息进行雌激素受体拮抗剂的定量筛选。
6.根据本公开的实施例,所述制备高通量叉指电极阵列导电芯片的步骤,包括:在auto-cad软件上绘制所设计的叉指电极阵列图案;采用高速激光刻蚀氧化铟锡导电玻璃制备叉指电极阵列;将具有叉指电极阵列的氧化铟锡导电玻璃与无底细胞培养孔板、印刷电路板组装为高通量叉指电极阵列导电芯片。
7.根据本公开的实施例,所述叉指电极阵列图案中单个电极的长度和宽度分别为7mm和100μm,相邻电极之间的间隙为100μm;所述采用高速激光刻蚀氧化铟锡导电玻璃制备叉指电极阵列,包括:将auto-cad所设计的叉指电极阵列图案直接导入到导电薄膜激光刻蚀机设备中,设置固体激光器的激光波长为1064nm,刻印速率为1000mm/s,激光频率为40khz,对氧化铟锡导电玻璃进行干法激光蚀刻,得到具有叉指电极阵列的氧化铟锡导电玻璃;所述将具有叉指电极阵列的氧化铟锡导电玻璃与无底细胞培养孔板、印刷电路板组装为高通量叉指电极阵列导电芯片,包括:使用聚二甲基硅氧烷预聚物组分将无底细胞培养孔板粘在具有叉指电极阵列的氧化铟锡导电玻璃上;将设计有电路的印刷电路板通过插针引脚连接到氧化铟锡导电玻璃的氧化铟锡电极上,组装获得高通量叉指电极阵列导电芯片。
8.根据本公开的实施例,所述对高通量叉指电极阵列导电芯片进行表面处理,包括:以甲醇清洗高通量叉指电极阵列导电芯片;以3-氨基丙基三乙氧基硅烷为硅烷偶联剂对预清洗的高通量叉指电极阵列导电芯片的表面修饰氨基;以聚(苯乙烯-co-马来酸酐)溶液对高通量叉指电极阵列导电芯片的表面修饰酸酐基团。
9.根据本公开的实施例,所述在高通量叉指电极阵列导电芯片表面铺满乳腺癌细胞并进行饥饿处理,包括:选取乳腺癌细胞作为肿瘤细胞;将乳腺癌细胞悬液接种到表面预处理后的高通量叉指电极阵列导电芯片上,以完全培养基培养;用含0.5%胚牛血清的培养基饥饿处理乳腺癌细胞,用1
×
杜氏磷酸盐缓冲液清洗乳腺癌细胞。
10.根据本公开的实施例,所述对乳腺癌细胞进行雌激素受体拮抗剂处理,包括:以不同浓度的雌激素受体拮抗剂氟维司群(fulvestrant)溶液对饥饿处理后的乳腺癌细胞进行加药作用。
11.根据本公开的实施例,所述在乳腺癌细胞上形成聚合细胞外基质并加入趋化因子,包括:依据预设配比,将i型胶原蛋白溶液、改良伊格尔培养基、10
×
磷酸盐缓冲盐溶液、氢氧化钠溶液进行混合,铺在乳腺癌细胞层的上方形成不同力学性能的聚合水凝胶,其中,所有试剂均在冰上保持并混合;在37℃的细胞培养箱中成胶后,加入完全培养基构建三维细胞培养体系,其中所用趋化因子为完全培养基中的胚牛血清。
12.根据本公开的实施例,所述i型胶原蛋白溶液在稀释后的预设浓度为3~5.6mg/ml;依据预设配比混合后的溶液中i型胶原蛋白的终浓度为2.5~4mg/ml;依据预设配比混合后的溶液ph值中和至7.3~7.5。
13.根据本公开的实施例,所述实时进行细胞阻抗检测,获取细胞的阻抗信息,包括:将高通量叉指电极阵列导电芯片与电子阻抗分析仪电连接,以输出频率为10khz~100khz、
输出正弦电压为10mv~30mv对雌激素受体拮抗剂作用后三维基质中正在进行群体细胞侵袭的细胞阻抗传感芯片进行扫频测量;获取定量的细胞阻抗信息是以在水凝胶中加入趋化因子为零时刻,进行多时间点的阻抗扫频测量,以获得不同频率不同时间点的细胞阻抗值。
14.根据本公开的实施例,所述根据阻抗信息进行雌激素受体拮抗剂的定量筛选,包括:根据获得的不同频率不同时间点的细胞阻抗值,以相对阻抗值变化表征三维基质中群体细胞随时间的侵袭距离,进而得到细胞侵袭过程的信息,由此实现拮抗剂药物的定量筛选。
15.本公开实施例提供的这种基于细胞阻抗传感的雌激素受体拮抗剂的定量筛选方法,通过雌激素受体拮抗剂(即不同浓度梯度的氟维司群)作用于乳腺癌细胞,诱导i型胶原蛋白凝胶中群体细胞侵袭,有效实现了三维基质中细胞侵袭过程中高效稳定的细胞阻抗传感检测,使得雌激素受体拮抗剂定量筛选达到了实时、无标记、持续动态检测的技术效果。
附图说明
16.通过以下参照附图对本公开实施例的描述,本公开的上述内容以及其他目的、特征和优点将更为清楚,在附图中:
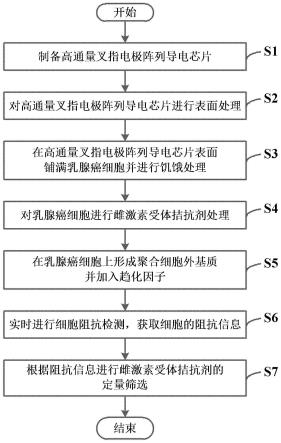
17.图1示意性示出了根据本公开实施例的基于细胞阻抗传感的雌激素受体拮抗剂的定量筛选方法的流程图;
18.图2示意性示出了根据本公开实施例的高通量叉指电极阵列导电芯片组装过程的流程示意图;
19.图3示意性示出了根据本公开实施例的不同力学性能的i型胶原蛋白凝胶的激光共聚焦扫描显微图;
20.图4示意性示出了根据本公开实施例的雌激素受体拮抗剂影响乳腺癌细胞蛋白表达的结果示意图;
21.图5示意性示出了根据本公开实施例的细胞在雌激素受体拮抗剂作用后阻抗传感检测获得的相对阻抗值与时间的对应关系图。
具体实施方式
22.以下,将参照附图来描述本公开的实施例。但是应该理解,这些描述只是示例性的,而并非要限制本公开的范围。在下面的详细描述中,为便于解释,阐述了许多具体的细节以提供对本公开实施例的全面理解。然而,明显地,一个或多个实施例在没有这些具体细节的情况下也可以被实施。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本公开的概念。
23.在此使用的术语仅仅是为了描述具体实施例,而并非意在限制本公开。在此使用的术语“包括”、“包含”等表明了所述特征、步骤、操作和/或部件的存在,但是并不排除存在或添加一个或多个其他特征、步骤、操作或部件。
24.在此使用的所有术语(包括技术和科学术语)具有本领域技术人员通常所理解的含义,除非另外定义。应注意,这里使用的术语应解释为具有与本说明书的上下文相一致的含义,而不应以理想化或过于刻板的方式来解释。
25.细胞毒性是抗癌药物作用的关键所在,细胞毒性引起的细胞死亡有程序性和非程
序性之分,后者即坏死。药物可以针对相应的细胞死亡信号通路进行调控,从而抑制或诱导细胞的死亡,对细胞死亡信号通路的深入研究,可为药物研发提供新的靶点。乳腺癌是女性常见的恶性肿瘤,对于早期乳腺癌一般是以手术治疗为主,对于中晚期乳腺癌则是以化疗、靶向治疗、内分泌治疗、放射治疗为主。目前用于治疗乳腺癌的抗肿瘤药物分为以下几类:内分泌治疗药物、化疗药物、靶向药物。乳腺癌的发病机制与雌激素受体α(oestrogen receptor alpha,erα)有关,该受体由性激素激活,促进乳腺癌细胞的异常增殖。erα作用的经典机制包括通过与靶基因启动子内的雌激素反应单元结合来调节雌激素反应基因的转录。雌激素受体α是erα阳性乳腺癌的内分泌治疗靶点。erα阳性乳腺癌在辅助内分泌治疗中表达缺失导致了对常用辅助内分泌治疗的耐药性,并与erα阴性转移性复发相关。然而,erα丢失如何与转移相关仍有待阐明,特别是在三维(3d)环境中,这种环境可以更好地模拟人乳腺癌的体内转移。
26.传统抗肿瘤药物细胞毒性测定方法有台盼蓝染色法、克隆(集落)形成法、3h放射性同位素掺入法、mtt法以及atp检测法等。这些细胞学研究检测形式多是终点检测法,仅给实验提供一个最终结果,不能实时定量追踪三维细胞侵袭且经常需要标记,从而对细胞产生破坏。由于细胞是活体,生物细胞进程是动态的而非静态的,终点检测法大大局限了生物信息的全程动态收集。
27.基于高通量叉指电极阵列导电芯片的细胞阻抗传感技术通过电阻抗的形式,可以实现实时、无标记、持续动态检测细胞侵袭位置变化。在高通量叉指电极阵列导电芯片的底部整合有高通量微电极阵列,获得的细胞阻抗值可以细胞指数(cell index,简称ci)的形式输出,可定量评估细胞生理状态包括细胞数量、附着状态及细胞形态变化等。基于阻抗检测得到的动力学谱图能够提供雌激素受体拮抗剂等化合物引起的细胞毒性作用的瞬时效应信息。此外,在抗肿瘤药物细胞毒性试验中,细胞阻抗传感检测能够精确确定化合物介导的细胞毒性作用发挥最大效应的时间点,有助于药物作用机理的研究及揭示。
28.本公开的实施例提供了一种基于细胞侵袭实时追踪的雌激素受体拮抗剂的定量筛选方法,如图1所述,该方法包括:
29.步骤s1:制备高通量叉指电极阵列导电芯片;
30.步骤s2:对高通量叉指电极阵列导电芯片进行表面处理;
31.步骤s3:在高通量叉指电极阵列导电芯片表面铺满乳腺癌细胞并进行饥饿处理;
32.步骤s4:对乳腺癌细胞进行雌激素受体拮抗剂处理;
33.步骤s5:在乳腺癌细胞上形成聚合细胞外基质并加入趋化因子;
34.步骤s6:实时进行细胞阻抗检测,获取细胞的阻抗信息;
35.步骤s7:根据阻抗信息进行雌激素受体拮抗剂的定量筛选。
36.根据本公开的实施例,将上述制备的具有可三维培养细胞的i型胶原蛋白凝胶的高通量叉指电极阵列导电芯片作为检测电极与阻抗谱仪电连接,构建一细胞阻抗传感系统,对不同浓度雌激素受体拮抗剂药物作用的群体细胞侵袭进行实时定量的细胞阻抗检测。具体地,在高通量叉指电极阵列导电芯片的微电极阵列上接种乳腺癌细胞,待细胞长满加不同浓度内分泌治疗药物作用后,在细胞层上经自组装纤维化过程制备了适于乳腺癌细胞三维侵袭模型的i型胶原蛋白凝胶;然后将阻抗谱仪通过导线经金属夹片与待检测细胞所在的检测电极(即细胞阻抗传感芯片)相连,以测量待检测细胞的阻抗值。
37.图2为根据本公开实施例的高通量叉指电极阵列导电芯片组装过程的流程示意图,即步骤s1中所述制备高通量叉指电极阵列导电芯片,具体包括:在auto-cad软件上绘制所设计的叉指电极阵列图案;采用高速激光刻蚀氧化铟锡导电玻璃制备叉指电极阵列;将具有叉指电极阵列的氧化铟锡导电玻璃与无底细胞培养孔板、印刷电路板组装为高通量叉指电极阵列导电芯片。
38.在本公开实施例中,所述叉指电极阵列包含了48对叉指电极,单个电极的长度和宽度分别为7mm和100μm,相邻单电极之间的间隙为100μm;将auto-cad所设计的叉指电极阵列图案直接导入到太阳能钙钛矿电池激光刻蚀机中,设置固体激光器的激光波长为1064nm,刻印速率为1000mm/s,激光频率为40khz,聚焦光斑小于10μm,ccd自动定位精度为2μm,对氧化铟锡导电玻璃进行干法激光蚀刻,即飞秒激光刻蚀,得到具有叉指电极阵列的氧化铟锡导电玻璃。
39.关于上述具有叉指电极阵列图案的高通量叉指电极阵列导电芯片可以采用氧化铟锡导电玻璃作为衬底进行制备,该高通量叉指电极阵列导电芯片还选择其他具有导电薄膜结构的衬底。具体地,导电玻璃的尺寸为250
×
100
×
0.4mm,方阻小于6ω,膜层厚度为185nm,透光率大于85%,膜层颜色为淡蓝色。
40.为更好的在具有叉指电极阵列的高通量叉指电极阵列导电芯片表面制备适于肿瘤侵袭模型的i型胶原蛋白凝胶,同时为形成细胞阻抗传感检测过程中细胞的接种和培养条件,需要在芯片的导电面上围绕叉指电极形成细胞培养腔阵列。具体地,在制得叉指电极阵列氧化铟锡导电玻璃芯片之后,通过微精密激光打孔去掉48孔细胞培养板的底,选择无底孔板作为本公开的环形结构,围设导电芯片上的叉指电极阵列粘结在导电芯片上,形成初步的多孔细胞培养腔。其中,粘结剂选择主剂∶固化剂=20∶1的聚二甲基硅氧烷粘接剂,48孔细胞培养板的孔直径为10.2mm,生长面积为0.8m2。将粘结完毕的细胞培养腔结构放入70℃烘箱烘干2小时,形成最终的多孔细胞培养腔,结果如图2所示。
41.在高通量叉指电极阵列导电芯片的叉指电极上制备多孔细胞培养腔后,用上下两层具有导电线路的印刷电路板作为夹具以固定粘有细胞培养孔板的氧化铟锡导电玻璃芯片,并通过插针引脚的方式将氧化铟锡导电玻璃的导电面与印刷电路板的导电线路电连接。
42.在本公开实施例中,步骤s2中所述对高通量叉指电极阵列导电芯片进行表面处理,具体包括:以甲醇清洗高通量叉指电极阵列导电芯片;以3-氨基丙基三乙氧基硅烷为硅烷偶联剂对预清洗的高通量叉指电极阵列导电芯片的表面修饰氨基;以聚(苯乙烯-co-马来酸酐)溶液对高通量叉指电极阵列导电芯片的表面修饰酸酐基团。
43.根据本公开的实施例,需要对光刻有高通量叉指电极阵列的芯片进行表面处理,以用于后续在细胞培养腔中形成聚合水凝胶,在i型胶原蛋白凝胶纤维化过程中酸酐基团的存在使得赖氨酸侧链能够共价键合凝胶表面,从而将适于肿瘤侵袭模型的i型胶原蛋白凝胶固定在具有反应性共聚物涂层的导电芯片皿表面。
44.在上述实施例的基础上,甲醇为无水甲醇,清洗次数至少为2次;3-氨基丙基三乙氧基硅烷溶液的配比为3-氨基丙基三乙氧基硅烷∶丙酮=3∶25~4∶25;聚(苯乙烯-co-马来酸酐)为重均分子量2000~3000,质量百分比0.14~0.15%的酸酐共聚物,其酸酐溶液配比为聚(苯乙烯-co-马来酸酐)∶丙酮=0.9∶2~1.1∶2。
45.采用无水甲醇清洗细胞培养腔2次,每次以摇床100rpm转速清洗3min,氮气吹干。以3-氨基丙基三乙氧基硅烷为硅烷偶联剂,加入丙酮配制3-氨基丙基三乙氧基硅烷∶丙酮=3∶25溶液对预清洗的细胞培养腔表面修饰氨基。具体地,可以在10.2mm内径的细胞培养腔中加入200μl上述溶液,不加盖置于通风橱中等待1h彻底自然晾干,此时,细胞培养腔底部呈现白色。然后,用去离子水清洗培养腔2次,每次3min,氮气吹干。再将聚(苯乙烯-co-马来酸酐)溶液以低速300rpm 20s旋涂在修饰了氨基的细胞培养腔表面以进一步修饰酸酐基团,配比为聚(苯乙烯-co-马来酸酐)∶丙酮=1∶2,其中,聚(苯乙烯-co-马来酸酐)为质量百分比0.14%,重均分子量2000~3000的酸酐共聚物。不加盖置于通风橱中等待30min彻底自然晾干,最后用去离子水清洗培养腔2次,每次3min,氮气吹干。
46.在本公开实施例中,步骤s3中所述在高通量叉指电极阵列导电芯片表面铺满乳腺癌细胞并进行饥饿处理,具体包括:选取乳腺癌细胞作为肿瘤细胞;将乳腺癌细胞悬液接种到表面预处理后的高通量叉指电极阵列导电芯片上,以完全培养基培养;用含0.5%胚牛血清的培养基饥饿处理乳腺癌细胞,用1
×
杜氏磷酸盐缓冲液清洗乳腺癌细胞。
47.在预处理的导电芯片表面铺满所选肿瘤细胞系细胞,所选的肿瘤细胞系可以为人乳腺癌细胞mcf-7;用1
×
磷酸盐缓冲盐溶液清洗细胞2次后,以0.25%的trypsin-edta溶液消化mcf-7细胞3min,用血球计数板计数后,将40
×
104数目的mcf-7细胞的细胞悬液接种到表面预处理并经紫外灭菌30min以上的细胞培养腔中,置于37℃5%co2细胞培养箱中以改良伊格尔高糖完全培养基培养24h;待细胞快要长满时,用含0.5%胚牛血清的培养基饥饿处理细胞24h,用1
×
杜氏磷酸盐缓冲液清洗细胞2次以除去细胞杂质。
48.在本公开实施例中,步骤s4中所述对乳腺癌细胞进行雌激素受体拮抗剂处理,具体包括:以不同浓度的雌激素受体拮抗剂氟维司群(fulvestrant)溶液对饥饿处理后的乳腺癌细胞进行加药作用。
49.进一步地,对多孔细胞培养腔中的乳腺癌细胞雌激素受体进行加药作用。细胞饥饿处理后,细胞培养腔中的细胞量应该达到90%~100%的饱和度。接着以不同浓度的氟维司群溶液对饥饿处理后的细胞继续加药作用2h。
50.在上述实施例的基础上,含胚牛血清的培养基为添加了青霉素链霉素混合双抗的改良伊格尔高糖培养基;不同浓度的氟维司群溶液为浓度范围为1nmol/l~20nmol/l。
51.上述含0.5%胚牛血清的培养基为添加了1%双抗(青霉素链霉素混合双抗)的改良伊格尔高糖培养基,不同浓度的氟维司群溶液为浓度梯度1nmol/l、2nmol/l、4nmol/l、10nmol/l、20nmol/l的氟维司群溶液。在氟维司群溶液的配制过程中,先用1.65ml的dmso溶解恢复至室温的10mg氟维司群粉末涡旋振荡得到10mmol/l的储存液,再以含0.5%胚牛血清的培养基稀释储存液至工作浓度,以用于乳腺癌细胞雌激素受体的加药作用。
52.在本公开的实施例中,以不同浓度的氟维司群溶液对饥饿处理后的乳腺癌细胞加药作用。氟维司群是一类新的雌激素受体拮抗剂,是雌激素受体下调剂类抗乳腺癌治疗药物。在许多乳腺癌患者中均发现有雌激素受体,且肿瘤生长收到雌激素的刺激,降低雌激素的浓度是目前治疗乳腺癌的主要方法之一。氟维司群可以与雌激素受体竞争性结合,亲和力与雌二醇类似。氟维司群还可阻滞受体,抑制雌激素的结合,并激发受体发生形态改变,降低雌激素受体浓度而损害肿瘤细胞。雌激素受体α是乳腺癌中黏着斑纽蛋白(vinculin,vcl)表达的转录启动子。黏着斑纽蛋白是一种在局灶性黏着斑中发现的膜细胞骨架蛋白,
参与了细胞外基质与肌动蛋白骨架的连接。不表达黏着斑纽蛋白的细胞在转染了黏着斑纽蛋白cdna后,其运动性和致瘤性明显降低。在一些高转移性癌细胞中发现了黏着斑纽蛋白的表达下调。在人乳腺癌组织中,雌激素受体α与黏着斑纽蛋白表达呈正相关。雌激素受体α通过上调三维基质中的黏着斑纽蛋白来抑制乳腺癌细胞的变形运动,进而促进细胞-细胞和细胞-基质的粘附,抑制变形运动突出的形成。
53.在本公开的实施例中,也对拮抗剂作用后的乳腺癌细胞进行了蛋白质印记分析(western blot analysis,wb)和免疫荧光分析实验,评估用氟维司群处理的mcf-7细胞中雌激素受体α和黏着斑纽蛋白的表达水平。在wb实验中,首先,用预冷1
×
杜氏磷酸盐缓冲液(ph 7.4)冲洗细胞以去除可溶性因子,然后用含有0.5mol/l三羟甲基氨基甲烷盐酸盐(tris-hcl,ph 7.4)、1.5mol/l氯化钠、2.5%脱氧胆酸、10%np-40裂解液、10mmol/l乙二胺四乙酸(edta)和蛋白酶抑制剂混合物的放射免疫沉淀分析裂解缓冲液(ripa)裂解细胞。然后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)分离总蛋白混合物,并使用bio-rad半干电泳池将其转移到聚偏二氟乙烯膜上。将膜与抗雌激素受体α抗体和抗黏着斑纽蛋白抗体孵育后,用辣根过氧化物酶(hr)结合的免疫球蛋白(igg)抗体标记靶抗体。hrp增强化学发光用于免疫反应蛋白可视化,结果如图4a所示。在免疫荧光分析实验中,首先,用1
×
杜氏磷酸盐缓冲液清洗细胞,并在4%(w/v)多聚甲醛中固定20分钟,然后用0.1%(v/v)triton x100打孔,并在室温下在2%(w/v)牛血清白蛋白(bsa)中封闭2小时。封闭后,细胞在4℃下与抗雌激素受体α一抗或重组抗黏着斑纽蛋白一抗孵育过夜,并分别与二级fitc结合抗体孵育2h。然后,在室温下用鬼笔环肽(phalloidin)染色细胞骨架3小时。细胞核在室温下用dapi复染30分钟。在每次固定、打孔和染色步骤后,用1
×
杜氏磷酸盐缓冲液冲洗细胞3次。利用倒置共聚焦激光扫描显微镜a1,使用20
×
/na 0.75物镜,获取并分析细胞的高分辨率图像,结果如图4b所示。与对照组相比,进一步证实,在下调mcf-7细胞中抗雌激素受体α的核表达后,黏着斑纽蛋白的表达也相应降低。
54.在本公开实施例中,步骤s5中所述在乳腺癌细胞上形成聚合细胞外基质并加入趋化因子,具体包括:依据预设配比,将i型胶原蛋白溶液、改良伊格尔培养基、10
×
磷酸盐缓冲盐溶液、氢氧化钠溶液进行混合,铺在乳腺癌细胞层的上方形成不同力学性能的聚合水凝胶,其中,所有试剂均在冰上保持并混合;在37℃的细胞培养箱中成胶后,加入完全培养基构建三维细胞培养体系,其中所用趋化因子为完全培养基中的胚牛血清。
55.在本公开的实施例中,所谓三维聚合细胞外基质可以是经自组装纤维化过程形成的具有体内细胞外基质的许多纳米和微观结构特征的i型胶原蛋白凝胶,具体可以通过原位自组装纤维化过程形成。以不同配比称取浓度为8.9~10.9mg/ml的i型胶原蛋白原液、摩尔浓度为0.02mol/l的乙酸溶液、浓度为1
×
的改良伊格尔培养基、浓度为10
×
的磷酸盐缓冲盐溶液、摩尔浓度为0.5mol/l的氢氧化钠溶液,将其涡旋均匀混合,即可得到混合水凝胶。
56.根据本公开的实施例,在上述原位自组装纤维化过程前,称取或配制的乙酸的溶液的摩尔浓度可以为0.02mol/l;高浓度的i型胶原蛋白原液的浓度可以为8.9~10.9mg/ml;改良伊格尔培养基的浓度可以为1
×
;磷酸盐缓冲盐溶液的浓度可以为10
×
;以及氢氧化钠的溶液的摩尔浓度可以为0.5mol/l。
57.在上述实施例的基础上,所述i型胶原蛋白溶液在稀释后的预设浓度为3~5.6mg/
ml;依据预设配比混合后的溶液中i型胶原蛋白的终浓度为2.5~4mg/ml;依据预设配比混合后的溶液ph值中和至7.3~7.5。
58.其中,乙酸溶液可以稀释高浓度的i型胶原蛋白原液到预设浓度;氢氧化钠溶液可以中和依据预设配比混合后的溶液ph至7.3~7.5。
59.图3为根据本公开实施例的不同力学性能的i型胶原蛋白凝胶的激光共聚焦扫描显微图。
60.根据本公开的实施例,关于经原位自组装纤维化过程形成i型胶原蛋白凝胶,具体地,可以依据如下制备过程形成,包括:将上述称取的各组成材料或溶液进行混合之后,快速超声振荡30s,用移液枪吸取200μl溶液快速滴于细胞培养腔中,以替换含0.5%胚牛血清的培养基,同时覆盖附着在微电极阵列上的mcf-7细胞,注意避免在溶液中引入气泡,所有试剂均在冰上(4℃)保持并混合以防止i型胶原蛋白单体自聚;以及迅速将导电芯片皿转移至37℃5%co295%湿度的细胞培养箱中成胶3h,经自组装纤维化过程制备适于群体细胞侵袭的三维细胞外基质。
61.在本公开实施例中,步骤s6中所述在乳腺癌细胞上形成聚合细胞外基质并加入趋化因子,具体包括:将高通量叉指电极阵列导电芯片与电子阻抗分析仪电连接,以输出频率为10khz~100khz、输出正弦电压为10mv~30mv对雌激素受体拮抗剂作用后三维基质中正在进行群体细胞侵袭的细胞阻抗传感芯片进行扫频测量;获取定量的细胞阻抗信息是以在水凝胶中加入趋化因子为零时刻,进行多时间点的阻抗扫频测量,以获得不同频率不同时间点的细胞阻抗值。
62.在本公开实施例中,进行细胞阻抗检测,包括:以输出正弦电压为10mv~30mv、输出频率为10khz~100khz的两端法阻抗测量模式(2-terminal impedance measurement,简称2-term z)对三维基质中不同浓度氟维司群作用的群体细胞侵袭过程进行扫频测量,以获得不同频率下细胞阻抗值;获取细胞阻抗信息是以在i型胶原蛋白凝胶中加入完全培养基为零时刻,进行多时间段的阻抗扫频测量,其中,阻抗扫频测量的时间间隔为1min,持续时间为30min。对相应时间点和检测频率值采集到的阻抗信息进一步用实验室自定义编写的,matlab脚本分析处理,以相对阻抗值变化即细胞指数(cell index,简称ci)表征三维基质中群体细胞随时间的侵袭距离,细胞指数越大表示细胞在三维基质中的侵袭距离越大。细胞指数(ci)根据如下公式计算:
[0063][0064]
其中,n是阻抗测量所设频率点的数目,r
t
(fi)和r0(fi)是t时刻和零时刻导电芯片取决于频率的阻抗值。对接种了40
×
104mcf-7细胞用不同浓度氟维司群处理后诱导群体细胞侵袭的导电芯片进行阻抗扫频测量,使用10khz~100khz频率范围进行扫频,步长为1khz,施加的正弦电压为30mv。其中,结果如图5所示,在相同的时间点,随着氟维司群浓度的增加,细胞指数(ci)逐渐增加;当氟维司群浓度超过一定值时,ci趋于平台稳定期。在浓度为3mg/ml的i型胶原蛋白凝胶中,可测得氟维司群诱导细胞侵袭的半数有效浓度为1.83nmol/l。
[0065]
在本公开实施例中,步骤s7中所述根据阻抗信息进行雌激素受体拮抗剂的定量筛选,具体包括:根据获得的不同频率不同时间点的细胞阻抗值,以相对阻抗值变化表征三维
基质中群体细胞随时间的侵袭距离,进而得到细胞侵袭过程的信息,由此实现拮抗剂药物的定量筛选。
[0066]
在本公开实施例中,通过与阻抗谱仪电连接进行细胞阻抗检测,获取定量的细胞阻抗信息。应用ecis技术检测不同的细胞系会得到不同的细胞增殖图谱,可基于细胞粘附、形态及生长等表型特点进行高通量的药物筛选。应用ecis技术检测不同作用机制的细胞生长抑制剂可获得特征性细胞效应图谱,从而可在大规模筛选中预测药物的作用机制。ecis技术检测的化合物药效特征与传统终点法具有良好的相关性。将某一化合物的细胞效应图谱与诱导凋亡的动力学特点相比,两种分析方法的结果具有良好的一致性,即ecis可为终点法检测提示最优检测时间。ecis技术为化合物筛选提供高通量、长时效的方法,并为不同生物学功能的化合物进行基于作用机制的聚类分析。
[0067]
下面以一活细胞示踪探针荧光标记后进一步通过显微镜表征细胞在三维凝胶基质中侵袭距离的实施例以验证本公开方法的有效性。
[0068]
根据本公开的实施例,对加药作用后的肿瘤细胞用活细胞示踪探针荧光标记,包括:吸除含不同浓度氟维司群的培养基;用磷酸盐缓冲盐溶液清洗细胞2次;轻轻加入37℃预热的探针工作液;于37℃5%co2孵箱条件下孵育45min;换用新鲜含0.5%胚牛血清的培养基继续培养30min,用于后续细胞层上形成适于肿瘤侵袭模型的i型胶原蛋白凝胶。
[0069]
在本公开的实施例中,探针工作液为浓度5-25μmol/l的绿色活细胞示踪探针(cell-tracker green,简称cmfda)溶液。将绿色活细胞示踪探针粉末取出回温至室温,短暂离心以保证粉末落入管底,用10.8μl dmso溶解50μg绿色活细胞示踪探针,充分混匀即得到10mmol/l的储存液。使用前用无血清培养基稀释上述储存液至工作液浓度(5~25μmol/l),并将探针工作液于37℃预热。绿色活细胞示踪探针试剂是可透过活细胞膜自由扩散的荧光氯甲基衍生物。进入细胞后,这些温和的硫醇反应性探针就会与细胞内组分反应,形成可在上样后存活至少24h的荧光细胞,以用于后续三维基质中群体细胞侵袭的追踪。
[0070]
通过激光共聚焦显微镜定量表征细胞在三维凝胶基质中侵袭状况。利用成像软件进行多点层扫模式的共聚焦成像和三维重建,所测细胞在三维凝胶基质中的侵袭距离为z方向上侵袭距离。i型胶原蛋白凝胶成胶3h后加入完全培养基以浸没凝胶,并立即转移至激光共聚焦显微镜的载物台温控装置中,设置成像软件的多点层扫模式。将高通量叉指电极阵列导电芯片表面设为0μm处,每次选取4个不同的(x,y)位点,扫描方向设为向上,以10μm的z间隔捕获图片,扫描间距总长为300μm,其中,激光共聚焦显微镜采用10
×
物镜,488通路进行多点层扫;以及以此时刻为零时刻,共聚焦成像的时间间隔为3h,至少进行3个独立的样本实验。其中,载物台温控装置为mcf-7细胞的培养提供温度为37℃,co2浓度为5%的环境控制。图5-a为10nmol/l氟维司群加药作用的mcf-7细胞在诱导侵袭3h后所对应的侵袭状况,其中,i型胶原蛋白凝胶所采用的单体浓度为3mg/ml。如图5c所示,本公开的细胞阻抗传感系统能完成拮抗剂药物作用后群体细胞在三维基质中迁移和侵袭中的监测应用,从而用于雌激素受体拮抗剂的定量筛选。
[0071]
本公开公开了一种基于细胞侵袭实时追踪的雌激素受体拮抗剂的定量筛选方法。具体而言,本公开以不同浓度氟维司群作用于乳腺癌细胞,制备了适于肿瘤侵袭模型的i型胶原蛋白凝胶,进一步加入趋化因子以诱导群体细胞在三维基质中的侵袭,将具有上述i型胶原蛋白凝胶的导电芯片与阻抗谱仪联用构建细胞阻抗传感检测系统和在线分析系统,实
现了三维基质中拮抗剂药物作用的群体细胞侵袭过程中细胞阻抗信息的实时、无标记监测,从而获得了拮抗剂药物的定量筛选新方法。
[0072]
相比于传统的终点检测法,本公开的这种加药作用后细胞侵袭的实时监测方法,提供了药物作用机理、药物细胞毒性作用的脱靶效应等方面的重要信息。与使用荧光、放射性同位素、发光或光吸收的经典检测方法不同,本公开所使用的无标记检测无需使用标记分子即可直接测量细胞功能,其优点包括简单的均相测定形式,无创测量,对正常细胞功能的干扰较小,动力学测定以及缩短测定开发时间。开发了更有信息性的加药作用后肿瘤细胞侵袭的三维体外分析方法,使药物筛选具有定量性和无标记,这可能推动目前细胞水平药物筛选方法的发展。本公开所公开的基于细胞阻抗传感的拮抗剂药物定量筛选方法,不仅对于细胞水平药物筛选和临床药物毒性检测具有重要的意义,而且拥有重要的商业推广价值,有望在新药筛选、药物安全性评价等方面发挥特点作用,产生良好的社会和经济价值。
[0073]
以上对本公开的实施例进行了描述。但是,这些实施例仅仅是为了说明的目的,而并非为了限制本公开的范围。尽管在以上分别描述了各实施例,但是这并不意味着各个实施例中的措施不能有利地结合使用。本公开的范围由所附权利要求及其等同物限定。不脱离本公开的范围,本领域技术人员可以做出多种替代和修改,这些替代和修改都应落在本公开的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1