一种培养基及生产抗CGRPR抗体的方法与流程
一种培养基及生产抗cgrpr抗体的方法
技术领域
1.本发明属于生物技术领域,具体地涉及一种培养基及利用其生产抗cgrpr抗体的方法。
背景技术:
2.由于单克隆抗体复杂的分子结构和较大的分子量,其在生产和储存过程中可产生大量的修饰,使得抗体产生多种异构体,这些异构体的组合导致了单克隆抗体的电荷异质性、糖基化修饰异质性等。糖基化水平和糖基化修饰类型是单抗药物的重要参数,而目前改变抗体糖基化方法主要在基因水平来改变抗体糖型或糖基化水平,这种方法耗费时间且安全性和稳定性缺乏保障。电荷异质性是单抗生产工艺中重要的质量属性,电荷异质性会产生酸碱峰,尤其是酸峰严重影响单抗的稳定性及生物学功能,进而影响其组织渗透性和药代动力学。而通过控制细胞工艺流程来控制抗体电荷异质性和优化抗体糖型具有很大的挑战性。
3.降钙素基因相关肽(calcitonin gene-related peptide,cgrp)是一种在偏头痛发生过程中起重要作用的神经递质。可通过阻断cgrp或其受体治疗和预防偏头痛发作,因此cgrp也是目前治疗偏头痛的热门靶点,由此开发出治疗用的小分子cgrp受体拮抗剂和预防用的cgrp单克隆抗体。其中厄瑞努单抗(erenumab)是一种针对和阻断典型cgrp受体的有效单克隆抗体。多项临床试验证明了erenumab对发作性偏头痛(em)和慢性偏头痛(cm)的预防效果和良好耐受性。
4.然而尚未有技术方案提供优化制备厄瑞努单抗的方法。
技术实现要素:
5.为解决现有技术中缺乏优化制备抗cgrpr抗体的有效方法的问题,本发明提供一种培养基及利用其生产抗cgrpr抗体的方法。本发明的方法通过控制细胞工艺流程调节抗体的电荷异质性并优化抗体的糖型,生产出与原研药物质量类似的厄瑞奴单抗erenumab。
6.为了实现上述目的:
7.本发明第一方面提供一种生产抗cgrpr抗体的方法,所述方法在发酵培养基中培养可表达所述抗cgrpr抗体的细胞,在所述发酵培养基中添加组氨酸和含半乳糖的糖型调节剂,并在发酵过程中通过补料加入含甘露糖的补料培养基。
8.本发明一些实施方案中,所述方法包括以下一种或多种条件:
9.(1)所述抗cgrpr抗体为厄瑞奴单抗;
10.(2)所述组氨酸的浓度为2g/l;
11.(3)所述甘露糖的浓度为50g/l;
12.(4)所述糖型调节剂的浓度为2%;和/或,所述糖型调节剂还包括锰离子和/或尿苷;其中%为体积百分比;
13.(5)所述方法中总葡萄糖不足3g/l时补到4~6g/l。
14.本发明一些实施方案中,所述细胞为cho细胞,优选所述cho细胞选自cho-k1、cho dg44和cho-s细胞,更优选为cho-k1细胞。
15.本发明一些实施方案中,所述发酵培养基选自opm-cho cd063 dpm(奥浦迈)、opm cd07 dpm(奥浦迈)、dynamis(gibco)、actipro(hyclone)和cho maxd(迈邦)中的一种或多种。
16.本发明一些实施方案中,所述补料为从第3天起每隔一天补料一次;和/或,所述补料培养基选自xf01 dpm、cdfs06、efficientfeed
tm c+、hyclone
tm cell boost
tm 7a、hyclone
tm cell boost
tm 7b、max fa和max fb中的一种或多种;和/或,在第11天补加0.5%所述糖型调节剂。
17.本发明一些具体的实施方案中,所述补料培养基中包括50g/l甘露糖;
18.较佳地,所述补料培养基为xf01 dpm或cdfs06。
19.本发明一些实施方案中,所述xf01 dpm每次补料的量为4%,所述cdfs06每次补料的量为0.4%,其中%为体积百分比。
20.本发明一些实施方案中,所述方法包括以下一种或多种条件:
21.(a)所述发酵的温度为:第1~6天为37℃,并在第7天起降至32~33℃;
22.(b)所述发酵的ph为7.0
±
0.2,优选6.9
±
0.1;
23.(c)所述发酵的时间为15~16天;
24.(d)发酵时,do为40%,空气流量为1.2l/h。
25.本发明一些实施方案中,所述方法包括以下一种或多种条件:
26.(i)摇瓶种子扩增时二氧化碳浓度为5%;
27.(ii)摇床转速为130rpm;
28.(iii)温度为37℃;
29.(iv)接种密度为0.5~1.0
×
106cells/ml。
30.本发明一些具体的实施方案中,还包括wave种子扩增,所述wave种子扩增包括以下一种或多种条件:
31.1)wave种子扩增时ph在6.7~7.2;
32.2)温度为37℃;
33.3)种子扩增第一阶段转速为15rpm,第二阶段转速为20rpm;
34.4)种子扩增第一阶段接种密度为0.5~1.0
×
106cells/ml,第二阶段接种密度为1.0~2.0
×
106cells/ml。
35.本发明第二方面提供一种用于生产抗cgrpr抗体的培养基,所述培养基包括发酵细胞的培养基、2g/l组氨酸、2%含半乳糖的糖型调节剂和50g/l甘露糖;其中,
36.所述细胞优选cho细胞,更优选地选自cho-k1、cho dg44和cho-s细胞。
37.本发明一些具体的实施方案中,所述发酵细胞的培养基为opm-cho cd063 dpm,和/或,所述糖型调节剂还包括半乳糖、锰离子和/或尿苷,例如所述糖型调节剂为s081912-001;和/或,所述抗cgrpr抗体为厄瑞奴单抗;其中%为体积百分比。
38.本发明第三方面提供一种用于生产cgrpr抗体的试剂盒,所述试剂盒包括发酵细胞的培养基,单独的糖型调节剂、组氨酸和甘露糖;其中,
39.所述细胞优选为cho细胞,更优选cho细胞选自cho-k1、cho dg44和cho-s细胞。
40.本发明一些具体的实施方案中,所述发酵细胞的培养基为opm-cho cd063 dpm;和/或,所述糖型调节剂还包括锰离子和/或尿苷,例如所述糖型调节剂为s081912-001;和/或,所述抗cgrpr抗体为厄瑞奴单抗;其中%为体积百分比。
41.本发明第四方面提供根据第二方面所述的培养基和第三方面所述的试剂盒在生产cgrpr抗体中的应用。
42.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
43.本发明所用试剂和原料均市售可得。
44.本发明的积极进步效果在于:
45.本发明提供的生产抗cgrpr抗体的方法,可有效控制抗体电荷异质性并优化抗体糖型,通过控制细胞工艺流程有效降低抗体的酸性峰,提高抗体的碱性峰,同时优化高甘露糖和g0f等糖型。本发明方法生产抗cgrpr抗体多种参数均与原研药物类似,提供了质量可靠的生物类似药。
附图说明
46.图1为不同ph和温度培养细胞时抗体电荷异质性对比图。工艺1:ph为7.0
±
0.2,第7天降温至33℃;工艺2:ph为7.0
±
0.2,第7天降温至32℃;工艺3:ph为6.9
±
0.05,第7天降温至32℃;工艺4:ph为6.9
±
0.05,第7天降温至34℃。
47.图2a和图2b为组氨酸、甘露糖和糖型调节剂对抗体电荷异质性和糖基化的影响。其中图2a为抗体电荷异质性对比图;图2b为抗体糖基化对比图。工艺1:基础培养基+2g/l组氨酸+2%糖型调节剂,xf01 dpm无甘露糖,d11补0.5%糖型调节剂;工艺2:基础培养基+2g/l组氨酸+2%糖型调节剂,xf01 dpm含50g/l甘露糖,d11补0.5%糖型调节剂。
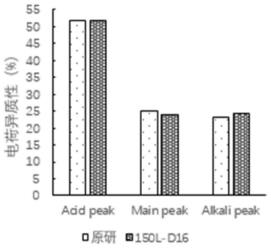
48.图3a和图3b为150l细胞罐细胞培养工艺的应用。其中图3a抗体电荷异质性对比图;图3b为抗体糖基化对比图。工艺1:基础培养基+2g/l组氨酸+2%糖型调节剂,xf01 dpm无甘露糖,d11补0.5%糖型调节剂;工艺2:基础培养基+2g/l组氨酸+2%糖型调节剂,xf01 dpm含50g/l甘露糖,d11补0.5%糖型调节剂。
具体实施方式
49.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
50.表1:实验物料
[0051][0052][0053]
表2:实验仪器
[0054]
实验仪器型号厂家四联罐dasgip 3.8l艾本德150l细胞罐150pronbs二氧化碳摇床zczy-bs8es知楚细胞计数仪ic1000countstar生物安全柜bsc-1300iia2苏静安泰血气分析仪500西门子渗透压仪smc 30c-1天津天河灭菌柜xg0.6g山东新华
[0055]
用流动相a将供试品稀释至1mg/ml,用高效液相色谱仪u3000进行检测,其色谱条件如下:
[0056]
表3:电荷变异体检测
[0057]
名称参数液相色谱仪thermo高效液相色谱仪u3000色谱柱thermo cex-mabpac scx-10 4*250mm,10μm检测波长检测波长215nm流速0.6ml/min,梯度洗脱(详见下表)上样体积75μl(共计75μg)采集时间70min柱温40℃样品盘温度20℃
[0058]
抗体经过变性处理后,用安捷伦的n糖试剂盒衍生,洗涤收集样品,将样品与乙腈按3:7混合用uplc检测,其色谱条件如下:
[0059]
表4:糖型检测
[0060][0061][0062]
实施例1 3.8l细胞罐培养
[0063]
1.细胞复苏及扩增
[0064]
从液氮罐中取出冻存细胞37℃水浴解冻,将解冻后的冻存液转入装有5ml基础培养基的离心管中,充分混匀,1000r/min离心5min,弃去上清。将细胞沉淀重新悬浮于5ml基础培养基中,以0.30
×
106个/ml的密度接种于装有25ml cd063液体培养基的125ml三角瓶中。将三角瓶置co2摇床中培养,co2浓度、温度和转速分别为5%、37℃和130rpm。每三天对摇瓶中的细胞计数一次,按0.5
×
106个/ml的密度接种至新鲜cd063液体培养基中,逐级传代扩增直至总细胞数达到接种细胞罐的要求。
[0065]
2.3.8l细胞罐发酵
[0066]
表5:3.8l细胞罐发酵工艺
[0067][0068][0069]
本发明技术方案选择降低温度和ph值来降低抗体酸性峰:
[0070]
表6:降低酸性峰的细胞培养工艺
[0071]
工艺1234(对照)温度d7降温至33℃d 7降温至32℃d 7降温至32℃d 7降温至34℃ph7.0
±
0.27.0
±
0.26.9
±
0.056.9
±
0.05
[0072]
表7:不同温度和ph培养细胞时抗体的电荷变体情况
[0073][0074]
由表7和图1可知,相比于对照组,更低的培养温度(33℃、32℃)可以降低酸性峰,提高主峰和碱峰,而同一培养温度下(32℃),更低的ph控制(6.9
±
0.05)也可以获得更低的酸性峰,这与理论是一致的。因此结合以上数据,我们选择d7降温至32℃,ph控制6.9
±
0.1(考虑ph控制在6.9
±
0.05,会导致中试放大二氧化碳分压过高,因此稍放宽至6.9
±
0.1)。
[0075]
本发明技术方案选择在基础培养基中添加2g/l组氨酸用于提升碱峰,在补料中添加50g/l甘露糖用于提升man5,在基础培养基中添加2%的糖型调节剂并在d11补加0.5%的
糖型调节剂用于降低g0f,同时以不加甘露糖的组合作为对照,验证甘露糖的作用,具体方案见下表。
[0076]
表8:提高抗体碱性峰和优化糖型的工艺
[0077]
工艺组氨酸甘露糖糖型调节剂12g/l/d11,0.5%22g/l50g/ld11,0.5%
[0078]
表9:组氨酸、甘露糖和糖型调节剂对抗体电荷异质性和糖基化的影响
[0079][0080]
如表9、图2a和图2b所示,组氨酸提升碱峰的作用非常明显,酸峰都略低于原研,有利于后续纯化工艺导致的酸峰上升而正好与原研接近。本次实验也可以看出,在补料中加入50g/l的甘露糖比对照(不加甘露糖)明显能提升man5。同时从不同的发酵时间也能看出,随着发酵时间的延长,特别是培养超过14天后,man5会有大幅提升,再次印证了延长发酵时间至15-16天,也有利于man5提升。
[0081]
实施例2 150l细胞罐培养
[0082]
150l细胞罐培养方案如下表所示,其中摇瓶种子经过30ml-120ml-600ml三级放大,wave种子经过3.5-8.5l两级放大后,接种至150l细胞罐,进行细胞发酵。
[0083]
表10:150l细胞罐细胞培养工艺
[0084]
[0085][0086]
1.细胞复苏及扩增
[0087]
从液氮罐中取出冻存细胞37℃水浴解冻,将解冻后的冻存液转入装有5ml基础培养基的离心管中,充分混匀,1000r/min离心5min,弃去上清。将细胞沉淀重新悬浮于5ml基础培养基中,以0.30
×
106个/ml的密度接种于装有25ml cd063液体培养基的125ml三角瓶中。将三角瓶置co2摇床中培养,co2浓度、温度和转速分别为5%、37℃和130rpm。每三天对摇瓶中的细胞计数一次,按0.5
×
106个/ml的密度接种至新鲜cd063液体培养基中,逐级传代扩增直至总细胞数达到接种细胞罐的要求。
[0088]
2.wave种子培养
[0089]
取扩增的摇瓶细胞计数,要求细胞密度满足4~8
×
106cells/ml,满足要求则将种子液接种至装有3l cd063液体培养基的wave反应袋(接种密度要求(0.8
±
0.2)
×
106cells/ml)。设置wave反应器培养条件:37℃,通气量0.2l/min,转速15rpm,角度8
°
,培养2~3天。通过co2控制ph在6.7~7.2之间。取wave第一阶段细胞种子计数,要求细胞密度>3.0
×
106cells/ml,满足要求则将5l opm-cho cd063 dpm泵入反应袋中,保证第二阶段初始接种密度为1~2
×
106cells/ml。设置wave反应器培养条件:37℃,通气量0.2l/min,转速20rpm,角度8
°
,通过o2控制溶氧40%,co2控制ph在6.7~7.2之间培养2~3天直至活细胞密度达到5.0
×
106cells/ml。
[0090]
3.150l细胞罐培养
[0091]
如表11、图3a和图3b所示,电荷变异体和糖型都与原研较为接近,因此本项目基本
可以确定,通过在基础培养基中添加2g/l的组氨酸用于调节电荷变异体,通过在基础培养基中添加2%糖型调节剂,并在d11补加0.5%糖型调节剂用于半乳糖比例调节,在xf01 dpm中添加50g/l的甘露糖用于man5的调节,截至目前,以此组合进行细胞培养产生的抗体在糖型上与原研最为相似,在电荷异构体方面最符合工艺需求。
[0092]
表11:150l细胞罐细胞培养工艺的应用
[0093]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1