一种深海链霉菌及其拒食与抗真菌活性物质的制备和应用
1.本发明涉及微生物农药技术领域,具体为一种具有拒食功能和抗菌作用的深海链霉菌及其应用。
背景技术:
2.放线菌在自然界中分布十分广阔,它们能产生具有多种生物功能的代谢产物。值得注意的是,大约76%市售的抗生素原始分子结构骨架都来源于放线菌属,其中以开发程度较高的链霉菌属最为突出(journal of industrial microbiology biotechnology,2014,41(2):425-431)。2019年,据李德海教授团队报道链霉菌贡献了放线菌产生新活性次级代谢产物总数的54%(current medicinal chemistry,2020,27(36):6244-6273)。更有意思的是,朱伟明教授团队统计发现67.3%的深海链霉菌天然产物表现出生物活性,如细胞毒、抑菌、抗疟等(海洋科学集刊,2016,51:86-124)。
3.长期大量使用有机合成杀虫剂导致害虫产生抗药性,引发严重的环境污染、农产品安全等问题(science,2002,297:2222-2223)。随着绿色防治理念深入人心,人们也在不断探索更加安全环保的害虫防治方法。防治害虫的目的是有效控制危害,并非只有杀死害虫唯一手段。通过拒食(或驱避)方式防虫,也可实现有效的保护。因此,昆虫拒食剂成为有机杀虫剂的重要替代。棉铃虫(helicoverpa armigera)是世界性广布害虫,对棉花、非洲水稻、玉米等粮食作物危害严重,其取食农作物幼嫩生长点和繁殖器官,幼虫钻蛀,啃食花蕾(北方园艺,2020,20:27-33)。现阶段对棉铃虫主要采用化学农药进行防治,但是棉铃虫已对化学农药产生抗性,而且化学农药降解速度慢并残留。因此,开发和应用绿色高效、环境友好型天然源拒食剂已吸引了广大学者的注意。
4.植物真菌病害发病率高,范围广,其发生造成农产品产量和品质下降,严重影响了农业产业的发展和安全性。例如苹果腐烂病是顽固的弱寄主寄生式真菌苹果黑腐皮壳菌(valsa ceratosperma)所引起的病害,又称烂皮病(现代农业科技,2008,23:147-147)。苹果腐烂病菌有潜伏侵染的特点,即当果树健康时,病菌可保持潜伏状态,不易对宿主扩大致病;当侵染点周围组织死亡,寄主生命力弱时病原菌可扩展致病。该病主要发生在成龄果园,造成苹果产量下降和经济损失。目前,我国已普遍进入了苹果腐烂病的高发期,成龄果园有80%左右发生了腐烂病(王宝君,2017,安徽农业大学硕士毕业论文)。苹果腐烂病已成为我国苹果树上的重要病害之一,长期困扰着果农,严重制约了苹果的产量,造成严重的经济损失,已成为限制我国苹果生产和出口的重要病害。
5.目前商品化的杀真菌剂品种较多,随着传统杀菌剂的长期使用,植物病原菌出现耐药性、抗药性等问题,同时农药残留、环境污染等问题有待解决(environmental science&technology,2019,53(7):3347-3365)。因此,开发作用机制新颖、杀菌谱广、抗性风险低的杀菌剂是目前杀菌剂创制的重点。
a7a(6)可作为拒食剂或抗真菌药物先导化合物。
19.所述真菌为
20.苹果树腐烂病菌valsa mali f68-1
21.尖镰孢霉冬瓜专化型fusarium oxysporum f.sp.cucurmerimum s19
22.本发明所具有的优点:
23.1.本发明所得菌株na13具有独特性,它生存环境特殊,来自于南海深海沉积物,而且通过全基因组测序,生物信息学分析可知,其基因组中含有合成产生antimycin等25种骨架类型化合物的基因簇,具有产生多样活性物质的潜能。
24.2.本发明菌株na13能同时制备抗霉素类化合物antimycin或环八肽surugamide类化合物;其中抗霉素类antimycin a1a(2)、antimycin a2a(3)、antimycin a3a(4)、antimycin a4a(5)、antimycin a7a(6)的拒食功能和抗植物病原菌活性为首次发明。
25.3.本发明通过菌株na13代谢产物制备获得抗霉素类antimycin q,该化合物为首次发现的新化合物,制备的抗霉素类物质作为虫害拒食剂或抗真菌药物先导化合物,具有开发成天然来源的抗菌、抗虫农药等应用前景。
附图说明
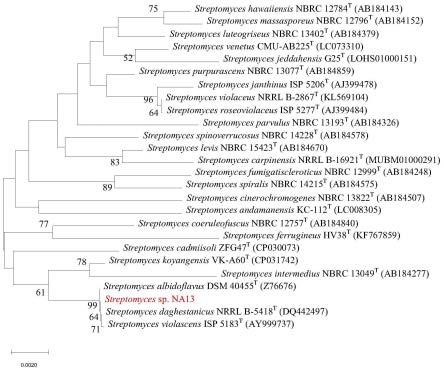
26.图1为本发明提供基于16s rdna序列的系统进化树显示na13分类学地位。
27.图2为本发明提供菌株na13在isp3发酵培养基中产生的抗霉素类化合物次级代谢产物。
28.图3为本发明提供利用菌株na13获得的化合物1-11的化学结构。
29.图4为本发明提供利用菌株na13获得的antimycin q(1)的hresims谱。
30.图5为本发明提供利用菌株na13获得的antimycin q(1)的1h-1
hcosy和hmbc的重要相关。
31.图6为本发明提供利用菌株na13获得的antimycin q(1)在ch3oh中的实验ecd光谱、计算ecd光谱。
32.图7为抗霉素类化合物1-6对棉铃虫的拒食活性。
具体实施方式
33.为了更好的理解本发明的内容,下面结合具体实施例作进一步说明,但本专利的保护内容不仅限于此。
34.实施例1深海链霉菌na13的鉴定和特征
35.菌株na13分离自中国南海深海沉积物(e 113
°
2.353
′
,n 13
°
58.498
′
),于2022年8月29日保藏于中国典型培养物保藏中心,保藏编号:cctcc m20221343。该菌在isp3和isp4培养基上生长旺盛,在isp2和高氏一号培养基生长一般。形成圆形菌落,无色素产生(表1)。
36.表1深海链霉菌na13的生长特征
37.培养基生长情况气生菌丝基内菌丝可溶性色素isp2生长一般乳黄色肉色无isp3生长旺盛淡黄色肉色无isp4生长旺盛乳白色肉色无
高氏一号生长一般淡黄色肉色无
38.将链霉菌na13接种于isp3液体培养基中,28℃培养36h后按照常规方法提取总dna。然后采用全基因组鸟枪法(whole genome shotgun,wgs)策略,利用第二代测序技术(next generation sequencing,ngs),基于illumina novaseq测序平台,同时利用第三代单分子测序技术,基于oxford nanopore ont测序平台进行测序,获得菌株na13的基因组完成图,线性染色体基因组大小约6.91mb,gc content为73.44%,含有一个线性质粒,大小约186.13kb,gc content为68.83%。对其16s rrna基因序列进行blast分析,发现其与三个不同种的标准菌株s.daghestanicus nrrl b-5418
t
、s.albidoflavus dsm 40455
t
和s.violascens isp 5183
t
序列同源性高达100%。进一步基于16s rdna序列构建的系统进化树显示,这些菌株聚类在同一分支(图1),显示出它们具有最亲密的遗传进化关系。最后计算基因组的平均核苷酸一致性(average nucleotide identity,ani)值显示链霉菌na13与s.albidoflavus dsm 40455
t
的ani达到98.7%,说明它们是一个种。因此将菌株na13鉴定为微白黄链霉菌(streptomyces albidoflavus)。
39.其中,微白黄链霉菌na13的16s rrna基因序列16s rdna为:
40.》streptomyces albidoflavus na13 16s rdna
41.acggagagtttgatcctggctcaggacgaacgctggcggcgtgcttaacacatgcaagtcgaacgatgaaccgctttcgggcggggattagtggcgaacgggtgagtaacacgtgggcaatctgccctgcactctgggacaagccctggaaacggggtctaataccggatatgactgtccatcgcatggtggatggtgtaaagctccggcggtgcaggatgagcccgcggcctatcagcttgttggtgaggtagtggctcaccaaggcgacgacgggtagccggcctgagagggcgaccggccacactgggactgagacacggcccagactcctacgggaggcagcagtggggaatattgcacaatgggcgaaagcctgatgcagcgacgccgcgtgagggatgacggccttcgggttgtaaacctctttcagcagggaagaagcgaaagtgacggtacctgcagaagaagcgccggctaactacgtgccagcagccgcggtaatacgtagggcgcaagcgttgtccggaattattgggcgtaaagagctcgtaggcggcttgtcacgtcggttgtgaaagcccggggcttaaccccgggtctgcagtcgatacgggcaggctagagttcggtaggggagatcggaattcctggtgtagcggtgaaatgcgcagatatcaggaggaacaccggtggcgaaggcggatctctgggccgatactgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtccacgccgtaaacggtgggcactaggtgtgggcaacattccacgttgtccgtgccgcagctaacgcattaagtgccccgcctggggagtacggccgcaaggctaaaactcaaaggaattgacgggggcccgcacaagcggcggagcatgtggcttaattcgacgcaacgcgaagaaccttaccaaggcttgacatacaccggaaacgtctggagacaggcgcccccttgtggtcggtgtacaggtggtgcatggctgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgtcccgtgttgccagcaggcccttgtggtgctggggactcacgggagaccgccggggtcaactcggaggaaggtggggacgacgtcaagtcatcatgccccttatgtcttgggctgcacacgtgctacaatggccggtacaatgagctgcgataccgcgaggtggagcgaatctcaaaaagccggtctcagttcggattggggtctgcaactcgaccccatgaagtcggagtcgctagtaatcgcagatcagcattgctgcggtgaatacgttcccgggccttgtacacaccgcccgtcacgtcacgaaagtcggtaacacccgaagccggtggcccaaccccttgtgggagggagctgtcgaaggtgggactggcgattgggacgaagtcgtaacaaggtagccgtaccggaaggtgcggctggatcacctccttt
42.使用antismash分析和手动矫正发现菌株na13蕴含有25个次级代谢产物基因簇,具有编码产生antimycin、candicidin、naringenin、isorenieratene、indigoidine-like、ectoine、desferrioxamine b、surugamide a、fredericamycin a、sal-2242、albaflavenone、hopene、sgr ptms、diisonitrile antibiotic sf2768骨架化合物的潜能,
以及合成多种新颖pks、ripp-like、nrps、terpene和siderophore等类化合物的潜能(表2)。说明na13具有制备表中所述类型化合物的能力。
43.表2菌株na13合成多样次级代谢产物的潜能
[0044][0045]
实施例2深海链霉菌na13生产多种类型生物活性物质和制备方法
[0046]
链霉菌na13使用isp3培养基发酵制备获得了一系列抗霉素类和环八肽类等类型的次级代谢活性产物(图2);具体为:
[0047]
将深海链霉菌na13接种于isp3固体培养基上培养72h活化,然后接种于isp3液体培养基,28℃培养72h作为种子液;再将发酵种子液按照体积比1:18接种于相同的发酵培养基,28℃振荡培养7天。将发酵液离心获得菌体,用丁酮超声30-50min萃取菌体中活性成分,回收丁酮溶剂后得的粗提物a,即为深海链霉菌na13代谢产物。将粗提物a,采用快速硅胶柱色谱法分离,按照二氯甲烷:甲醇(v/v)比为100:0-0:100梯度洗脱,获得7个流分(f
a-fg)。将100:1洗脱的流份fb经凝胶lh20除杂,采用半制备反相hplc,经85%的甲醇水溶液洗脱,流速为3.0ml/min,获得化合物antimycin q(化合物1)(5.7mg,tr:18.5min)、antimycin a1a(2)(6.4mg,tr:20.2min)、antimycin a2a(3)(8.0mg,tr:15.8min)、antimycin a3a(4)
111.30,d.(6.7)15.2,ch
31′ꢀ
114.3,c2
′ꢀ
150.6,c3
′ꢀ
126.9,c4
′
8.23,d,(7.9)125.0,ch5
′
6.91,t,(8.0)118.3,ch6
′
7.85,d,(8.1)123.1,ch7
′ꢀ
169.7,c8
′
8.31,d,(1.8)160.4,c1
″
1.46,m;1.30,m25.5,ch22
″
1.22,m33.5,ch23
″
1.18,m32.8,ch4
″
1.18,m28.6,ch25
″
0.78,m11.1,ch36
″
0.78,m18.7,ch
31″′ꢀ
174.9,c2
″′
2.45,m39.5,ch3
″′
1.63,m;1.46,m25.9,ch24
″′
0.86,t,(7.4)11.4,ch35
″′
1.12,d,(7.2)16.6,ch
32′‑
oh12.74,br s 3-nh9.33,br s 3
′‑
nh9.81,s [0051]
其他的已知化合物antimycin a1a(2)、antimycin a2a(3)、antimycin a3a(4)、antimycin a4a(5)、antimycin a7a(6)、n-formylantimycic acid methyl ester(7)、surugamide a(8)、surugamide b(9)、surugamide d(10)、surugamide e(11)(图3)均由1d nmr光谱和旋光等数据比较报道相关文献确定。
[0052]
实施例3抗霉素类化合物拒食功能活性测定
[0053]
测定方法:选取棉铃虫(helicoverpa armigera)进行拒食功能评价。测定方法:先用打孔器将厚度均匀、干净新鲜的小白菜(brassica chinensis)叶片打成直径为1cm的圆形小叶碟,处理组取供试化合物溶液(单体化合物(化合物1-6)三个不同浓度分别为1、0.5、0.25mg/ml)50μl均匀涂于叶片背面,空白对照组涂相同体积的甲醇溶液,待叶碟自然晾干后,放入预先垫有滤纸保湿的培养皿(直径9cm)中,每个培养皿中放入2片处理叶碟和2片对照叶碟,十字交叉放置。每个培养皿接入2只饥饿12h的三龄棉铃虫,并将培养皿放入25℃光照培养箱中,以高浓度中对照被取食80%左右时间为截止时间,用坐标方格纸测量每片叶碟被取食的面积。实验重复至少5次以上。计算拒食率:拒食率(%)=(ac-at)/(ac+at)
×
100%,其中,ac、at分别表示空白对照组和样品处理组叶碟被取食的面积。
[0054]
实验结果:na13粗提物在5mg/ml时表现出显著的拒食活性(ai=83.33%)。从图7中可以看出,本发明所提及的抗霉素类化合物1-6对棉铃虫均具有不同程度的拒食活性。特
别是化合1-4在1mg/ml时的拒食活性(ai=87.83%、88.46%、89.86%、90.79%);可初步推断抗霉素类母核九元双内酯环结构为该活性必要基团。
[0055]
实施例4抗霉素类化合物抗真菌活性测定
[0056]
选取苹果树腐烂病菌valsa mali f68-1和尖镰孢霉冬瓜专化型菌fusarium oxysporum f.sp.cucurmerimum s19作为抗真菌活性评价的菌株。
[0057]
测定方法:将病原真菌采用挖块法接种到psa平板的中央,置于28℃的恒温培养箱中,培养2-3d,待菌落直径4cm左右时,在平板上对称放置添加10μl供试品溶液(256、128、64、32、16、8、4、2、1、0.5和0.25μg/ml)的滤纸片。阴性对照为甲醇溶液,阳性对照为制霉菌素。将平板置于28℃的恒温培养箱中培养2d。肉眼可观察到的无菌生长的最低供试品浓度作为最低抑菌浓度(minimal inhibitory concentration,mic),每个试验重复三次。
[0058]
实验结果:测试结果显示分离得到的抗霉素类化合物1-6均不同程度的展现了对2种病原真菌的抑制活性,但活性微弱。化合物7对2种病原真菌无抑制活性(表4)。
[0059]
表4化合物1-7抗真菌活性
[0060]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1