一种萜类化合物及其提取方法和应用
1.本发明涉及农业废物转化领域,尤其涉及一种从农业废物中提取的萜类化合物及其提取方法和应用。
背景技术:
2.山茶属是山茶科的重要经济和系统发育成员。中国、日本和亚洲热带和亚热带地区广泛分布着300多种茶花。国内已经培育了几种茶花品种,并培育了许多品种,以满足日益增长的需求,将其用作生产流行商业产品的原料,包括促进健康的茶叶成分、园艺艳丽的花朵以及优质食用油。由于其营养价值和经济价值高,油茶被认为是油茶品种中具有最高生产价值的。这种小型多年生树木在中国已经栽培和利用了2000多年,也是世界四大木本油料植物之一。在食品和化妆品行业,油菜籽主要用于生产纯天然食用油。联合国粮食及农业组织(fao)推荐它为优质健康的植物油,因为它富含不皂化成分,如甾醇、脂肪醇和生育酚。油茶油的药用价值也非常重要。长期以来,这种油在民间医学中被用来治疗胃肠道疼痛和皮肤灼伤。现代化学和药理学研究表明,该油及其主要成分包括皂甙、多酚、不饱和脂肪酸和角鲨烯,这些物质具有广泛的生物功能,如抗肿瘤、抗氧化、抗炎、抗菌、抗血栓和肝脏保护活性。
3.油茶籽饼(简称油茶籽饼)是从油茶籽中提取茶油的残余副产品。尽管油饼占种子总质量的80%,但在榨油后,油饼要么被烧毁,要么被丢弃,这是对有机资源的巨大浪费。充分开发茶花籽饼的潜在价值,不仅可以产生经济价值,而且可以防止空气、水或土壤污染。皂甙是油茶籽饼中最重要的成分,约占重量的15%-20%。从油茶籽饼中已鉴定出30多种皂甙,还有新的皂甙不断被分离和鉴定,这些皂甙中许多在人类癌细胞系中具有很好的细胞毒性。
4.有鉴于此,为了充分利用油茶籽饼资源,有必要从中进一步鉴别分离出抗癌效果更好的物质,而推动对这种废弃物进行再利用。
技术实现要素:
5.本发明的第一个目的在于提供一种萜类化合物。
6.本发明的第二个目的在于提供一种萜类化合物的提取方法。
7.本发明的第二个目的在于提供一种萜类化合物的应用。
8.为实现上述目的,本发明采用以下技术手段:
9.一种萜类化合物,其特征在于:
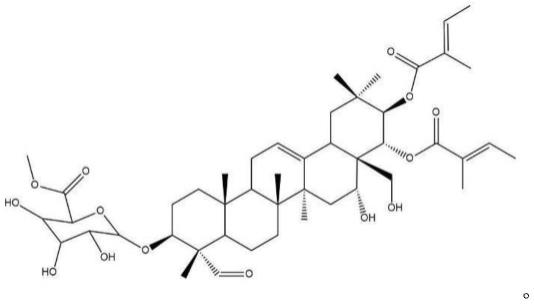
10.所述萜类化合物具有如下结构;
[0011][0012]
所述的萜类化合物的提取方法,包括如下步骤:
[0013]
将山茶籽饼磨成粉末,采用第一有机溶剂进行回流ⅰ;
[0014]
然后采用第二有机溶剂提取出粗提物;
[0015]
采用大孔树脂柱对粗提物进行洗脱ⅰ后减压浓缩,得到总皂苷;
[0016]
将总皂苷回流ⅱ后中和后采用酯类化合物萃取,取酯类化合物层,得到苷元提取物;
[0017]
将苷元提取物进行洗脱ⅲ后采用半制备色谱进行纯化,即得。
[0018]
所述第一有机物包括石油醚;
[0019]
所述回流ⅰ的时间为2小时;
[0020]
所述提取的次数为三次;
[0021]
所述第二有机物包括乙醇;
[0022]
所述大孔树脂包括ab-8;
[0023]
所述洗脱ⅰ包括采用naoh溶液洗脱的步骤;
[0024]
所述洗脱ⅰ包括采用甲醇水溶液洗脱的步骤。
[0025]
所述中和采用的溶液包括naoh溶液。
[0026]
所述酯类化合物包括乙酸乙酯。
[0027]
所述洗脱ⅲ包括采用重量比为30:1-1:1的石油醚乙酸乙酯溶洗脱的步骤;
[0028]
所述纯化包括mecn水溶液洗脱的步骤;
[0029]
所述mecn水溶液中mecn和水的体积比为70:30。
[0030]
所述萜类化合物的应用,应用于制备治疗癌症的药物。
[0031]
所述治疗癌症的药物包括nrf2抑制剂。
[0032]
所述治疗癌症的药物包括可降低p-stat3/stat3的表达水平的药物;或者
[0033]
所述治疗癌症的药物包括可减弱抗凋亡蛋白bcl-2并且降低bcl-2/bax比值的药物;或者
[0034]
所述治疗癌症的药物包括可下调β-catenin并且可上调caspase-3和tnf-α的药物。
[0035]
相比于现有技术,本发明带来以下技术效果:
[0036]
本发明提供的萜类化合物可以减弱抗凋亡蛋白bcl-2,降低bcl-2/bax比值。
[0037]
本发明提供的萜类化合物可通过下调β-catenin和上调caspase-3和tnf-α来促进细胞凋亡。
[0038]
本发明提供的萜类化合物是一种nrf2抑制剂。
附图说明
[0039]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0040]
图1示出了c1的正离子hr-esi
–
ms光谱图。
[0041]
图2示出了c1的1h nmr图谱。
[0042]
图3示出了c1的
13
c nmr图谱。
[0043]
图4示出了c1(溶剂为cdcl4)的1h 1h cosy图谱。
[0044]
图5示出了c1(溶剂为cdcl4)的hsqc图谱。
[0045]
图6示出了c1(溶剂为cdcl4)的hmbc图谱。
[0046]
图7示出了c1的noesy图谱。
[0047]
图8示出了c2的1h nmr图谱。
[0048]
图9示出了c2的13c nmr图谱。
[0049]
图10示出了c2的1h 1h cosy图谱。
[0050]
图11示出了c2的hsqc图谱。
[0051]
图12示出了c2的hmbc图谱。
[0052]
图13示出了c2的noesy图谱。
[0053]
图14示出了c3的1h nmr图谱。
[0054]
图15示出了c3的13c nmr图谱。
[0055]
图16示出了c3的1h 1h cosy图谱。
[0056]
图17示出了c3的hsqc图谱。
[0057]
图18示出了c3的hmbc图谱。
[0058]
图19示出了c3的noesy图谱。
[0059]
图20示出了c4的hresim图谱。
[0060]
图21示出了c4的1h nmr图谱。
[0061]
图22示出了c4的13c nmr图谱。
[0062]
图23示出了c4的1h 1h cosy图谱。
[0063]
图24示出了c4的hsqc图谱。
[0064]
图25示出了c4的hmbc图谱。
[0065]
图26示出了c4的noesy图谱。
[0066]
图27示出了c3和4对三种典型肿瘤细胞系活性的影响示意图。其中图27(a)示出了钙调素am/pi法用于检测c3和4在a549细胞中的细胞毒性得到的图谱;图27(b)示出了c3通过上调bax促进凋亡,c4通过下调p-stat3和bcl-2促进a549细胞凋亡。图27(c)示出了钙调素am/pi法用于检测c3和4在u251细胞中的细胞毒性。图27(d)示出了c3通过下调p-mtor和p-stat3来促进凋亡,c4通过下调u251细胞中的p-stat3和bcl-2来促进凋亡。图27(e)示出了钙调素am/pi法用于检测c3和4在pan02细胞中的细胞毒性。图27(f)示出了c3和4通过下调pan02细胞中的p-mtor、p-stat3和bcl-2来促进细胞凋亡。
[0067]
图28示出了流式细胞术观察c4对hepg2细胞凋亡的影响。。
[0068]
图29示出了c4对hepg2细胞凋亡相关信号通路典型蛋白表达的影响。p《0.05
[0069]
图30示出了lps诱导hepg2细胞中nrf2和nf-κb通路上c4的表达。图30(a)示出了蛋白质带;图30(b)示出了nrf2;图30(c)示出了ho-1;图30(d)示出了nf-κb;图30(e)示出了inos;图30(f)示出了cox-2.lps+3.125μm,lps+6.250μm与lps相比,*p《0.05。
[0070]
图31示出了c4抗癌原理的示意图。
具体实施方式
[0071]
为了从油茶籽饼中鉴别并分离出新的具有抗肿瘤活性化合物,进一步开发油茶籽饼中的皂甙资源,本发明从油茶籽饼中分离得到的多种萜类化合物。
[0072]
本发明对油茶籽饼的提取物进行了研究。从细胞毒性筛选试验中发现,与总皂苷组分相比,酸处理组分在肿瘤细胞系中具有很好的细胞毒性活性。进一步的,本发明采用预酸水解处理和活性引导分离的结合从总皂苷中分离出了四种茶皂素衍生物,包括两种新的茶皂素衍生物。具体结构如下:
[0073][0074]
以下用分别用c1、c2、c3和c4分别代指上述四种化合物。
[0075]
本发明进一步研究了上述四种化合物对五种人类肿瘤细胞系的体外细胞毒性活性,即huh-7、hepg2、hela、a549和sgc7901,并对其作用机理进行了说明。
[0076]
具体的,本发明采用的表征方法如下:
[0077]
紫外线光谱由persee紫外线分光度计t9(中国北京)记录。
[0078]
ir频谱由thermo nicolet nexus 470ft-ir光谱仪(美国马萨诸塞州赛默飞世尔科技)记录。
[0079]
nmr光谱仪由bruker avance iii 400nmr光谱仪(德国布鲁克)记录,使用cdcl3作为溶剂,而化学变化则参考溶剂的残峰。
[0080]
使用安捷伦6250tof lc/ms系统获取hresims数据。
[0081]
硅胶(中国200-300网状、青岛海洋化工有限公司、中国)及ab-8大孔吸附树脂(solarbio life science co.,ltd.,中国北京)用于开放柱色谱(cc)表征。
[0082]
采用xbridge shield rp18(3.5um 4.6
×
150毫米)高效液相色谱柱和waters acouity高效液相色谱系统进行高效液相色谱分析。
[0083]
在waters 2695-2489系统和glp-id(150mm
×
450mm)制备柱上进行半制备rp-hplc。
[0084]
在预涂硅胶gf254板上进行tlc分析。
[0085]
所有溶剂均为分析纯。
[0086]
具体的,本发明采用的实验材料为2020年从中国广东省梅州市射江镇收集的油茶种子。油茶籽饼由压榨食用茶油产生,然后用作提取。
[0087]
具体的,本发明对皂苷的提取、酸水解及分离过程如下:
[0088]
将5公斤山茶籽饼磨成粉末,并用石油醚回流2小时。
[0089]
将脱脂的籽饼干燥并用75%乙醇进一步提取三次。
[0090]
然后将粗提物装入ab-8大孔树脂柱,用1%氢氧化钠水溶液洗脱,然后用甲醇-水的顺序混合物(0%、10%、30%、80%)洗脱。
[0091]
用80%甲醇洗脱的部分在减压下浓缩,得到总皂苷部分(251g)。
[0092]
将溶于3n hcl(甲醇
–
h2o,1:1)中的总皂苷溶液回流5h。
[0093]
用10%的氢氧化钠水溶液中和反应混合物,然后进行三次etoac萃取。
[0094]
然后干燥etoac层,并从茶花籽饼中获取总计40克苷元提取物。
[0095]
将总苷元提取物加载到硅胶柱中,用石油醚etoac(30:1-1:1,梯度系统)洗脱,以生成fr.a(0.8g)和fr.b(1.4g)两个组分。
[0096]
使用mecn-h2o(70:30,v/v)流动相通过半制备rp-hplc进一步纯化fr.a,以得到c3(231mg)和c4(70mg)。
[0097]
通过半制备rp-hplc(h2o中85%等容mecn)分离fr.b,得到c1(52mg)和c2(234mg)。
[0098]
本发明中涉及的参数的测试方法如下:
[0099]
细胞毒性生物测定
[0100]
c1、c2、c3和c4的细胞毒性在五种人体癌细胞系中进行评估:huh-7、hepg2、hela、a549及sgc7901。用mtt法检测分离物处理后细胞的活性。每个治疗组进行三个独立的实验。
[0101]
细胞凋亡检测
[0102]
细胞在12孔培养板中以不同处理培养4h,然后用冷pbs洗涤两次,再悬浮在结合缓冲液中,浓度为1
×
106细胞/ml。接下来,将100μl的再悬浮细胞转移到5ml试管中,添加5μl的annexin v-fitc和5μl pi,并轻轻地旋转细胞。在室温下培养15分钟后,向每个试管中添加400μl结合缓冲液,并在30分钟内通过流式细胞仪分析细胞。
[0103]
细胞复染
[0104]
细胞在含有10%fbs和1%双抗体的dmem培养基中培养,然后洗涤5ml pbs。接下来,添加350ml胰酶,并在37℃下快速将培养瓶转移到含有5%co2的培养箱中。细胞成圆后,迅速加入2ml培养液,停止消化。转移至15ml离心管中,1500rpm离心5min,用新鲜培养物重新悬浮细胞。将细胞悬液稀释至1
×
106细胞/ml,在37℃和5%co2下培养24h,添加化合物。孵育48小时后,加入100μl钙黄绿素(calcein am/pi),孵育30分钟,然后进行高内涵细胞成
像分析系统的图像分析。选择了6种转录因子。gapdh或肌动蛋白被用作参考基因。
[0105]
蛋白质印迹分析
[0106]
将a549 u251 pan02和hepg2细胞(1
×
106细胞)在6-cm培养皿中预培养24小时,然后在无血清培养基中饥饿2.5小时,以消除fbs的影响。然后,细胞在暴露于c3或c4下之前,可用mv处理细胞2小时也可不用mv处理。将收集的细胞进行裂解,并将上清液煮沸5分钟。根据制造商手册,使用染料结合蛋白检测试剂盒(beyotime生物技术研究所)测定蛋白质浓度。将等量的裂解蛋白进行10%的sds-page并电泳转移到pvdf膜上(amershan pharmacia biotech,little chalfont,uk)。封闭后,在4℃下将膜与特异性一级抗体孵育过夜,然后再与hrp结合二级抗体孵育1小时(cell signaling technology,beverly,usa)。结合抗体是使用带lumi vision pro机器的ecl系统检测的(日本柴达木市taitec)。使用lumi vision imager软件量化与特定抗体相关的蛋白质的相对数量。
[0107]
钙黄绿素am/pi,孵育30分钟,然后对高内涵细胞成像分析系统进行图像分析。
[0108]
统计分析
[0109]
所有数据均采用spss软件进行分析。所有样品测量三次,数据表示为三个不同实验的平均值
±
sd。单因素方差分析用于测量各实验平均值之间的统计差异。p《0.05为显著统计学差异。
[0110]
油茶茶皂苷衍生物的提取、鉴定与表征
[0111]
考虑到皂苷的化学结构,本发明对茶花籽饼中的总皂苷部分进行了预酸处理。筛选试验结果表明,酸处理组分在大多数癌细胞系中表现出更好的细胞毒性活性(表1)。然后,用75%甲醇提取茶花籽饼,通过硅胶柱洗脱,最后用半制备型rp-hplc检测。最后,分离并鉴定了四个主要化合物,c1、c2、c3和c4。其中,两个新的茶皂苷衍生物c1和c4是首次发现在油茶中存在的。
[0112]
表1
[0113][0114]
为了验证c1、c2、c3和c4的准确化学结构,本发明对上述化合物进行了1h和13c nmr分析。如图1所示,c1的正离子hr-esi
–
ms光谱在m/z 571.4025处显示[m+h]+峰(计算值571.3999),对应分子式为c
35h54
o6。红外光谱表明存在羟基(3525cm-1
)和α,β-不饱和酯基(1710和1650cm-1
)。c1的1h nmr光谱表明,δh 9.37处为甲酰质子(1h,s,h-23),δh 5.31处为芳香单重态质子(1h,t,j=3.9hz,h-12),δh3.64处为两个孤立的含氧亚甲基质子信号(1h、d,j=11.3hz,h-28)和3.38处为三个单独的含氧亚甲酰质子,δh 3.75处为三种含氧亚甲基质子(1h-3.75,dd,j=11.4,4.6hz,h-3),5.80处为两种单独的含氧亚甲基质子信号,和3.89(1h,dd,j=12.8,5.4hz,h-22),δh 1.05(3h,s,h-24),0.98,h-4')和1.87(3h,s,h-5')]。
[0115]
13c nmr光谱显示了35个碳的共振,包括两个羰基碳(δ
c 207.3和169.5)、四个烯烃碳(δc141.4、139.2、123.7和129.1)、四种含氧碳(δc76.6、73.2、72.0和71.5)、八个甲基(33.1、27.3、24.9、16.7、16.0、14.7、12.5和9.1)、八种亚甲基(δ
c 46.4、44.1、38.4、32.1、
31.8、26.2、23.5和20.8),hsqc结果支持的三种甲基(δ
c 48.4、46.8和42.0)和六种季碳(δ
c 55.3、43.9、41.4、40.3、36.0和31.6)。该数据表明,c1分子中含有齐墩果酸结构,这与其他报告一致(zhou,wang,ye,&chen,2014;zong et al.,2015)。
[0116]
在hmbc实验中,h-24与c-3/c-4/c-5/c-23、h-25与c-1/c-5/c-9/c-10、h-26与c-7/c-8/c-9/c-14、h-27与c-8/c-13/c-14/c-15、h-29/h-30与c-19/c-20/c-21之间的相关性进一步证实了齐墩果酸骨架的存在。h-1/h-2/h-24和c-3(δ
c 72.0)、h-18/h-21/h-28和c-22(δ
c 76.6)、h-16/h-18/h22和c-28(δ
c 73.2)之间的hmbc相关性分别用于将三个羟基放在c-3、c-22和c-28上。h-3'/h-5'和c-1'、h-3'/h-4'/h-5'和c-2'、h-4'/h-5'与c-3'之间的hmbc相关性以及h-4'和h-5'之间的noesy相关性进一步支持了天使酰取代基的存在(图2)。根据h-16和c-1'之间的hmbc相关性,可以阐明c-16处的angeloyl基团的位置。c1的相对构型由noesy实验确定。
[0117]
化合物1-4的nmr数据如表2所示。其中,溶剂为cdcl3(δin ppm,j in hz,500mhz for 1h nmr,125mhz for 13c nmr)。
[0118]
表2
[0119][0120]
根据c4的13c nmr和hresims数据(m/z 859.4821[m+h]+,c
47h71o14
的计算值,859.4844),预测c4的分子式为c
47h70o14
,表明存在13个缺氢指标。c4的红外光谱在1708和1646cm-1处有吸收带,代表羧基和α,β-不饱和酯,3447和1044cm-1
处的宽谱带表明存在糖苷结构(zhou,wang,ye,&chen,2014;zong et al.,2015)。核磁共振波谱结果进一步支持了该数据(表1)。对1d和2d nmr数据的详细分析表明,c4的结构与化合物1的结构相似。显著差异在于糖苷结构的附加信号[δh 4.27(1h,d,j=7.5hz,h-a),3.33(1h、m、h-b),3.50(1h和m、h-c),3.66(1h与m、h-d),3.87(1h,m,h-e),3.80(3h,s,h-f-me);δc 104.1(c-a),73.3(c-b),75.5(c-c),71.4(c-d),71.7(c-e),169.9(c-f),52.9(c-f-me 4个oyl取代基。糖苷结构与齐墩果酸骨架的c-3相连,由h-a和c-3以及h-3和c-a的hmbc相关性证明(图2)。根据h-21和c-1'、h-22和c-1的hmbc相关性,这两个angeloyl基团可能分别位于c-21和c-22”。因此,可得到c4的结构。
[0121]
c2和c3均为白色无定形粉末,其ms和nmr数据分析表明它们都是齐墩果酸三萜,具有紧密的茶皂苷骨架。与c1相比,化合物2和3的nmr波谱数据表明存在当归醇基团[δh 6.93(1h,qd,j=7.0,1.1hz,h-3'),1.82(3h,dd,j=9.0,1.1赫兹,h-4'dd,j=7.2,1.4hz,h-4')和1.89(3h,t,j=1.4,h-5'),δc 169.0(c-1'),127.7(c-2'),139.2(c-3'),16.0(c-4'),20.8(c-5')表示3]。在化合物2中,利用h-16和c-1'之间的hmbc相关性来定位c-16处的天使酰取代基。结合hmbc相关性,化合物2被鉴定为山茶黄素a16虎苷。同样,由于h-22和c-1'之间的hmbc相关性,化合物3的结构被确定为山茶素a22虎苷酸。尽管c2和c3是已知的化合物,之前在某些地方已经进行了表征,但它们的1h和13c nmr数据首次完全公开。
[0122]
以下对c1、c2、c3和c4的应用效果进行说明。
[0123]
c1、c2、c3和c4在典型癌细胞系中的抗肿瘤活性
[0124]
本发明采用mtt法评估所有分离物对五种人类肿瘤细胞系(人类肝细胞癌细胞huh-7和hepg2、人宫颈癌细胞hela、人肺癌细胞a549和人胃癌细胞sgc7901)的细胞毒性。使用广泛使用的抗癌药顺铂(ddp)作为阳性对照。如表3所示,所有分离的茶皂苷衍生物在人类肿瘤细胞系中都表现出显著的细胞毒性活性,尤其是c4。c4表现出强大的细胞毒性,ed50范围为1.5至11.3μm,与ddp相当。在初步结构中-活性关系分析中,与化合物2相比,化合物1中醛基在c-23位置的额外取代可以增加细胞毒性活性,因此对茶皂素支架c-23的进一步结构修饰有可能会大大提高其细胞毒性。
[0125]
表3
[0126][0127]
其中ddpa为阳性对照。
[0128]
c3和c4对三种典型癌细胞株活性的影响
[0129]
考虑到受试茶皂素衍生物的细胞毒性作用以及c3和c4作为潜在抗肿瘤化合物的重要性,本发明进一步研究了c3和c4对细胞内生存、增殖、迁移和侵袭相关信号通路蛋白表达的影响,如生存jak2/stat3、增殖抑制因子、增殖抑制蛋白、增殖抑制基因、增殖抑制信号通路蛋白、增殖相关信号通路和侵袭抑制蛋白β-catenin mtor、凋亡bcl-2/bax caspase 3、氧化还原介质nf-κb/nrf2途径。
[0130]
根据钙黄绿素am/pi染色结果,可发现,c3和c4中的a549、u251和pan02细胞具有显
著的凋亡效应。在三种细胞模型中,c3和c4组中观察到大量代表死亡细胞的橙色荧光,并与对照组进行了比较。c4组a549和pan02细胞的死亡率高于c3组。然而,在u251细胞中,c3组的细胞死亡率高于c4组。这些结果表明,c3和c4显著抑制癌细胞的增殖,c4比c3更有效。
[0131]
图27显示了三种细胞凋亡相关蛋白中c3和c4的表达。c3和c4通过调节这些细胞中的不同蛋白来促进细胞凋亡。c3通过上调bax表达,c4通过下调a549细胞中的p-stat3和bcl-2表达。c3通过下调u251细胞中的p-mtor和p-stat3而表达,c4通过下调p-stat3和bcl-2而表达。化合物3和4通过下调pan02细胞中的p-mtor、p-stat3和bcl-2。结果表明,c3和c4均具有明显的促凋亡作用。同时,c4的作用优于c3。与对照细胞相比,c4显著降低a549、u251和pan02细胞中p-stat3/stat3的表达水平。同时,它还可以减弱抗凋亡蛋白bcl-2,降低bcl-2/bax比值。
[0132]
c4对hepg2细胞凋亡的影响
[0133]
选择c4是为了证实其抗肿瘤作用,因为c4比c3更易促凋亡。根据流式细胞术的结果,c4的凋亡率肯定以剂量依赖的方式增强。为了获得c4抗肿瘤活性的更准确的分子证据,在hepg2细胞中检测到典型的凋亡相关蛋白。图4中的结果表明,与空白相比,caspase-3和tnf-α的表达显著下降,以促进细胞凋亡。同时,与空白组相比,β-catenin的表达显著增强,促进细胞凋亡。然而,jak2没有显著变化。这些结果表明,c4通过下调β-catenin和上调caspase-3和tnf-α来促进细胞凋亡。
[0134]
c4对lps诱导hepg2细胞氧化还原相关的nrf2和nf-κb通路的影响
[0135]
为了阐明c4抗肿瘤的分子机制,在lps诱导的hepg2细胞中检测到典型的凋亡相关蛋白。检测nrf2及其下游蛋白ho-1。检测炎症因子nf-κb、inos和cox-2。如图5所示,lps组与空白组相比显著增加。这表明炎症模型已经成功建立。如图5所示,与lps组相比,3.125和6.250组的nrf2和ho-1的表达显著降低。因此,c4是一种合适的nrf2抑制剂,它可以使抗肿瘤药物在癌细胞中发挥协同作用。6.250组nf-κb、inos和cox-2的表达显著增强,3.125组表达增强,但不显著。基于这些,c4可能是一种合适的炎症诱导剂,可用于调节增殖。
[0136]
综上所述,上述结果表明,c4可通过bcl-2/caspase 3和jak2/stat3途径触发细胞凋亡,并通过nf-κb/inos/cox-2途径刺激细胞增殖,更重要的是,c4可以通过抑制nrf2/ho-1途径提高抗癌药物的抗药性。
[0137]
在本发明中,提供了四种细胞毒性茶皂素衍生物,包括两种新的(c1和c4),它们是通过预酸水解处理和活性导向分离相结合从茶花籽饼中提取的。同时,分子证据表明c4具有优异的抗肿瘤能力,可以显著抑制炎症途径和靶点,并调节细胞内redox平衡。
[0138]
在本发明中,对c4的抗肿瘤活性和分子机制进行了研究,发现c4通过诱导凋亡途径和抑制nrf2/ho-1途径发挥其强大的抗肿瘤性能。
[0139]
癌症的发展与炎症密切相关。例如,癌症干细胞样细胞中与炎症相关的dna损伤导致具有侵袭性临床特征的癌症的发展。一些癌症之前会出现体内炎症反应。然而,癌细胞的凋亡可以诱导炎症途径,刺激细胞增殖,防止细胞死亡。由此可见,c4可以显著刺激nf-kb炎症途径及其靶点,并抑制nrf2/ho-1途径来调节细胞内redox平衡,这表明c4可以开发成为治疗癌症的药物。本发明对比了c3,发现c3也具有抗肿瘤活性,但不如c4有效。这说明糖苷配体是c4抗癌活性的一个重要来源。
[0140]
同时,c4可以降低nrf2的活性,并且效果显著。这说明c4为一种nrf2抑制剂,它可
以增强癌细胞对抗癌药物的敏感性并提高疗效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1