一种植物乳杆菌扁鹊君18、植物乳杆菌制剂及其应用的制作方法
1.本发明涉及微生物技术领域,具体的,涉及一种植物乳杆菌扁鹊君18及其在降糖方面的应用。
背景技术:
2.糖尿病作为目前健康的主要杀手之一,已经受到极大地关注。作为一种多病因的代谢性疾病,由于胰岛素分泌不足或机体缺陷,引起的糖、脂肪和蛋白质代谢紊乱而造成机体高血糖。糖尿病有i型和ⅱ型糖尿病,i型糖尿病因胰岛素分泌缺乏,依赖外源性胰岛素补充以维持生命。ⅱ型糖尿病患者约占比最高,主要是胰岛素抵抗或胰岛素分泌不足,患者常年伴有高血糖。目前口服降糖药主要有五类,包括α-glucosidase抑制剂、磺脲类、氯茴苯酸类、双胍类和噻唑烷酮类药物,但是这些药物的使用会产生严重的副作用。
3.研究表明,益生菌是一类对宿主健康有促进作用的活性微生态制剂,其良好的功能特性和健康促进作用已被广泛接受和认可。植物乳杆菌是主要的益生菌种类,也有部分研究证实其具有一定程度降血糖作用(如cn111733111b)。但植物乳杆菌在进入人体后会受到胃液和胆盐的抑制,因此菌株的耐酸耐胆盐性能非常重要,同样地,随着抗生素的普遍使用,菌株对于其他药物的耐抗性亦非常重要。因此,开发一种既具有辅助降糖作用又能适应肠胃环境兼具耐酸、耐胆盐、耐药性的功能菌株,为本领域技术人员亟待解决的问题。
技术实现要素:
4.本发明的目的在于提出一种既具有辅助降糖作用又能适应肠胃环境兼具耐酸、耐胆盐、耐药性的植物乳杆菌-扁鹊君18。
5.为了实现上述发明目的,本发明的技术方案如下:
6.一种植物乳杆菌(lactobacillus plantarum)扁鹊君18,所述植物乳杆菌扁鹊君18于2022 年9月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.25712。
7.作为进一步技术方案,所述植物乳杆菌扁鹊君18的获得,包括以下步骤:
8.s1、将石家庄泡菜固体进行粉碎后,采用0.85%灭菌生理盐水提取,得到提取液;
9.s2、将提取液加入到生理盐水混合均匀后,依次进行十倍梯度稀释,分别吸取10-4
、10-5、 10-6
三个稀释度的样品,均匀涂布于含0.5% caco3的固体mrs培养基上,37℃恒温静置培养36-48h;
10.s3、培养36-48h后,挑选透明圈明显的菌落纯化后,于4℃冰箱斜面保存,得到植物乳杆菌扁鹊君18。
11.作为进一步技术方案,所述植物乳杆菌制剂包括权利要求1所述的植物乳杆菌扁鹊君18。
12.作为进一步技术方案,所述植物乳杆菌制剂为固态或液态。
13.作为进一步技术方案,所述植物乳杆菌制剂包括植物乳杆菌扁鹊君18活菌、植物
乳杆菌扁鹊君18灭活菌、植物乳杆菌扁鹊君18代谢产物中的一种或多种。
14.作为进一步技术方案,所述的植物乳杆菌制剂在制备酸奶中的应用。
15.作为进一步技术方案,所述的植物乳杆菌制剂在制备降低机体血糖的制品中的应用。
16.作为进一步技术方案,所述的植物乳杆菌制剂在制备提高机体糖耐量的制品中的应用。
17.作为进一步技术方案,所述的植物乳杆菌制剂在制备降低机体糖基化血红蛋白含量的制品中的应用。
18.作为进一步技术方案,所述制品包括食品、药品或保健品。
19.本发明的工作原理及有益效果为:
20.1、本发明中植物乳杆菌扁鹊君18对于α-葡萄糖苷酶和α-淀粉酶均具有较佳的抑制作用,尤其对于α-淀粉酶具有突出的抑制作用,同时,其兼具耐酸、耐胆盐、耐药性,此外,其还具有优异的肠道定植能力,能够适应人体肠胃环境,使得其降血糖功效受到外界环境的影响尽量降低,保证了其辅助降血糖的效果。此外,已通过体外实验证实,植物乳杆菌扁鹊君18 对ⅱ型糖尿病小鼠的糖耐量具有显著改善作用,可以明显延缓高血糖小鼠的空腹血糖和餐后血糖上升情况,改善高血糖小鼠的糖耐量。因此,植物乳杆菌扁鹊君18适用于制备辅助降低血糖的食品、药品和保健品。
21.2、本发明中植物乳杆菌扁鹊君18在酸奶的发酵过程中产酸速率快,减少了生产成本。 l.plantarum扁鹊君18在凝乳时间、发酵乳酸度和发酵过程中产酸速度、保水率、活菌数、储存期的酸度变化、储存期的活菌数变化和储存期脱水收缩率变化,均表现出优异的性能,适用于制备酸奶中的应用。
22.3、本发明中植物乳杆菌扁鹊君18对羟自由基、超氧阴离子自由基和dpph自由基的清除率较高,具有较好的抗氧化性能,可应用于制备抗氧化制品。
23.4、本发明中植物乳杆菌扁鹊君18含有丰富的抑菌物质,抑菌能力较佳,可应用于制备抑菌制品。
附图说明
24.下面结合附图和具体实施方式对本发明作进一步详细的说明。
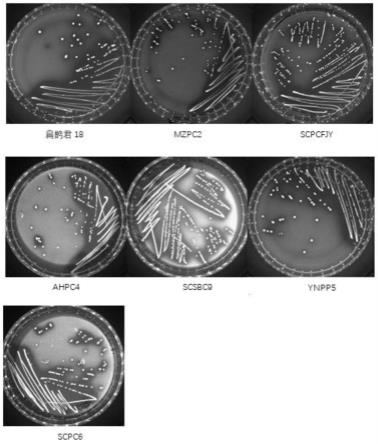
25.图1为筛选出的7种菌株的菌落形态图;
26.图2为扁鹊君18、scsbc9的革兰氏染色的菌体形态图;
27.图3为高血糖模型建模成功后各组小鼠auc比较图;
28.图4为灌胃一周后各组小鼠auc比较图;
29.图5为实验结束时各组小鼠auc比较图;
30.图6为发酵乳发酵过程中ph变化示意图;
31.图7为发酵乳发酵过程中酸度变化示意图;
32.图8为发酵乳发酵过程中活菌数变化示意图;
33.图9为发酵乳储存期酸度变化示意图;
34.图10为发酵乳储存期活菌数变化示意图;
35.图11为发酵乳储存期脱水收缩率变化示意图。
具体实施方式
36.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都涉及本发明保护的范围。
37.实施例1、植物乳杆菌扁鹊君18的筛选与鉴定
38.1.1本实施例中,实验所用的原材料和仪器设备具体如下:
39.1.1.1实验样品
[0040][0041]
需要说明的是,本领域技术人员知晓,所有固体样品均包含发酵液。此外,2号样品和3 号样品来自不同的农家自然发酵泡菜,只不过2号样品取样时携带泡菜发酵液较少,3号样品取样时携带固体泡菜较少。
[0042]
1.1.2培养基
[0043]
mrs培养基:葡萄糖20g、蛋白胨10g、牛肉膏10g、酵母浸粉5g、无水乙酸钠5g、磷酸氢二钾2g、柠檬酸三铵2g、硫酸锰0.25g、硫酸镁0.58g、吐温-80 1ml、ph6.2-6.4,121℃高压灭菌15min。
[0044]
mrs固体培养基:在mrs液体培养基中加1.5%琼脂,115℃高压灭菌15min。
[0045]
caco
3-mrs固体培养基:mrs液体培养基中添加1.5%caco3和1.5%琼脂。
[0046]
营养肉汤培养基(nb):牛肉膏3g、蛋白胨10g、氯化钠5g、ph7.2-7.4,121℃高压灭菌20min。
[0047]
1.1.3指示菌
[0048]
金黄色葡萄球菌atcc 25923(staphyloccocus aureus atcc 25923)。大肠杆菌atcc 44752 (escherichia coli atcc 44752)。
[0049]
1.1.4实验试剂
[0050][0051][0052]
1.1.5实验设备
[0053][0054]
1.2菌株的筛选
[0055]
1.2.1样品处理
[0056]
将安徽泡菜、四川泡菜、石家庄泡菜、四川水白菜、梅州泡菜、云南发酵枇杷固体样品进行粉碎,采用灭菌生理盐水(质量百分比为0.85%)提取。吸取样品提取液于试管中,并置于4℃冰箱保存备用。
[0057]
将四川泡菜发酵液直接吸取于试管中,并置于4℃冰箱保存备用。
[0058]
1.2.2菌株的筛选
[0059]
分别用移液器无菌移取上述固体样品的提取液和四川泡菜发酵液,分别取样0.5ml。将样品分别悬液于装有4.5ml无菌生理盐水(质量百分比为0.85%)的试管中,并置于涡旋振荡器上混合均匀。混合均匀后,依次进行十倍梯度稀释。每试管分别吸取10-4
、10-5
、10-6
三个稀释度的样品,均匀涂布于含0.5% caco3的固体mrs培养基上,后置于37℃恒温静置培养36-48h,观察并挑选透明圈明显的菌落,进行编号,并在mrs平板上多次划线。纯化直至菌落形态单一,挑取单菌落到mrs固体培养基培养24h,斜面保存,记录菌落特征,后置于4℃冰箱保存备用,得到7种菌株,将其分别编号为ahpc4、scpc6、scpcfjy、扁鹊君 18、scsbc9、mzpc2和ynpp5。
[0060]
1.2.3菌悬液及发酵液的制备
[0061]
挑取斜面保藏的筛选菌株,加入装有50ml mrs的250ml三角瓶中,37℃静置培养24h,获得一代菌悬液,吸取一代菌悬液按1%接种量接种于装有50ml mrs的250ml三角瓶中, 37℃静止培养12h,获得二代菌悬液。将连续活化的二代菌悬液在4000rpm、4℃的条件下离心10min,分离上清液,将离心分离的上清液过0.22μm的微孔滤膜,作为菌株的发酵上
清液;取离心沉淀菌体,0.85%的生理盐水清洗2-3次后进行重悬,调整菌悬液为1
×
109cfu/ml(od 值=1.0),获得菌悬液。筛选得到的7种菌株均做上述处理,得到相应的菌悬液。
[0062]
1.3菌株的鉴定
[0063]
1.3.1菌株的形态观察
[0064]
挑取步骤1.2.2中斜面保藏的筛选菌株,接入mrs液体培养基中,37℃恒温培养,连续活化2代后,用接种环在固体caco
3-mrs平板上划线,37℃恒温培养48h后,观察菌落特征,筛选得到的7种菌株均做上述处理,结果如图1所示。由图1可知,7种菌株的菌落形态较相似,菌落直径在0.2-2.0mm之间,菌落颜色均为乳白色,菌落形态均为圆形凸起,边缘整齐,半透明,表面湿润光滑。其中6株菌为杆状,1株菌为球状,为菌株scsbc9(图1)。
[0065]
将分离出的菌株进行革兰氏染色并镜检:于超净台固定好载玻片,挑取适量单菌落,均匀涂抹在载玻片上,酒精灯火焰加热,固定细菌。使用结晶紫初染1min,用蒸馏水冲洗,用吸水纸将多余水分等吸去。碘-碘化钾溶液媒染1min,用吸水纸将多余水分等吸去,95%的乙醇对其进行脱色30s,蒸馏水冲洗,吸水纸将多余水分等吸去,最后使用番红对其进行复染,时间为30s,蒸馏水冲洗,吸水纸将多余水分等吸去。最后镜检,在显微镜下观察,蓝紫色为革兰氏阳性菌,红色为革兰氏阴性菌。筛选得到的扁鹊君18和scsbc9菌株均做上述处理,结果如图2所示。图2显示了菌扁鹊君18和scsbc9的显微形态特征,两者的革兰氏染色结果均显示紫色,两种菌株均为革兰氏阳性菌,不形成芽孢。
[0066]
说明:申请文本中提交的图1-2为黑白图,实际的实验结果表现的并不十分清楚,因此额外提交证明文件,证明文件1-2为图1-2的原图(彩色图)。
[0067]
下一步进行h2o2酶试验。取载玻片,用移液器(1-10μl)移取数滴3%(v/v)h2o2,均匀分布于载玻片表面,挑取菌株单菌落,充分溶解在h2o2中,30s内检测是否有气泡产生,每株实验菌株重复检测三次。筛选得到的7种菌株均做上述处理,结果如表1显示。根据表 1可知,7株菌均为h2o2酶阴性。
[0068]
表1菌株的形态和理化特征
[0069][0070]
1.3.2菌株的分子生物学鉴定
[0071]
将菌株在mrs固体培养基上活化三代,直至单菌落明显。将活化后的菌株送上海生
淀粉(0.1%)溶液,37℃反应15min,加入300μl 1.0mol/l hcl终止反应,加入200μl碘液 (0.01mol/l)显色,最终加蒸馏水定容至5ml,在波长660nm下测吸光度a。筛选得到的7 种菌株和相应的菌悬液(实施例1制得)均做上述处理。计算公式如下:
[0081][0082]
式中:a1—阴性空白od
660
值;a2—阴性对照od
660
值;a3—样品空白od
660
值;a4—样品对照od
660
值。
[0083]
表4植物乳杆菌扁鹊君18对α-淀粉酶的抑制率实验
[0084][0085][0086]
7种菌株及其相应菌悬液对α-淀粉酶的抑制作用,结果见表5。表5显示,7种株菌的发酵上清液对α-淀粉酶的抑制率均较高,抑制效果最好的是菌株扁鹊君18,抑制率为47.33%,远优于现有技术,对于扁鹊君18应用于辅助降血糖的意义重大;而7种菌悬液对α-淀粉酶抑制作用不明显,均在5%以内。
[0087]
表5植物乳杆菌扁鹊君18对α-淀粉酶的抑制作用
[0088][0089]
2.2对α-葡萄糖苷酶的抑制率
[0090]
准确吸取100μl样品溶液(菌株发酵上清液或菌悬液),分别加入100μl的α-葡萄糖苷酶(1u/ml),37℃孵育10min后再加入500μl pnpg(1mmol/l),然后37℃培养20min,最后加入1ml的na2co3(0.2mol/l)终止反应,在405nm波长处测定吸光值。筛选得到的7 种菌株和相应的菌悬液(实施例1制得)均做上述处理。计算公式如下
[0091][0092]
式中:a—含有α-葡萄糖苷酶溶液但不含样品的od
405
值;b—不含α-葡萄糖苷酶溶液和待测样品的od
405
值;c—含有α-葡萄糖苷酶溶液和待测样品的od
405
值;d—不含α-葡萄糖苷酶溶液但含待测样品od
405
值。
[0093]
表6植物乳杆菌扁鹊君18对α-葡萄糖苷酶的抑制作用
[0094][0095]
7种菌株及其相应菌悬液对α-葡萄糖苷酶的抑制作用,结果见表6所示。根据表6可知, 7种乳酸菌菌体及其发酵上清液对α-葡萄糖苷酶均具有一定的抑制作用。其中,发酵上清液中,以扁鹊君18和scpcfjy对α-葡萄糖苷酶的抑制率最高;菌体中,以scpcfjy对α-葡萄糖苷酶的抑制率最高。
[0096]
综合上述结果可知,植物乳杆菌扁鹊君18对α-葡萄糖苷酶和α-淀粉酶均具有很好的抑制作用,表明植物乳杆菌扁鹊君18具有优异的辅助降糖效果。
[0097]
实施例3、植物乳杆菌扁鹊君18对糖尿病小鼠的降糖作用
[0098]
需要说明的是,km小鼠购于河北医科大学动物研究中心。
[0099]
3.1植物乳杆菌扁鹊君18活菌制剂及代谢物的制备
[0100]
将l.plantarum扁鹊君18在液体mrs培养基中进行活化,37℃恒温培养24h,连续活化2代后,将处于对数生长期的l.plantarum扁鹊君18以1%的接种量接种到mrs培养基中,温度为36℃,ph值为7,其中mrs培养基中的葡萄糖替换为等量的麦芽糖,恒温静置培养。每隔2h取样,测菌液od
600
值。
[0101]
分别收集两种菌体,分别将菌体用12%的脱脂乳作为保护剂重悬,真空冷冻干燥制备固体粉末活菌制剂。分别收集两种菌体离心的发酵上清液,真空冷冻干燥36h后制备发酵代谢物固体样品,即发酵上清液冻干剂。
[0102]
3.2小鼠体内实验
[0103]
3.2.1实验小鼠分组及糖尿病模型建立
[0104]
按照表7进行实验小鼠的分组和饲喂,每组小鼠均不少于10只。第1周仅进行基础饲料的饲喂。第2周的开始按照表7进行腹腔注射。从第2周开始时进行小鼠血糖的测定(采用断尾取血、用血糖仪和血糖试纸测量的方法),每周一次。
[0105]
表7实验小鼠分组及饲喂情况
[0106][0107]
小鼠腹腔注射stz后的一个星期(即自饲喂开始的第3周开始时),对小鼠进行空腹血糖和餐后血糖的测定。小鼠断食不断水12h,测量空腹血糖;喂食小鼠,2h后测定餐后血糖。结果如表8、9所示。
[0108]
表8建模成功后各组小鼠空腹血糖
[0109][0110]
表9建模成功后各组小鼠餐后血糖
[0111][0112]
根据表8和表9可知,除n组的对照组外,其余各组的空腹血糖值均高于正常值 7.0mmol/l,餐后2h血糖高于11.0mmol/l,根据小鼠的空腹血糖和餐后血糖值(空腹血糖》7.0mmol/l,餐后2h血糖》11.0mmol/l),可以判断ⅱ型糖尿病小鼠模型造模成功。
[0113]
各组小鼠精神状态:正常组n组小鼠活动表现正常,精力充沛;观察小鼠的体态,毛发充足且完好,白色顺滑,形态正常,观察小鼠饮食与饮水均正常,粪便为黑色。高血糖组小鼠均表现异常,精神萎靡,体态瘦小、毛色发黄易脱落,饮水与排尿量明显增多,粪便为灰色。
[0114]
3.2.2ⅱ型糖尿病小鼠模型给药处理后的血糖情况
[0115]
医学诊断ⅱ型糖尿病的非常重要的指标是机体的空腹血糖及餐后血糖。通过适应
性喂养、随机分组、构建高血糖小鼠、测量小鼠的空腹和餐后血糖。在步骤3.2.1测得小鼠餐后血糖后,将按照表7对小鼠进行灌胃。在灌胃之前,需要对扁鹊君18的活菌制剂进行处理,处理方法为:将上述3.1制备的活菌制剂用生理盐水(0.85%)稀释,调整活菌数为1
×
109cfu/ml和 1
×
108cfu/ml,37℃恒温水浴30min后灌胃小鼠。灌胃后的一个星期(即自饲喂开始的第4 周开始时),对小鼠进行空腹血糖和餐后血糖的测定,结果如表10和表11所示。
[0116]
表10小鼠空腹血糖变化
[0117][0118]
表11小鼠餐后血糖变化
[0119][0120]
由表10和表11可知,自建模开始至第3周时,除了n组之外,其它各组空腹血糖均显著增高。随后,p组的空腹血糖水平开始下降,经过连续的给药治疗,治疗组的其空腹血糖水平开始慢慢地接近于正常组。第5周开始,m组的血糖增长速率远远大于其他各组,其他各治疗组的空腹血糖与m组相比明显降低。虽然扁鹊君18(1)、扁鹊君18(2)和扁鹊君18 (3)无法达到p组的效果。但是与m组相比,无论是高血糖小鼠的空腹血糖,还是高血糖小鼠的餐后血糖,在扁鹊君18的作用下,血糖均得到一定程度的改善。由此证明,植物乳杆菌扁鹊君18可应用于辅助降血糖的食品、药品和保健品。
[0121]
3.2.3小鼠口服葡萄糖糖耐受试验
[0122]
耐糖现象是临床诊断糖尿病的一个重要参考依据,通过口服糖耐量试验作为判断标准。造模成功后,各组小鼠通过口服葡萄糖的实验检测血糖变化。小鼠口服葡萄糖耐量的检测方位为:测完空腹血糖后,各组小鼠灌胃葡萄糖溶液(2g/kg),于15、30、60、90和120min 时测定小鼠血糖的含量。分别在造模成功后(即自饲喂开始的第3周开始时)、灌胃一周(即自饲喂开始的第4周开始时)和实验结束时(即自饲喂开始的第11周)进行。结果见表12 和图3。
[0123]
表12高血糖模型建模成功后各组小鼠糖耐量变化
[0124][0125][0126]
造模成功后且未进行给药之前,各组小鼠通过口服葡萄糖的实验检测血糖变化,结果见表12和图3。根据表12和图3可知,灌胃15min内,各组小鼠血糖均急速上升,高血糖组小鼠的血糖速率高于正常组小鼠;15min后正常组小鼠血糖开始下降,2h后可以恢复到正常水平;而高血糖组小鼠15min后血糖水平下降缓慢,2h后依然保持高血糖水平,葡萄糖耐受能力显著降低。
[0127]
表13灌胃一周后各组小鼠糖耐量变化(mmol/l)
[0128][0129]
灌胃一周后,各组小鼠的葡萄糖糖耐受结果见表13和图4。根据表13和图4可知,p组的血糖变化与一周前变化趋势大致一致。灌胃15min内,高血糖组小鼠的血糖持续增高,30min 仍然有短暂的升高现象。高血糖组小鼠在灌胃一周后血糖恢复情况较一周前有明显的下降趋势,且灌胃组小鼠的auc值与m组相比差异显著。说明扁鹊君18可以改善高血糖小鼠的糖耐量。
[0130]
表14实验结束时各组小鼠糖耐量变化(mmol/l)
[0131][0132]
实验结束时,各组糖耐受的结果见表14和图5。由表14和图5可知,n组的血糖值变
化与此前没有变化,糖耐受性依然保持平稳,可以恢复到正常水平。治疗组p组的血糖值及耐受性接近于n组,说明治疗效果显著。其他各实验组auc值与m组相比差异性明显,血糖上升的速率和幅度也显著低于m组,下降速率比m组明显。说明植物乳杆菌扁鹊君18对ⅱ型糖尿病小鼠的糖耐量具有显著改善作用。由此证明,植物乳杆菌扁鹊君18可用于制备提高机体糖耐量的组合物中。
[0133]
3.2.4小鼠糖基化血红蛋白检测
[0134]
糖基化血红蛋白(hba1c)可作为糖病尿患者评价血糖控制的指标。血浆中糖基化血红蛋白的含量可做为血糖的控制情况的指标。糖基化血红蛋白小于8.3mmol/l表示血糖控制理想。具体操作步骤如下:实验结束后,称重小鼠的脏器,计算脏器比和糖基化血红蛋白含量。糖基化血红蛋白采用elisa试剂盒,方法参照说明书,结果见表15。
[0135]
通过表15可知,各组小鼠的脏器比系数差异不显著,说明喂食乳酸菌和发酵液对小鼠的器官未产生影响。p组与n组相比,糖基化血红蛋白含量均小于8.3mmol/l,差异不显著,说明高血糖小鼠在治疗一段时间后糖基化血红蛋白得到显著改善。高血糖组小鼠与n组相比,糖化血红蛋白含量较高,均高于8.3mmol/l,说明高血糖组小鼠存在持续高血糖情况,与m 组相比,扁鹊君18(1)、扁鹊君18(2)和扁鹊君18(3)实验组的糖化血红蛋白均有所下降。说明喂食植物乳杆菌扁鹊君18可以改善糖基化血红蛋白含量。由此证明,植物乳杆菌扁鹊君18可用于制备降低机体糖基化血红蛋白含量的制品中。
[0136]
表15植物乳杆菌扁鹊君18对各组小鼠脏器系数和血糖指标影响
[0137][0138]
注:字母表示显著性,相同字母表示差异不显著,不相同字母表示差异显著,显著性水平p《0.05。
[0139]
实施例4、植物乳杆菌扁鹊君18耐药能力的确认
[0140]
本实施例中,阿米卡星、卡那霉素、庆大霉素、链霉素、诺氟沙星、氧氟沙星、左氟沙星、环丙沙星、万古霉素、红霉素、四环素、头孢噻吩、头孢噻肟、青霉素g、呋喃妥因、氯霉素、克林霉素均购自天坛生物制品有限公司,均为分析纯。
[0141]
4.1菌株活化
[0142]
吸取100μl的实施例1中的菌株发酵液,接种于mrs液体培养基,37℃静置培养24h,传代2次至对数期,备用。上述7种菌株发酵液均做上述处理。
[0143]
4.2药敏试验
[0144]
7种菌株采用药敏纸片扩散法检测抗生素的敏感性,根据美国临床和实验室标准协会 (clinical and laboratory standards institute,clsi)最新版手册,检测7种菌株的耐药活性,检测结果如表16所示。
[0145]
表16菌株的耐药性结果
[0146][0147]
注:“r”表示耐药性;“i”表示介于耐药性和敏感性之间;“s”表示敏感性。
[0148]
菌株的耐药性是评价菌株安全性的重要标准,由表16可知植物乳杆菌扁鹊君18的耐药性是最优的,其只对沙星类抗生素有耐药性,其它类均具有敏感性,具有较高的安全性,能够确保植物乳杆菌扁鹊君18在服用后,几乎不会受到其他药物的影响,进一步确保植物乳杆菌扁鹊君18的辅助降血糖功能,提高辅助降血糖的效果,更进一步利于植物乳杆菌扁鹊君 18在制备辅助降血糖食品、药品等领域的应用。
[0149]
实施例5、植物乳杆菌扁鹊君18耐酸性、耐胆盐性以及耐nacl能力的确认
[0150]
5.1耐酸性
[0151]
胃蛋白酶溶于0.5%氯化钠溶液中,调ph为2.0、3.0和4.0,终浓度为0.3%。充分溶解后用0.22μm的微孔膜过滤除菌(整个过程无菌操作)。将培养至第2代的菌株接种于模拟人工胃液中,37℃恒温静置培养,分别于0h、2h、4h取样,平板稀释法测定活菌数,计算存活率。
[0152]
实施例1得到的7种菌株均做上述处理。存活率的计算公式如下:
[0153][0154]
式中:n—经过处理之前的乳酸菌活菌数(cfu/ml);na—经过处理之后的乳酸菌活菌数(cfu/ml)。
[0155]
7种菌株的存活率结果如表17所示。根据表17可知,经过体外耐酸性实验,菌株表现出了不同的耐酸能力。在ph 4.0的环境中,7种菌株的存活率均在90%以上;但在低酸条
6%、7%、8%、9%,高温高压灭菌后,以1%的接种量接入对数生长期的菌株于在mrs培养基中,37℃恒温培养18h,600nm波长下测定菌悬液的od值。实施例1得到的7种菌株均做上述处理。
[0165]
表19耐nacl测定结果
[0166][0167]
7种菌株的耐nacl测定结果如表19所示。根据表19可知,在nacl超过4%后,其他几株菌的菌体量急剧下降,而在nacl浓度为9%时,扁鹊君18仍然可以生长60%,表现出优异的nacl的耐受能力。
[0168]
综上所述,植物乳杆菌扁鹊君18具有优异的耐酸性、耐碱性和nacl耐受能力,能够保证植物乳杆菌扁鹊君18在肠胃环境中不受这些因素干扰,进一步确保植物乳杆菌扁鹊君18 的辅助降血糖功能,提高辅助降血糖的效果。
[0169]
实施例6、植物乳杆菌扁鹊君18疏水能力的确认
[0170]
用pbs溶液(0.01mol/l,ph7.4)调节各菌株的od
600
至0.8(a0)。将4ml的a0与400μl 的二甲苯充分混合,漩涡振荡3min后,静置30min,分层后取水相,测定od
600
吸光值(a1)。
[0171]
实施例1得到的7种菌株均做上述处理。od
600
吸光值(a1)计算公式如下:
[0172][0173]
式中:a0—初始菌液od
600
值;a1—分层后水相od
600
值。
[0174]
表20疏水能力测定结果
[0175][0176]
7种菌株的疏水能力测定结果如表20所示。根据表20可知,scpcfjy的疏水能力最佳,为65.80,其次是扁鹊君18和ahpc4,疏水率亦高于50%。此三种菌株的疏水率显著高于其他菌株的疏水率。本领域技术人员知晓,疏水性是影响菌株黏附性的主要因素,研究表明菌体表面疏水性高的菌株具有更高的黏附力;菌株细胞膜疏水能力与黏附能力呈正相关,可作为考察菌株黏附能力的指标;黏附性强的菌株更容易在人体肠道中定植。根据测定结果可知,扁鹊君18的强疏水率,能够保证扁鹊君18在人体肠道中定植,进一步促进降血糖功效的发挥,提高辅助降血糖的效果。
[0177]
实施例7、植物乳杆菌扁鹊君18发酵性能的确认
[0178]
本实施例的菌株即为实施例1得到的7种菌株。本实施例的脱脂奶粉,购自上海光明乳业。本实施例的旋转式黏度计ndj-5s,购自上海伦捷机电仪表有限公司。
[0179]
7.1发酵乳凝乳时间的测定
[0180]
将菌株活化至对数期,以2%接种量接种于10%(w/v)的灭菌脱脂乳中,37℃恒温静置,每隔2h观察凝乳状况,记录凝乳时间。每组3个平行。在脱脂乳(含1%葡萄糖)中进行单菌发酵后的凝乳时间和终止发酵时间的测定,实施例1得到的7种菌株均做上述处理,结果见表21。由表21可知,各个菌株的凝乳时间大不相同,其中l.plantarum mzpc2在48h后仍未形成凝乳;而l.plantarum扁鹊君18、l.plantarum scpcfjy和p.pentosaceus scsbc9 的凝乳时间较短,其凝乳时间分别为14h、14h和12h。
[0181]
表21发酵乳的凝乳时间
[0182][0183]
需要说明的是,由于l.plantarum mzpc2和l.plantarum ahpc4的凝乳时间过长,不利于应用于酸奶制备,故不再进行后续的测定。
[0184]
7.2发酵乳酸度和发酵过程中ph的测定
[0185]
乳酸菌的产酸能力强弱影响发酵乳的整体品质。产酸速率快,会对发酵乳的蛋白交联产生影响造成风味物质的缺失和口感的下滑;产酸速率慢,会对发酵乳的开发和市场的推广损失,浪费能源、时间,增大了生产成本。
[0186]
在5种菌株发酵开始后,每间隔4个小时,则用ph计测定一次发酵乳的ph值,直至终止发酵。发酵乳发酵过程中的ph变化结果如图6所示。由图6可知,各菌株的产酸能力各不相同,发酵过程中的滴定酸度不断增长,随着发酵时间增长,乳酸菌的产酸速率达到一定值并且逐渐达到稳定。各发酵乳ph到达4.6以下时的时间差异明显,l.plantarum scpcfjy 的产酸速度较慢,大概需要40个小时;l.plantarum扁鹊君18的产酸速率最快,大概需要 24个小时。
[0187]
将菌株活化后,以2%接种量接种于10%(w/v)的灭菌脱脂乳,37℃恒温培养,待凝乳后立刻置于4℃冷藏24h,然后测定发酵乳的酸度。参考国标gb/t 5009.239-2016《食品酸度的测定》的方法测定酸度,用吉尔涅尔度(
°
t)表示。重复3次试验取平均值,实施例1得到的5种菌株均做上述处理,结果如图7所示。本领域技术人员知晓,乳酸菌的产酸能力在 70~110
°
t之间最佳。根据图7可知,凝乳结束时,l.plantarum扁鹊君18的酸度较佳,在 100~110
°
t之间。
[0188]
7.3发酵乳保水率的测定
[0189]
凝固型酸奶的重要质量指标之一就是持水力。将活化至对数期的5种菌株,分别以
2%接种量接种于10%(w/v)灭菌脱脂乳中,37℃恒温静置培养,凝乳后,于4℃冷藏24h。分别取10ml发酵乳,装入离心管离心(13200r/min、4℃)20min,倾去上清液,测定发酵乳的保水率和滴定酸度,并进行感官评价。每组3次平行,结果记载于表22中。保水率的计算公式如下:
[0190][0191]
式中:m—离心管质量(g);ma—样品和离心管质量(g);mb—离心后样品与离心管质量(g)。
[0192]
发酵乳的感官评价过程具体为:将凝乳后的脱脂发酵乳均冷藏24h,根据发酵乳的色泽、滋味、气味、组织状态评价发酵乳,感官评价成员由7人组成,均受过专业感官培训。感官评分标准如表22所示。感官评价完成后,结果记载于表23中。
[0193]
表22发酵乳感官评价表
[0194][0195][0196]
根据表23的数据可知,l.plantarum扁鹊君18的保水率在66.42%
±
0.28%,酸度在76.42
ꢀ±
0.28
°
t,感官评价51.32
±
2.33,在这三方面的表现均较佳。
[0197]
表23发酵乳制品实验结果
[0198][0199]
7.4发酵乳活菌数的测定
[0200]
分别准确量取0.5ml发酵乳,分别用生理盐水(0.85%)梯度稀释、mrs培养基平板涂布法计算发酵乳中的活菌数,结果见图8。由图8可知,l.plantarum扁鹊君18发酵6h后已进入对数生长期,24h基本处于稳定期,到达稳定期后的活菌数在9.25个对数值左右。
[0201]
7.5发酵乳储存期酸度的变化
[0202]
酸奶的风味,品质,保质期跟储存期的酸度变化相关。发酵乳储存期酸度的测定方法与实施例7.2一致,结果如图9所示。根据图9可知,所有菌株在冷藏期酸度有逐渐增大的趋势。其中,l.plantarum扁鹊君18和l.plantarum sb5的滴定酸度增加值最少,分别增加了 13.51
°
t和12.77
°
t,后酸化能力最弱。
[0203]
7.6发酵乳储存期活菌数的变化
[0204]
合格的发酵乳产品,在保质期内理化性质要保持稳定,且活菌数要在合理的范围内才能达到发酵乳的益生作用。发酵乳储存期活菌数的测定方法与实施例7.2一致,结果如图10所示。根据图10可知,l.plantarum扁鹊君18虽然在一周后也呈现下降趋势,但是下降速度最缓慢,活菌数最高,说明其在储存期内的理化性质最稳定。
[0205]
7.7发酵乳储存期脱水收缩率的变化
[0206]
发酵乳脱水收缩能力和发酵乳的黏度都主要与发酵乳结构有关。发酵乳储存期的结构越松散,水分子越容易析出,品质和风味就会下降;发酵乳的结构紧密,水分子析出就会降低,因此脱水收缩能力是评价发酵乳质量和稳定性的重要指标。脱水收缩率的测量方法如下:分别准确称取5.0g发酵乳,分别恒温静置放置漏斗中(20℃,90min),分别收集滤液称重,重复3次取平均值,结果见图11。脱水收缩率的计算公式如下
[0207][0208]
式中,m——样品质量(g);m1——滤液质量(g)。
[0209]
储存期间5种发酵乳的sts变化结果见图11。由图11可知,l.plantarum扁鹊君18的脱水收缩能力还是较好的。
[0210]
通过实施例7可知,l.plantarum扁鹊君18在凝乳时间、发酵乳酸度和发酵过程中产酸速度、保水率、活菌数、储存期的酸度变化、储存期的活菌数变化和储存期脱水收缩率变化,均表现出优异的性能,适用于制备酸奶中的应用。
[0211]
实施例8植物乳杆菌扁鹊君18抗氧化能力的确认
[0212]
测定实施例1筛选得到的7种菌株的抑菌能力。
[0213]
8.1羟自由基清除能力
[0214]
取10ml离心管,依次加入0.5ml的水杨酸-乙醇溶液(5mmol/l)、0.5ml的硫酸亚铁 (5mmol/l)、0.5ml的h2o2(3mmol/l)和1ml菌株发酵上清液或菌悬液,混合均匀,双蒸水定容至5ml。37℃恒温孵育15min,4℃、4000rpm离心15min,吸取离心上清,在510nm 处测定吸光度。以加入1ml的1mmol/l抗坏血酸作为阳性对照。实施例1得到的7种菌株及其菌悬液均做上述处理,结果记载于表24中。羟自由基清除能力计算方式如下:
[0215][0216]
式中:ao—无样品的od
510
值;as—有样品的od
510
值;
[0217]
8.2超氧阴离子清除能力
[0218]
取菌株发酵上清液或菌悬液样品0.1ml,加入tris-hcl(ph8.2,150mmol/l)4.5ml,25℃水浴20min,加入0.4ml、1.2mmol/l的邻苯三酚,25℃水浴5min,立即加入2滴8mol/l的 hcl终止反应,取上清液在325nm处测定吸光度(以双蒸水为参比)。实施例1的到的7种菌株
及其菌悬液均做上述处理,结果记载于表24中。超氧阴离子清除能力计算公式如下:
[0219][0220]
式中:ao—无样品的od
325
值;as—有样品的od
325
值。
[0221]
8.3dpph清除能力
[0222]
取1ml菌株发酵上清液或菌悬液与1mldpph无水乙醇溶液(0.2mmol/l)震荡混匀,室温避光反应30min,6000rpm离心10min。吸取离心上清,517nm处测吸光度。等体积无水乙醇代替dpph溶液为空白组,等体积蒸馏水代替样品溶液为对照组。实施例1的到的7种菌株及其菌悬液均做上述处理,结果记载于表24中。dpph清除能力计算公式如下:
[0223][0224]
式中:a1—不含样品的od
517
值;a2—含有样品的od
517
值;a3—空白组的od
517
值。
[0225]
通过表24可知,对羟自由基的清除率,植物乳杆菌扁鹊君18的发酵上清液具有较好的抗氧化性能。对超氧阴离子自由基和对dpph自由基的清除率,植物乳杆菌扁鹊君18的发酵上清液和菌体均具有较好的抗氧化性能。由此证明,植物乳杆菌扁鹊君18可应用于制备抗氧化制品中。
[0226]
表24抗氧化能力的测定结果
[0227][0228]
实施例9、植物乳杆菌扁鹊君18抑菌能力的确认
[0229]
测定实施例1筛选得到的7种菌株的抑菌能力。
[0230]
9.1酸排除
[0231]
将菌株在mrs培养基培养24h,离心获得发酵上清液,测定ph值。然后调节ph值为 4.0、4.5、5.0、5.5、6.0、6.5、7.0。实施例1得到的7种菌株均做上述处理。采用牛津杯琼脂扩散法测定七种菌株发酵上清液的抑菌活性。
[0232]
9.2温度敏感性
[0233]
将7种菌株的发酵上清液分别在80℃和121℃热处理15min,采用牛津杯琼脂扩散法测定发酵上清液的抑菌活性,通过抑菌圈大小分析发酵上清液的温度敏感性。
[0234]
9.3酶敏感性
[0235]
研究7种菌株发酵上清液对胰蛋白酶、蛋白酶k、蛋白酶e、胃蛋白酶和过氧化氢酶的敏感性。将胃蛋白酶溶解于50mmol/l、ph 2.0的na2hpo
4-柠檬酸缓冲液,其他酶溶解于 50mmol/l、ph 7.5的tris-hcl缓冲液。取一定量的酶溶液与菌株的无菌上清液混合均匀,酶
液终浓度10mg/ml,37℃恒温水2h,反应结束后100℃沸水浴5min,使酶完全失活。将灭酶后的溶液用0.1mol/l的hcl或naoh调节反应液ph至发酵上清液初始ph值,6000r/min离心10min,收集上清液。实施例1得到的7中菌株发酵上清液均做上述处理。上清液收集完成后,采用牛津杯琼脂扩散法测定发酵上清液的抑菌活性。其中,对照组为未经过酶处理的发酵上清液。
[0236]
表25抑菌效果
[0237][0238]
通过表25可知,扁鹊君18对大肠杆菌和金黄色葡萄球菌的抑菌性能均高于其他六株菌具有较好的抑菌能力。由此证明,植物乳杆菌扁鹊君18可应用于食品、药品和保健品中,提高抑菌性。
[0239]
实施例10植物乳杆菌扁鹊君18有机酸含量的确定
[0240]
测定实施例1筛选得到的7种菌株的有机酸。
[0241]
将7种菌株分别在mrs培养基中培养24h,分别离心获得发酵上清液,分别经0.22μm 膜过滤后进行高效液相色谱检测。分别配制1-500μg/ml不同浓度的有机酸标准品(草酸、柠檬酸、甲酸、丙酸、焦谷氨酸、苹果酸、羟基苯乳酸、乳酸、醋酸、丁酸和苯乳酸),hplc 检测其峰面积,横坐标为有机酸含量,纵坐标为峰面积,绘制有机酸的标准曲线,根据有机酸标准曲线计算发酵液中有机酸的含量。色谱条件:采用waters e2695高效液相色谱仪和 aminexhpx-87h柱(300mm
×
7.8mm),流动相5mmol/l的稀硫酸溶液,等梯度洗脱,流速 0.5ml/min,检测波长210nm,柱温50℃,进样量20μl。7种菌株有机酸含量的结果如表26 所示。
[0242]
表26有机酸含量测定结果
[0243]
[0244][0245]
根据表26的结果可知,7种菌株发酵上清液中的有机酸主要为乳酸和醋酸。此外,还检测到第三代新型抑菌物质—苯乳酸。扁鹊君18菌株发酵液中发酵上清液中乳酸含量最多,为9.97mg/ml,其次为醋酸2.40mg/ml,苯乳酸的含量为0.046mg/ml。由此证明,扁鹊君18 菌株发酵上清液所产有机酸类抑菌物质含量最高,抑菌能力最佳,进一步利于植物乳杆菌扁鹊君18应用于制备抑菌制品。
[0246]
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1