检测低微生物量生物样本中细菌的引物组合、试剂盒及方法与流程
1.本发明涉及生物技术领域,具体地,涉及检测低微生物量生物样本中细菌的引物组合、试剂盒及方法。
背景技术:
2.现有的研究已充分证明,人体微生物组对人类的健康维持和疾病发生紧密相关。针对16s rrna基因序列的高可变区如v3、v4区进行高通量测序是目前常用且成熟的检测高丰度细菌群的手段,在肠道菌群、口腔菌群、阴道菌群、皮肤菌群等研究中已有广泛应用。然而将16s rrna基因(v3v4)应用于肿瘤组织等样本内细菌群检测的效果却不理想。
3.肿瘤组织内细菌群检测遇到这些挑战:肿瘤组织内的细菌生物量较低,并且在从组织中提取到dna中,属于细菌的dna占比非常低。这些挑战会导致肿瘤组织内的细菌难以检出。现有的16s rrna基因测序(v3-v4)检测低细菌生物量的样本灵敏度有限,不适合对肿瘤组织内细菌群做检测。
技术实现要素:
4.为了解决上述技术问题的中一种,本发明旨在提供一种灵敏度高的肿瘤组织内细菌的检测引物和方法,采用多重特异性引物和多重pcr方法,并结合二代高通量量测序鉴定肿瘤组织内细菌的方法。为了达到该目的,本发明所采用的技术方案如下:
5.本发明第一方面提供一种检测低微生物量生物样本中细菌的引物组合,包括由具有seq id no.1所示核苷酸序列序列的第一上游引物和具有seq id no.2所示核苷酸序列的第一下游引物组成的第一引物对、由具有seq id no.3所示核苷酸序列序列的第二上游引物和具有seq id no.4所示核苷酸序列的第二下游引物组成的第二引物对、由具有seq id no.5所示核苷酸序列序列的第三上游引物和具有seq id no.6所示核苷酸序列的第三下游引物组成的第三引物对、由具有seq id no.7所示核苷酸序列序列的第四上游引物和具有seq id no.8所示核苷酸序列的第四下游引物组成的第四引物对以及由具有seq id no.9所示核苷酸序列序列的第五上游引物和具有seq id no.10所示核苷酸序列的第五下游引物组成的第五引物对。
6.在本发明的中,所述第一引物对、第二引物对、第三引物对、第四引物对和第五引物对分别靶向细菌16s rrna基因的序列的v2、v3、v5、v6和v8区。
7.在本发明的一些实施方案中,各上游引物和下游引物还具有测序通用引物序列,以建立文库,利用高通量测序鉴定低微生物量生物样本中的细菌组成。
8.本发明第二方面提供一种检测低微生物量生物样本中细菌的试剂盒,包括本发明第一方面所述的引物组合。
9.进一步地,所述试剂盒还包括dna提取试剂。在本发明的一些实施方案中,所述dna提取试剂包括裂解试剂,所述裂解试剂包括但不限于ctab、溶菌酶和蛋白酶。
10.更进一步地,所述试剂盒还包括pcr扩增试剂和/或pcr纯化试剂。在本发明的一些
实施方案中,所述pcr扩增试剂包括dna聚合酶。在本发明的一些优选实施方案中,dna聚合酶、mg
2+
和dntp预混在一起。
11.本发明第三方面提供本发明第一方面所述的引物组合在制备基于高通量测序检测低微生物量生物样本中细菌的试剂盒中的应用。
12.本发明第四方面提供一种检测低微生物量生物样本中细菌的方法,包括以下步骤:
13.s1,获得所述低微生物量生物样本的dna样本;
14.s2,利用权利要求1所述的引物组合对所述dna样本进行pcr扩增;
15.s3,利用琼脂糖凝胶电泳检测是否扩增出目标条带,如有,则回收纯化所述目标条带进行高通量测序,
16.s4,将高通量测序数据与细菌16s rrna基因数据库进行比对,鉴定中所述低微生物量生物样本中存在的细菌种类。
17.在本发明的一些实施方案中,所述引物组合在pcr扩增体系中,各引物的终浓度为0.2μm。
18.在本发明的一些实施方案中,所述pcr扩增的程序为:95℃2min;94℃30sec,70℃1min,72℃40sec,35个循环;72℃5min;4℃保持。
19.在本发明中,所述低微生物量生物样本选自包括血液、尿液、组织、细胞的组中的至少一种。
20.在本发明的一些实施方案中,所述组织可以是新鲜获得的组织,也可以为组织的福尔马林固定石蜡包埋(formalin-fixed paraffin-embedding,ffpe)样本。在本发明的一些实施方案中,所述组织可以为正常组织,也可以为肿瘤组织。
21.本发明的有益效果
22.相对于现有技术,本发明取得的有益效果如下:
23.利用本发明的引物组合、试剂盒和方法,能够有效提升低微生物量生物样本中细菌菌群检测的灵敏度和检出率。
24.利用本发明的引物组合、试剂盒和方法,对降解样本具有更高的宽容度,可以有效提升降解样本中的菌群检测合格率。
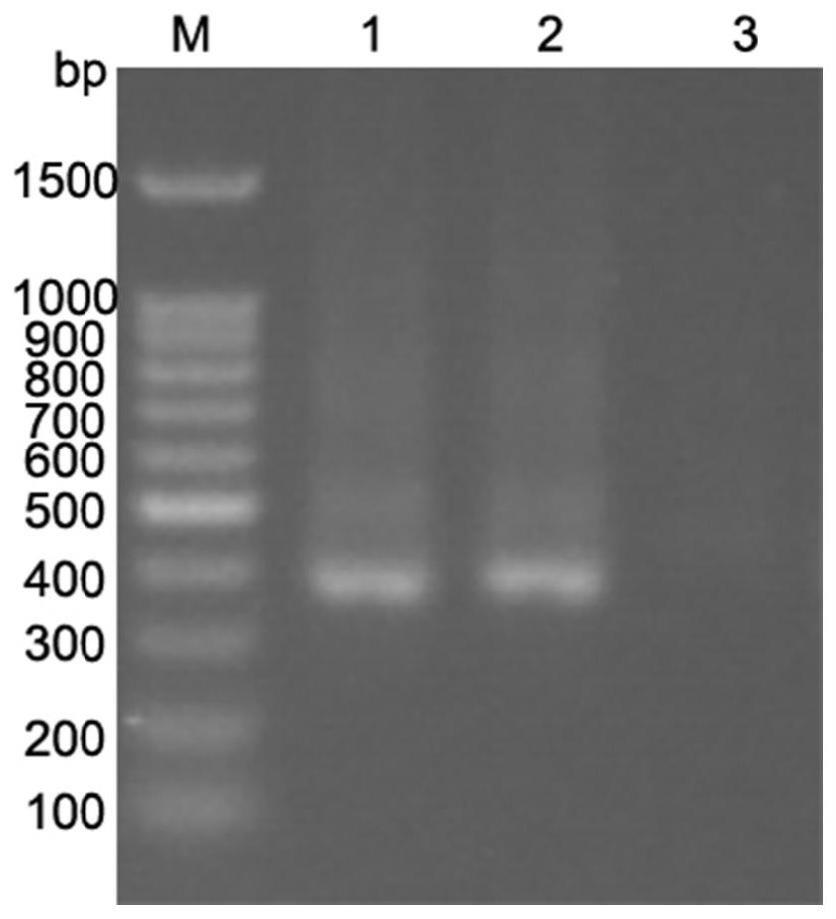
附图说明
25.图1示出了v2、v3、v5、v6、v8单个可变区引物对扩增的结果。m:100bp dna ladder;1:v2区引物对扩增结果;2:v3区引物对扩增结果;3:v5区引物对扩增结果;4:v6区引物对扩增结果;5:v8区引物对扩增结果。
26.图2示出了v2、v3、v5、v6、v8其中2个可变区引物对扩增的结果。m:100bp dna ladder;1:v2v3扩增结果;2:v2v5扩增结果;3:v2v6扩增结果;4:v2v8扩增结果;5:v3v5扩增结果;6:v3v6扩增结果;7:v3v8扩增结果;8:v5v6扩增结果;9:v5v8扩增结果;10:v6v8扩增结果。
27.图3示出了v2、v3、v5、v6、v8其中3个可变区引物对扩增的结果。m:100bp dna ladder;1:v2v3v5扩增结果;2:v2v3v6扩增结果;3:v2v3v8扩增结果;4:v3v5v6扩增结果;5:v3v5v8扩增结果;6:v5v6v8扩增结果;7:v2v5v6扩增结果;8:v2v5v8扩增结果;9:v2v6v8扩
增结果;10:v3v6v8扩增结果。
28.图4示出了v2、v3、v5、v6、v8其中4个可变区引物对扩增的结果。m:100bp dnaladder;1:v1/v2/v3/v4区引物对扩增结果;2:v1/v2/v3/v4区引物对扩增结果;3:v1/v2/v3/v4区引物对扩增结果;4:v1/v2/v3/v4区引物对扩增结果;5:v1/v2/v3/v4区引物对扩增结果。
29.图5示出了v2、v3、v5、v6、v8 5个可变区引物对扩增的结果。m:100bp dna ladder;1:v1/v2/v3/v4/v5区引物对扩增结果。
30.图6示出了v3/v4区引物对扩增的结果。m:100bp dnaladder;1:样本1中v1/v2/v3/v4/v5区引物对扩增结果;2:样本2中v1/v2/v3/v4/v5区引物对扩增结果。
31.图7示出了v2、v3、v5、v6、v8 5个可变区引物对扩增文库的结果。m:100bp dna ladder;1:样本1中v1/v2/v3/v4/v5区引物对扩增文库结果;2:样本2中v1/v2/v3/v4/v5区引物对扩增文库结果;3:阴性对照(ntc)。
32.图8示出了扩增5个可变区引物扩增建库的测序鉴定出的肿瘤组织内属水平的细菌。
具体实施方式
33.除非另有说明、从上下文暗示或属于现有技术的惯例,否则本技术中所有的份数和百分比都基于重量,且所用的测试和表征方法都是与本技术的提交日期同步的。在适用的情况下,本技术中涉及的任何专利、专利申请或公开的内容全部结合于此作为参考,且其等价的同族专利也引入作为参考,特别这些文献所披露的关于本领域中的相关术语的定义。如果现有技术中披露的具体术语的定义与本技术中提供的任何定义不一致,则以本技术中提供的术语定义为准。
34.本技术中的数字范围是近似值,因此除非另有说明,否则其可包括范围以外的数值。数值范围包括以1个单位增加的从下限值到上限值的所有数值,条件是在任意较低值与任意较高值之间存在至少2个单位的间隔。对于包含小于1的数值或者包含大于1的分数(例如1.1,1.5等)的范围,则适当地将1个单位看作0.0001,0.001,0.01或者0.1。对于包含小于10(例如1到5)的个位数的范围,通常将1个单位看作0.1。这些仅仅是想要表达的内容的具体示例,并且所列举的最低值与最高值之间的数值的所有可能的组合都被认为清楚记载在本技术中。
35.术语“包含”,“包括”,“具有”以及它们的派生词不排除任何其它的组分、步骤或过程的存在,且与这些其它的组分、步骤或过程是否在本技术中披露无关。为消除任何疑问,除非明确说明,否则本技术中所有使用术语“包含”,“包括”,或“具有”的组合物可以包含任何附加的添加剂、辅料或化合物。相反,出来对操作性能所必要的那些,术语“基本上由
……
组成”将任何其他组分、步骤或过程排除在任何该术语下文叙述的范围之外。术语“由
……
组成”不包括未具体描述或列出的任何组分、步骤或过程。除非明确说明,否则术语“或”指列出的单独成员或其任何组合。
36.为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
37.实施例
38.以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
39.除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
40.那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
41.下述实施例中未作具体说明的分子生物学实验方法,均按照《分子克隆实验指南》(第四版)(j.萨姆布鲁克、m.r.格林,2017)一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。其他实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
42.实施例1特异性引物的设计
43.发明人根据细菌16s rrna基因序列特征特异性设计5对特异性引物,如表1所示:
44.表1用于快速鉴定肿瘤组织内细菌的5对特异性引物
[0045][0046][0047]
f1和r1扩增16s的v2,f2和r2扩增v3,f3和r3扩增v5,f4和r4扩增v6,f5和r5扩增v8。
[0048]
利用多重pcr扩增技术,上面5对引物能够同时扩增和构建出16s的5个可变区(v2、v3、v5、v6、v8)的扩增文库,然后进行二代测序鉴定肿瘤组织内的细菌组成(引物上设计测序所需的通用引物)。
[0049]
f端5条引物需要进行预混,引物稀释到5μm,各取20μl混合在一起,混合后每个引物为1μm,r端5条引物需要进行预混,引物稀释到5μm,各取20μl混合在一起,混合后每个引物为1μm。
[0050]
上述引物可以制备成试剂盒用于检测肿瘤组织内细菌。
[0051]
实施例2引物有效性验证
[0052]
为了测试5对引物扩增16s rrna基因的有效性,以粪便dna为样本,使用实施例引
物对分别对16s rrna基因的v2、v3、v5、v6、v8的单个可变区、2个可变区、3个可变区、4个可变区随机组合,以及5个可变区进行扩增。以通用的v3v4引物对(341f-cctacgggnggcwgcag,805r-gactachvgggtatctaatcc)扩增16s rrna基因作为阳性对照,目标片段约在600bp(图6)。单个可变区、2个可变区、3个可变区、4个可变区随机组合,以及5个可变区的扩增结果分别如图1~图5所示,阳性对照的扩增结果如图6所示。结果显示,5个可变区的引物对不管是单独扩增还是组合扩增都能成功扩增出16s rrna基因的目标条带,并且扩增的可变区越多,扩增得到的目的条带就越亮。
[0053]
实施例3肿瘤组织内细菌的检测
[0054]
1.多重pcr反应体系的准备:
[0055]
(1)反应液:2
×
phanta max master mix;
[0056]
(2)引物液:正向引物和反向引物混合后每个单引物1μm。
[0057]
用上述反应体系按以下方法对肿瘤组织内细菌进行鉴定。
[0058]
2.肿瘤组织dna提取:
[0059]
1)离心管中加入适量珠,取入适量样本(50~100mg)。
[0060]
2)向装有样品的离心管加入1ml 65℃预热的ctab提取液,50μl溶菌酶,20μl蛋白酶,研磨仪设置50hz,研磨4min,65℃水浴60min。
[0061]
3)水浴期间摇匀2~3次,保证裂解充分。取出后,冷却至室温。
[0062]
4)用移液器取管内溶液至新的2.0ml无菌离心管中。
[0063]
5)加入800μl氯仿-异戊醇(24:1),上下颠倒100次,12000rpm离心20min。
[0064]
6)吸取600μl上清液至新的2ml无菌离心管,加入等体积氯仿-异戊醇(24:1),上下颠倒100次,12000rpm离心20min。
[0065]
7)吸取400μl上清液至新的1.5ml无菌离心管中,加入上清液体积的2/3体积的异丙醇和1/10体积的乙酸钠(3m),充分混匀,-20℃放置1h。
[0066]
8)12000rpm离心10min,弃上清,瞬时离心,用枪头吸弃多余液体,室温晾干10min至dna沉淀呈半透明状。
[0067]
9)加入50-100μl含10mg/ml rnase的无菌ddh2o,溶解dna沉淀,37℃水浴锅消化1h后,取上清液转移至另一支离心管中作为模板dna,余下样品液保存在-20℃冰箱。
[0068]
3.多重pcr扩增反应:
[0069]
(1)多重pcr扩增体系如表2所示。
[0070]
表2多重pcr扩增体系
[0071]
组分体积(μl)待扩增样本dna7.5引物混合物52
×
phanta max master mix12.5总体积25
[0072]
1)取出2
×
phanta master mix解冻并离心;
[0073]
2)计算好所需体积,与混合后引物混合于八联管中,涡旋离心,置于冰箱4℃备用;
[0074]
3)准备一个新的96孔板,将酶与引物混合物加入96孔板;
[0075]
4)加入对应待扩增样本dna,封板;
[0076]
5)进行pcr反应,程序为:95℃2min;94℃30sec,70℃1min,72℃40sec,35个循环;72℃5min;4℃保持。
[0077]
4.pcr产物纯化:
[0078]
1)向25μl的pcr产物中加入40μl 10mm tris-hcl,再加入50μl磁珠吹打混匀15次,室温放置5min;
[0079]
2)将上述离心管置于磁力架5min,至液体澄清为止,弃上清;
[0080]
3)保持离心管在磁力架上,加入200μl新鲜配制的80%乙醇,注意不要扰动磁珠;放置30sec,吸弃上清;
[0081]
4)再次加入200μl新鲜配制80%乙醇,30sec后弃上清;
[0082]
5)将离心管留在磁力架上,室温晾干3-5min;
[0083]
6)加入50μl 10mm tris-hcl,吹打混匀15次,室温放置5min;
[0084]
7)将离心管置于磁力架5min,直至液体澄清。转移上清(文库)至新的96孔板中,于-20℃保存文库。
[0085]
5.扩增结果判定:
[0086]
将多重pcr产物跑琼脂糖凝胶电泳,如图7所示,主片段集中在450~480bp左右(含有测序通用引物序列)。结合novaseq 6000pe250测序,以及和16s rrna基因数据库比对,即可鉴定出肿瘤组织中存在的细菌种类,结果如图8所示。
[0087]
由图8可知,五对引物组合在一起可以鉴定出肿瘤组织内细菌的群落构成。
[0088]
实施例4扩增合格率检测
[0089]
为了进一步验证本发明实施例设计的引物的灵敏度和检出率,发明人分别用v2、v3、v5、v6、v8的单个可变区引物对,2个可变区、3个可变区、4个可变区引物对随机组合,以及5个可变区引物对组合对10份肿瘤组织样本进行扩增,同时,v3v4引物对扩增作为实验对照。
[0090]
以能扩增出目标条带作为扩增合格的标准结果,pcr产物利用琼脂糖凝胶电泳进行检测,结果如表3所示。
[0091]
表3 5个区域的引物扩增肿瘤组织内细菌菌群的合格率
[0092][0093][0094]
从表3中可以看出,v2、v3、v5、v6、v8五对引物组合在一起进行肿瘤组织样本的细菌检测具有更高的灵敏度和扩增合格率。
[0095]
实施例5降解肿瘤组织样本的检测
[0096]
发明人使用10份石蜡包埋肿瘤组织样本(ffpe)的dna(降解程度各异),分别用v2、v3、v5、v6、v8 5个可变区组合在一起的引物对,以及v3v4引物对扩增降解样本中的细菌序
列,以能扩增出目标条带作为扩增合格的标准。
[0097]
扩增结果如表4所示。
[0098]
表4 5个可变区引物对组合在一起扩增ffpe样本内细菌菌群的合格率
[0099]
扩增所用引物扩增合格率(%)v2,v3,v5,v6,v8五对引物对组合在一起70%v3v4引物对30%
[0100]
从表中数据可以看出,v2、v3、v5、v6、v8五对引物组合在一起进行ffpe样本的细菌检测具有更高的dna降解宽容度和扩增合格率。
[0101]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1