蛋白MtNPHE1在培育苜蓿中的应用
蛋白mtnphe1在培育苜蓿中的应用
技术领域
1.本发明涉及生物技术领域,更具体地说,特别涉及一种蛋白mtnphe1在培育苜蓿中的应用。
背景技术:
2.磷素和氮素是植物生长所必需的大量元素,对植物的生长发育和农作物增产具有重要作用。磷素以无机态的形式被植物吸收,但由于无机磷易与钙离子、镁离子等金属离子形成沉淀或被被土壤颗粒固定,磷在土壤中难以扩散,植物时常会遭受低磷胁迫。低磷胁迫不仅直接影响植物生长,还会影响植物对氮素的吸收利用,如影响豆科植物结瘤固氮。苜蓿是一类豆科植物,能够在根部形成根瘤进行生物固氮,磷素的缺乏严重抑制苜蓿的生长发育。
3.为了提高农作物产量,磷肥和氮肥的施用量逐年增加,但是由于磷的自身特点,即使向土壤中施用大量磷肥,土壤中植物可吸收利用的无机磷浓度仍然很低。因此,挖掘参与植物磷吸收和利用的关键基因,改良作物吸收和利用磷的能力是提高作物氮磷营养效率和产量最直接有效的途经,通过分子育种改良植物,不仅能够提高植物的产量和品质,对于环境保护也具有重要意义。
技术实现要素:
4.本发明的目的在于提供一种蛋白mtnphe1在培育苜蓿中的应用,以克服现有技术所存在的缺陷。
5.为了达到上述目的,本发明采用的技术方案如下:
6.蛋白mtnphe1在培育苜蓿品种中提高苜蓿磷积累、调控苜蓿生长发育或提高苜蓿产量的应用。
7.进一步地,所述mtnphe1蛋白来自苜蓿,是如下(1)或(2)或(3)或(4)或(5)所示的蛋白质:
8.(1)如序列2所示的氨基酸序列组成的蛋白质或包含该氨基酸序列的蛋白质;
9.(2)包含序列2所示氨基酸序列带有标签的蛋白质;
10.(3)序列2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质;
11.(4)与序列2所示的氨基酸序列具有75%或75%以上同源性的蛋白质;
12.(5)序列2所示氨基酸序列可人工合成或基因表达而成。
13.进一步地,所述蛋白质由序列1所示的cds序列编码而来。
14.进一步地,mtnphe1核酸序列是如下(a1)或(a2)或(a3)或(a4)所示的序列:
15.(a1)如序列1所示的碱基序列组成的cds或包含该序列的核酸;
16.(a2)包含序列1所示cds序列的核酸序列;
17.(a3)序列1所示的cds序列或基因组dna;
18.(a4)与序列1所示的核酸序列具有75%或75%以上的同源性的cds或基因组dna。
19.蛋白mtnphe1相关的生物材料在在培育苜蓿品种中提高苜蓿磷积累、调控苜蓿生长发育或提高苜蓿产量的应用。
20.进一步地,所述生物材料如下(b1)至(b7)中的任一种:
21.(b1)编码序列2所示氨基酸序列的核酸分子或与序列1所示核酸序列同源性75%或75%以上的核酸分子;
22.(b2)含有(b1)所述核酸分子的载体;
23.(b3)含有(b1)所述核酸分子的微生物;
24.(b4)含有(b2)所述载体的微生物;
25.(b5)含有(b1)所述核酸分子的转基因植物;
26.(b6)含有(b2)所述载体的转基因植物;
27.(b7)含有(b1)所述核酸序列或部分序列,用于编辑(或构建crispr/cas9材料)苜蓿所用重组载体/重组微生物/重组植物细胞系。
28.与现有技术相比,本发明的优点在于:本发明提供的一种蛋白mtnphe1在培育苜蓿中的应用,通过蛋白mtnphe1在培育苜蓿中,改良作物吸收和利用磷的能力,提高作物氮磷营养效率和产量,通过分子育种改良植物,不仅能够提高植物的产量和品质,对于环境保护也具有重要意义。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
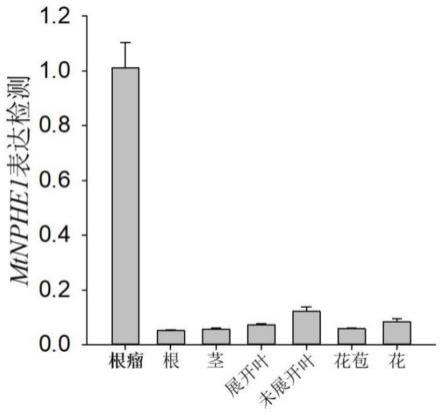
30.图1是本发明mtnphe1基因组织表达分析图。
31.图2是本发明中表型检测图。
32.图3是本发明中无机磷含量测定图。
具体实施方式
33.下面结合附图对本发明的优选实施例进行详细阐述,以使本发明的优点和特征能更易于被本领域技术人员理解,从而对本发明的保护范围做出更为清楚明确的界定。
34.该实施例中涉及到的实验方法均为常规方法,试剂耗材订购于试剂耗材公司。
35.1、苜蓿mtnphe1基因的克隆
36.利用蒺藜苜蓿网站(ensembl plants(https://plants.ensembl.org/index.html),通过基因号mtr_1g093080检索mtnphe1基因的cds序列,该序列为a17生态型背景,利用该序列在网站https://medicagohapmap2.org/比对r108生态型背景的mtnphe1基因cds序列。分别在该cds序列的5’端和3’端设计引物primer1和primer2,以野生型r108的cdna为模板,扩增r108生态型中mtnphe1基因的cds序列。
37.扩增体系(50μl):5μl 10
×
taq buffer,0.5μl extaq,4μl dntps,2.5μl引物primer1,2.5μl引物primer2,35μl ddh2o,1μl模板。
38.primer1:5
’‑
atgcagcgtt ttaaaatggatt-3’39.primer2:5
’‑
atagccaggg gaagtatttgta-3’40.扩增程序:95℃预变性5min,95℃变性30s,55℃退火30s,72℃延申1min 20s,扩增35个循环,72℃延申10min。
41.2、构建过表达载体
42.构建mtnphe1基因的过量表达材料所使用的过表达载体为pcambia3301,以野生型r108的cdna为模板,用带有接头的引物primer3和primer4扩增mtnphe1基因的cds序列,使回收的目标cds两端带有接头(接头即载体上序列,位于bglii和ncoi酶切位点两端)。同时用bglii和ncoi两个内切酶酶切载体,使载体线性化。用同源重组的方法将带有接头的cds序列连接到线性化载体上。
43.primer3:5
’‑
gaacacgggggactcttgaccatgcagcgttttaaaatggatt-3’44.primer4:5
’‑
agaaatttaccctcagatctaccatatagccaggggaagtatttgta-3’45.其中,小写字母为接头序列
46.克隆基因:克隆mtnphe1基因带有接头cds序列,扩增体系和程序同上述1“苜蓿mtnphe1基因的克隆”扩增体系和程序一致。
47.载体线性化体系:5μl10
×
quickcut buffer,1μl quickcut bglii,1μl quickcut ncoi,质粒≤1μg,ddh2o补至50μl。
48.载体线性化条件:37℃保温5min。
49.回收目的基因和线性化载体步骤如下:
50.(1)分别切取带有mtnphe1基因cds条带和线性化载体pcambia3301条带的琼脂糖凝胶,放入干净离心管中;
51.(2)加入三倍体积的gsb,放于干净ep管中,于55℃溶胶至凝胶全部融化。
52.(3)将融化后的胶加入离心柱中,静置1min,10,000g离心1min,弃流出液。
53.(4)向离心柱中加入650μl wb(wash buffer),10,000g离心1min,弃流出液。
54.(5)10,000g离心1-2min,彻底去除残留的wb。
55.(6)将离心柱置于干净的离心管中,开盖静置1min,在离心柱中央加入30-50μlddh2o,静置1min。
56.(7)10,000g离心1min,将洗脱dna放于-20℃保存。
57.连接体系:5μl 2
×
cloning master mix,10-500ng线性化载体,30-1500ng目的基因的回收产物,用ddh2o将反应体系补至10μl。
58.连接条件:将体系混匀后放于50℃空气浴中连接30min。
59.3、转基因苜蓿的获得
60.将过表达载体35s:mtnphe1转化农杆菌eha105,方法参照北京华越洋生物技术有限公司农杆菌转化方法。参照已发表文章中的侵染方法(cosson,v.,durand,p.,d’erfurth,i.,kondorosi,a.and ratet,p.(2006).medicago truncatula transformation using leaf explants.methods mol.biol.343:115-127),用重组农杆菌侵染蒺藜苜蓿野生型r108,以r108叶片或子叶和下胚轴为侵染材料,利用植物细胞的脱分化和再分化,通过草铵膦抗性筛选获得转基因株系:35s:mtnphe1-1和35s:mtnphe1-2。
61.4、mtnphe1在不同组织的表达情况分析
62.将苜蓿根瘤、根、茎、未展开叶、展开叶、花苞和花分别取材,提取rna,方法参照普洛麦格rna提取试剂盒说明书。将1000ng rna反转为cdna,方法参照赛默飞反转录试剂盒说明书。以稀释5倍的cdna为模板,以primer5和primer6为引物,以mtactin11为内参基因,用荧光定量pcr检测mtnphe1基因在不同组织中的表达情况,以此指示mtnphe1发挥主要作用的部位,检测结果如图1所示,相对于其它组织,mtnphe1在根瘤中表达丰度极高,这说明mtnphe1在根瘤中发挥重要作用。
63.primer5:5
’‑
gttgcacaagcgattcttga-3’64.primer6:5
’‑
aggacaaaaggtgctgctgt-3’65.mtactin11-f:5
’‑
caaaagatggcagatgctgaggat-3’66.mtactin11-r:5
’‑
catgacaccggtatgacgaggtcg-3’67.荧光定量pcr体系:1μl primer5(浓度为1μm),1μl primer6(浓度为1μm),1μl cdna,10μl定量酶,7μl ddh2o。
68.同时利用引物mtactin11-f和mtactin11-r按照相同体系检测各组织材料中内参基因mtactin11的表达情况。
69.反应程序:95℃预变性10min,95℃变性15sec,60℃退火1min,60℃延伸1min,40个循环。
70.5、转基因苜蓿表型检测
71.将r108、35s:mtnphe1-1和35s:mtnphe1-2种子在砂纸上打磨去掉硬实,平铺于湿润滤纸上,放在4℃冰箱水合2天,之后放于光照培养箱中继续生长3天至两片子叶展开。将幼苗下胚轴用海绵缠绕后固定于水培板上,放于水培液中继续培养,放于光照培养箱中生长一周,拍照,表型如图2a所示。同时将子叶展开的幼苗种于土中,放于温室继续生长一个月,拍照,表型如图2b所示。将水培幼苗用镊子夹出,吸干水分放至于称量纸上,放于80℃烘箱烘干至恒重,用分析天平称量干重。检测结果显示,35s:mtnphe1-1和35s:mtnphe1-2过表达材料生物量显著高于野生型对照(图2c),这说明提高mtnphe1的表达能够提高苜蓿生物量。光照培养箱与温室培养条件:光周期为16h(光照)/8h(黑暗),湿度为70%,温度为24℃。
72.水培液配方:2.5mm kno3,0.25mm cacl2,1mm mg2so4,0.5mm kh2pho4,0.03mm h3bo3,0.005mm mnso4,0.001mm znso4,0.001mm cuso4,0.0007mm na2moo4,0.1m m feso4,0.1mm edta-na2,溶剂为单蒸水,用koh调节ph至5.95。
73.土培土壤配方:进口土、蛭石和东北黑土按比例1:1:1混匀,分装于花盆中。
74.6、转基因苜蓿无机磷含量测定
75.(1)分别将r108、35s:mtnphe1-1和35s:mtnphe1-2在滤纸上水合2天,放于光照培养箱继续生长3天至两片子叶展开,然后整株取材,每个材料至少取三个生物学重复,冻于液氮中保存。
76.(2)提前准备1.5ml ep管,向管中加入100μl无机磷提取液。
77.(3)将(1)中材料在冷冻状态下研磨成粉末,用预冷过的钢勺取大约100mg粉末于(2)的ep管中,并称量粉末鲜重,用振荡器混匀,向ep管中加入900μl冰醋颠倒混匀。42℃水浴反应30min。在4℃条件下,1,2000rpm离心15min。
78.(4)吸取步骤(3)得到的上清液液250μl,加入到350μl显色液中,颠倒混匀,同时制备标准曲线,42℃水浴反应30min。
79.(5)吸取步骤(4)中的反应液,用分光光度计测定820nm的波长和浓度。
80.结果如图3所示,35s:mtnphe1-1和35s:mtnphe1-2过表达材料无机磷含量显著高于野生型对照,说明提高mtnphe1的表达能够提高苜蓿磷积累。
81.无机磷提取液配方(1l):10ml 1m tris-hcl(ph 8.0),2ml 0.5m edta(ph8.0),5.844g nacl,700μlβ-巯基乙醇,10ml 100mm pmsf(现配现用),用ddh2o定容。
82.显色液配方(1l):将25g钼酸铵溶于400mlddh2o中,将1.25g偏钒酸铵溶于300ml煮沸的ddh2o中,冷却后加入250ml浓硝酸,将钼酸铵溶液加入偏钒酸铵溶液中,缓慢倒入并不断搅拌,用ddh2o定容,遮光常温保存。
83.虽然结合附图描述了本发明的实施方式,但是专利所有者可以在所附权利要求的范围之内做出各种变形或修改,只要不超过本发明的权利要求所描述的保护范围,都应当在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1