一株羊肠道病毒的分离鉴定方法及应用
本发明涉及病毒分离鉴定备,尤其涉及一株羊肠道病毒的分离鉴定方法及应用。
背景技术:
1、羊肠道病毒(caprineenterovirus,cev)属于小rna病毒科肠道病毒属成员,是一种羊的新发传染病病原体。在临床上以消化道和呼吸道症状为主要特征,某些发病羊群呈现严重腹泻、高热、流涎,甚至造成繁殖障碍。该病毒是匈牙利学者于2012年首次从健康绵羊的粪便中测定了tb4-oev株的基因组序列,2014年日本学者仅从腹泻山羊粪便内检测到cev基因序列,2016年泰国也从腹泻山羊上检测到cev基因序列,但是均未分离到病毒。2014年,王明月等从腹泻山羊病例中,利用山羊腹泻粪便接种vero细胞的方法分离出肠道病毒cev-jl14,首次确认了羊群中存在的肠道病毒感染;后续利用同样方法分离出的病毒株包括:2020年,王汝都等人分离鉴定的hen-d1-37、hen-d2-57、zk/2018株;林倩等人(2020)分离的6株山羊肠道病毒jl-ls34、jl-ls127、jl-ls165、ji-ls174、nmg-f37、sd-s68和1株绵羊肠道病毒nx-dr26,其中nx-dr26为国内分离获得的首株绵羊肠道病毒株。
2、对我国几个省的羊群cev调查结果表明,cev的感染率为13.54%-71.19%,有逐年增加的趋势,且绵羊感染率高于山羊。也发现cev与牛病毒性腹泻(bvdv)、边界病毒(bdv)、小反刍兽疫病毒(pprv)的有混合感染情况,导致羊的死亡率增高。至今鉴定的cev存在ev-f和ev-g种(包含ev-g1、ev-g5、ev-g7、ev-g20、ev-f1类型),发病率和死亡率因毒株类型不同差异较大。zk/2018株分离毒株经消化道、呼吸道、肌肉注射感染羔羊的发病率和死亡率分别达4/4和2/4、2/4和0/4、4/4和0/4。目前还不完全清楚我国cev有哪些种和亚种,以及各种甚至各亚种毒株间的抗原性和致病性如何,以待进一步研究。
3、病原分离鉴定是最终确诊临床感染病原经典方法,同时也是开启病毒生物学特性、诊断技术和疫苗等研究的首要工作。采用高效的病毒分离方法是分离鉴定毒株的关键,尽管使用粪便研磨物接种细胞分离到了cev,但是粪便中微生物多,易污染,分离成功率低。
技术实现思路
1、1.要解决的技术问题
2、本发明的目的是为了解决现有技术中尽管使用粪便研磨物接种细胞分离到了cev,但是粪便中微生物多,易污染,分离成功率低的问题,而提出的一株羊肠道病毒的分离鉴定方法及应用。
3、2.技术方案
4、为了实现上述目的,本发明采用了如下技术方案:
5、一株羊肠道病毒的分离鉴定方法,包括以下步骤:
6、步骤1:组织样品处理及核酸提取,将采取的死亡羊少许淋巴组织和肠道组织混合研磨,加入适量灭菌石英砂充分研磨,用0.01mol/l pbs溶液、ph值7.4,制成1:3-1:5悬液,反复冻融3次,8000rpm离心10min,取上清提取核酸;
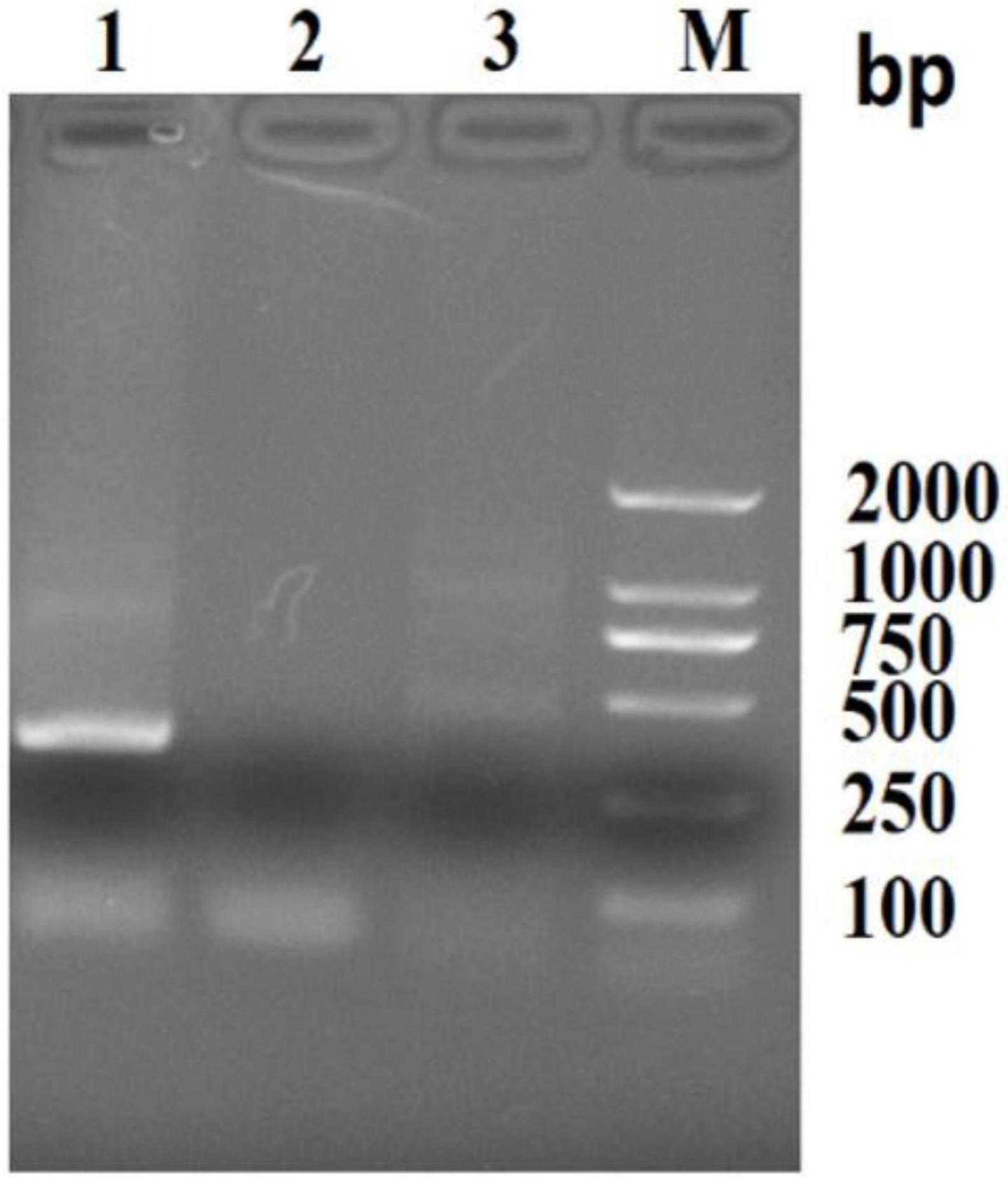
7、步骤2:rt-pcr扩增,以提取的病毒基因组rna为模板,使用实验室常用检测小反刍兽疫病毒(pprv)、口蹄疫病毒(fmdv)和牛病毒性腹泻病毒(bvdv)的pcr引物进行rt-pcr扩增,以提取的病毒基因组rna为模板,用引物分别进行rt-pcr扩增,用1.5%的琼脂糖凝胶电泳检测pcr扩增产物,按照dna片段胶回收试剂盒纯化回收目的条带,将纯化产物使用扩增引物进行测序;
8、步骤3:病毒分离,利用rna转染易感细胞的方法分离病毒;
9、步骤4:测序鉴定,待细胞出现明显病变后,取第3代细胞培养物和原始组织研磨物各1ml,各加入2ml的trizol溶液,混匀密封,低温条件下寄送测序公司进行宏基因组测序;
10、步骤5:序列比对分析,将测定的病毒全长与家畜肠道病毒各亚种的代表毒株序列建立遗传演化系统进化发生树,确定测定的毒株序列。
11、优选地,所述步骤1中按照e.z.n.a. rna kit i的说明书提取rna,其中e.z.n.a. rna kit i购自omega bio-tek公司。
12、优选地,所述步骤2中pcr反应体系为:2×one step mix 12.5μl,上下游引物(10mm)各1.5μl,one step enzyme mix 1μl,模板rna 3μl,灭菌蒸馏水5.5μl,总反应体系25μl;反应条件为:50℃30min,94℃3min;94℃30sec,57℃30sec,72℃1min,共35个循环;最后72℃5min。
13、优选地,所述步骤2中测序委托北京擎科新业生物技术有限公司完成。
14、优选地,所述步骤3中rna转染易感细胞方法的具体步骤为:
15、s3.1:转染细胞的准备,转染前一天,将bhk-21细胞按照1-2×105cells/孔接种至6孔细胞培养板中;
16、s3.2:将步骤1中提取的临床组织总rna进行浓度测定,取20μl lipofectamine2000与250μl opti-mem培养基混合后室温下孵育5min,期间将约2ug总rna与250μl opti-mem培养基混匀,并使用opti-mem培养基洗涤6孔板中单层细胞2次,待lipofectamine 2000孵育5min后加入配制的总rna,混匀后缓慢滴加到细胞中,连续培养5h,每间隔1h摇一次,之后补加2ml细胞培养液,连续观察2-3d;之后,反复冻融2次,按照10%的接毒量传至3-5代,观察细胞的病变情况。
17、优选地,所述bhk-21细胞株利用细胞培养液保存,其中细胞培养液为含10%胎牛血清(fbs)、1%双抗的mem培养基,细胞维持液为含1%双抗的mem培养基。
18、优选地,所述步骤4中的混合液在低温条件下寄送华南农业大学进行宏基因组测序。
19、优选地,所述步骤5中家畜肠道病毒各亚种的代表毒株主要为猪肠道病毒和牛、羊肠道病毒,其中猪肠道病毒主要为ev-g种,包括20个血清型,牛、羊肠道病毒主要为ev-e和ev-f种,分别包括5个和8个血清型。
20、本发明还提出了一株羊肠道病毒,该病毒为cev-g类型病毒,且命名为jsnt/1/2022。
21、本发明还提出了一株羊肠道病毒的应用,使用该毒株进行兔抗血清的制备。
22、3.有益效果
23、相比于现有技术,本发明的优点在于:
24、(1)本发明中,分离方法极大的减少了对临床组织样品的依赖,同时也减少了使用系列类型的血清中和试验的方式来鉴定病毒的繁琐工作;另外,结合宏基因组测序技术,既可快速的获得病毒的全基因组序列,更能证明分离病毒的纯净性,因此利用病毒核酸的感染性,转染细胞分离病毒是一种更为高效的方法,值得推广应用。
25、(2)本发明中,充分利用了ev核酸具有感染性的特点,将病毒核酸转染bhk-21细胞,待出现cpe后使用宏基因组测序、电镜技术以及免疫实验动物制备血清的多种手段证明成功分离到一株cev。
- 还没有人留言评论。精彩留言会获得点赞!