一种AP2/ERF转录因子及其编码基因和应用
一种ap2/erf转录因子及其编码基因和应用
技术领域
1.本发明涉及分子生物学技术领域,尤其涉及一种ap2/erf转录因子及其编码基因和应用。
背景技术:
2.铁皮石斛(dendrobium officinale kimura et migo)是兰科(orchidacea)石斛属(dendrobium sw.)多年生的附生草本植物,它不仅是一种观赏性植物,也是我国传统的珍稀药用植物。研究表明,萜类化合物是铁皮石斛挥发性物质的主要成分,铁皮石斛的主要药用成分石斛碱也是萜烯衍生物。因此,萜烯代谢的研究在铁皮石斛的次生代谢中尤为重要。
3.在整个萜类代谢途径中,由于萜类合成酶(tps)是萜类化合物合成的直接催化者,才使得植物能够合成并释放出种类丰富、结构复杂的萜类化合物,即萜类合成酶是萜类物质生物合成过程中的关键酶类。转录因子对合成基因的转录激活是植物次生代谢最为重要的调节环节之一,其通过激活植物次生代谢合成途径中关键功能基因的表达,可有效控制次生代谢产物的合成积累。目前,已在长春花、拟南芥、玉米、甜橙等植物中发现了参与萜类代谢调控相关的转录因子,包括ap2类、wrky类、锌指类、bhlh类等。在甜橙中,cittps16主要催化e-香叶醇的积累,而转录因子citerf71可以通过转录激活cittps16的表达,进而调控甜橙果实e-香叶醇合成。
4.ap2/erf转录因子家族是植物中最大的转录因子家族之一,该家族的每个成员都包含一个典型的ap2结构域。许多植物具有超过100个ap2/erf转录因子家族成员。目前,对铁皮石斛中挥发性萜类合成相关的ap2/erf转录因子的研究还处于起步阶段,关于其对萜类合成途径中关键基因的调控作用还不明确。
技术实现要素:
5.本发明的主要目的在于提供一种能够调控铁皮石斛萜类合成的ap2/erf转录因子及其编码基因和应用。
6.为实现上述目的,本发明提供了一种ap2/erf转录因子,其氨基酸序列如seq id no.1所示。以下记作转录因子doap2/erf89。
7.本发明还提供一种编码上述的ap2/erf转录因子的基因,其全长核苷酸序列如seq id no.2所示,其编码区核苷酸序列如seq id no.3所示。
8.本发明还提供一种含有上述的基因的表达载体。
9.本发明还提供一种含有上述的表达载体的宿主菌。
10.本发明还提供一种上述的转录因子或上述的基因在调控铁皮石斛萜类合成上的应用。
11.进一步地,所述应用通过所述转录因子或所述基因激活铁皮石斛dopae基因启动子。
12.本发明的有益效果体现在:
13.本发明发现一种参与铁皮石斛挥发性萜类合成调控的ap2/erf转录因子doap2/erf89,通过酵母单杂技术、双荧光素酶试验,证明doap2/erf89能够结合到dopae的启动子区域,激活dopae启动子的表达,增强dopae启动子活性,促进萜类的合成,在调控铁皮石斛萜类合成中起关键作用。本发明为转录因子doap2/erfs的研究提供了理论基础,为进一步揭示铁皮石斛萜类合成的转录调控机制提供思路和依据。
附图说明
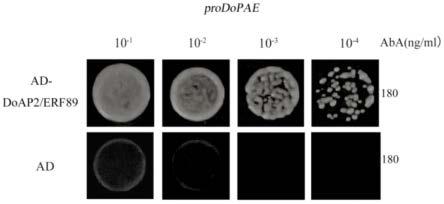
14.图1为铁皮石斛ap2/erf蛋白的进化树分析。
15.图2为体外重组dopaes蛋白的gc-ms分析。
16.图3为doap2/erfs与dopaes共表达分析。
17.图4为doap2/erf89的亚细胞定位。
18.图5为酵母单杂交验证doap2/erf89与dopaes互作。
19.图6为荧光素酶互补成像分析转录因子对启动子的调控作用。
20.图7为doap2/erf89瞬时转化铁皮石斛类原球茎萜类分析。
具体实施方式
21.下面结合实施例对本发明作进一步描述:
22.以下实施例所使用的各种原料和设备,如未作特别说明,均为本领域公知的市售产品。
23.实施例1:ap2/erf转录因子筛选
24.使用数据库plant cis-acting elements(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和plant cis-acting regulatory dna elements(https://www.dna.affrc.go.jp/place/?action=newplace)分析dopaes启动子区域可能存在的顺式作用元件。进行本地建库对于拟南芥ap2/erf的cds(编码区)序列,鉴定到候选doap2/erf基因111个。将111个doap2/erfs与dopae s进行相关性网络分析和基因共表达分析,最终筛选出转录因子doap2/erf89,其氨基酸序列如seq id no.1所示。
25.实施例2:转录因子doap2/erf89的编码基因的核苷酸序列
26.植物rna提取试剂盒提取铁皮石斛类原球茎的rna;使用反转录试剂盒(全式金one-step gdna removal and cdna synthesis supermix)按照说明将rna反转录合成cdna,扩增得到doap2/erf89的编码基因的cds(编码区)完整序列,用primer premier 5.0软件设计全长引物为:
27.doap2/erf89-f1:atggtgactgtgagagaggagatgc
28.doap2/erf89-r2:tcacatcatgatttcttgatctccc
29.以cdna为模板,进行pcr扩增,反应体系如下:
30.表1pcr扩增反应体系与反应条件
[0031][0032]
doap2/erf89的核苷酸如seq id no.1所示,其编码基因的全长核苷酸序列如seq id no.2所示,其编码区核苷酸序列如seq id no.3所示。
[0033]
实施例3:doap2/erf89的亚细胞定位
[0034]
将doap2/erf89的编码基因,转化pmd18-t载体,提取质粒,进行双酶切,反应条件为37℃恒温反应3h。使用1%琼脂糖凝胶电泳分离目的片段,使用试剂盒(sanprep柱式dna胶回收试剂盒,生工生物工程(上海)股份有限公司)对目的片段和载体(pcambia1300,pdr196)进行胶回收。将得到的pcambia1300-doap2/erf89质粒转化农杆菌gv3101,菌落pcr鉴定。
[0035]
农杆菌转化步骤如下:
[0036]
(1)从-80℃取出保存的感受态农杆菌于冰上融化;
[0037]
(2)每100μl感受态加1μg质粒dna混匀,依次于冰上静置5min、液氮5min、37℃5min、冰浴5min;
[0038]
(3)加入700μl无抗生素的lb液体培养基,于28℃振荡培养2~3h;
[0039]
(4)5000rpm离心三分钟收集菌,留取50μl左右的上清轻轻吸打重悬菌块涂布于含相应抗生素的lb平板上,倒置放于28℃培养箱培养2~3天
[0040]
(5)挑单菌落培养并鉴定,鉴定正确的菌液每300μl加入50%甘油700μl置于-80℃保存。
[0041]
将含有目的基因的农杆菌置于含有50mg/l卡那霉素和50mg/l利福平的lb液体培养基扩大培养。待菌液od
600
=0.6-0.8时,4500r/min,4℃离心10min,收菌。用侵染缓冲液(1/2ms,1%蔗糖,0.5mmol/l mgcl2,200μmol/l乙酰丁香酮,10mmol/l乙磺酸和0.01%silwett-77)悬浮菌体,28℃避光静置约3h。
[0042]
(1)利用改良聚乙二醇法将融合表达载体dopaes-gfp转入从拟南芥叶片中获得的原生质体,以pcambia1304-gfp空载体作为对照。
[0043]
表2酶切反应体系与反应条件
[0044][0045]
表3连接反应体系与反应条件
[0046][0047]
(2)选取约1cm2新鲜洋葱鳞片下表皮,浸入农杆菌悬浮液,暗培养30min后用滤纸吸取多余的液体,放置在共培养培养基(1/2ms,1%蔗糖,0.03%水解酪蛋白,0.28%脯氨酸,10μmol/l 2,4-d,2μmol/l 6-ba,200μmol/l乙酰丁香酮和0.8%琼脂)上,22℃的暗培养20h-24h。
[0048]
将瞬时表达的拟南芥原生质体和洋葱鳞片下表皮置于激光共聚焦显微镜下扫描拍摄,观察gfp绿色荧光的分布。gfp和叶绿素的激发波长分别为488nm和640nm。亚细胞定位见图4,doap2/erf89定位于细胞核。
[0049]
实施例4:转录因子doap2/erf89的编码基因与dopaes基因互作酵母单杂交试验
[0050]
(1)酵母感受态的制备(现做现用,不可冷冻保存后使用):
[0051]
从-80℃冰箱中取出酵母菌株y1hgold,吸取10-20μl涂布于ypda固体培养基中,28℃培养箱中培养2d-4d至菌斑直径长到2mm左右;从ypda固体培养平板上分别挑取2-3个克隆至20ml ypda液体培养基中,28℃恒温,180r/min过夜培养,至od
600
大于1.5;取约10ml菌液接种于100ml新鲜的ypda液体培养基,28℃恒温,180r/min培养至od
600
=0.4-0.6,室温1 000
×
g离心5分钟收菌;去上清,10ml无菌水重悬细胞,6 000r/min离心5min,去除上清;沉淀用1.5ml 1
×
liac重悬后即为感受态细胞。
[0052]
(2)诱饵载体转化:
[0053]
将待转化的pabai空载体质粒及其重组载体pabai-dopaespro按照表6转化至酵母感受态细胞,转化后涂布于sd/-ura固体培养基上培养,筛选阳性克隆用于后续试验,转化前需要使用限制性内切酶bstbⅰ进行线性化。
[0054]
表4酶切反应体系与反应条件
[0055][0056]
表5连接反应体系与反应条件
[0057][0058]
y1h[pbait-abai]菌株本底水平表达:
[0059]
将y1h[pbait-abai]菌株用0.9% nacl重悬,调至od
600
=0.002,取100μl涂布在含不同浓度(0ng/ml,200ng/ml,400ng/ml,600ng/ml,800ng/ml)金担子素(aureobasidin a,aba)的sd/-ura缺陷型培养基上,28℃倒置避光培养2-3d。若平板上有白色单菌落,pbait-abai菌株存在自激活,反之,证明aba浓度可抑制自激活,确定抑制pbait-abai菌株生长的最低aba浓度。
[0060]
已携带pbait-abai酵母感受态的制备同上,转化产物涂布于sd/-leu固体培养基,28℃倒置培养3-5d。筛选阳性克隆梯度稀释后涂布于含600ng/mlaba的sd/-leu固体培养基。
[0061]
表6酵母感受态转化体系
7000b)联用(gc-ms)检测铁皮石斛类原球茎挥发性萜类化合物。将100μm聚二甲基硅氧烷(supelco)组成的固相微萃取纤维置于含有样品的顶空瓶中,在室温下吸附1小时。采集的挥发性萜类化合物在配备hp-5ms(30m
×
0.25mm
×
0.25μm)熔融硅毛细管柱的gc-ms triple quad装置上进行分析。色谱条件:氦气(1ml/min)为载气,进样口温度为250℃,不分流进样,初始温度为60℃,保持6min,以5℃/min升至300℃,维持5min。质谱条件:ei离子源的温度为230℃,电子能量为70ev,四级杆温度为150℃,转接口温度280℃,质量扫描范围50~400m/z。通过nist(national institute of standards and technology)2011标准库对检测出的挥发性化合物进行检索,结合已发表文献对所得化合物进行比对,确定检测的挥发性萜类。
[0069]
在样品中加入200μg/kg
·
h的癸酸乙酯作为内标。根据内标的峰面积进行定量。挥发物的含量表示为μg/kg
·
fw
·
h。
[0070]
试验结果详见图2、图7,图2体外酶活性证实dopaes能催化β-广藿香烯的合成。图7表明doap2/erf89能够激活dopaes启动子的表达,增强dopaes的启动子活性,从而促进了铁皮石斛中β-广藿香烯的合成。
[0071]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1