一种应用二氧化碳促进栅藻生产α-亚麻酸的方法
一种应用二氧化碳促进栅藻生产
α-亚麻酸的方法
技术领域
1.本发明属于生物工程技术领域,尤其涉及一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法。
背景技术:
2.与陆生植物相比,微藻是一类可进行光合作用的微小的藻类群体,具有生长速度快、可固定二氧化碳(co2)、不占用耕地、不受季节影响等特点。碳元素在微藻生物质中约占50
±
2%(w/w),微藻主要通过光合作用和钙化作用固定co2,1吨微藻生物质(干重)可以固定1.76~1.91吨的co2。同时,co2可抵消因微藻生长引起的ph值升高,并改变微藻的生化成分。微藻可通过生物介导的碳捕获和利用(bio-ccu),实现co2可持续生物固定和生物量稳定。此外,微藻擅长将co2转化为高价值的生物分子,这为抵消微藻养殖捕获co2的运营成本提供了巨大的潜力。
3.α-亚麻酸(ala,c18:3)作为一种必需的ω-3多不饱和脂肪酸(pufa),在维持和改善正常生理功能、预防疾病和降低疾病风险方面发挥积极作用,是食品和保健品的重要原料。全球保健、食品和医药市场对高纯度ala原料的年需求总量达2000吨。微藻是富含pufa油脂的极好来源,与农作物相比具有更高的光合效率和表面积生产力,营养需求简单。目前,微藻被广泛用于生产pufa,但是仍面临着pufa含量及产率低等问题。因此,利用微藻固定co2并促进α-亚麻酸高效积累具有较强的应用前景。
4.通过上述分析,现有技术存在的问题及缺陷为:
5.(1)能够耐受高浓度co2的微藻藻株有限;
6.(2)能够利用淡水微藻生产ala的藻株有限;
7.(3)利用微藻生产ala仍存在含量低、产量低等问题。
技术实现要素:
8.针对现有技术存在的问题,本发明提供了一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法。
9.本发明是这样实现的,一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法,所述应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法的具体过程包括:
10.步骤一,种子液的制备:以bg-11为基础培养基,在25
±
1℃、光强为2500~2800lux,持续光照条件下培养栅藻至对数生长期;
11.步骤二,促进栅藻积累α-亚麻酸:将栅藻种子液转接到含1l bg-11培养基的鼓泡柱式反应器中,初始接种量为0.6g/l;将无菌混合co2气体(co2/空气,v/v)以1
±
0.1l/min的流速通入所述鼓泡柱式反应器底部,连续光照,温度25
±
1℃下,促进藻细胞积累α-亚麻酸;
12.步骤三,利用气相色谱仪检测藻细胞的α-亚麻酸含量。
13.进一步,所述步骤一中栅藻为栅藻菌株为acutodesmus sp.hlgy,分离自四川省海螺沟雅家梗红石滩。
14.进一步,所述步骤二中光照强度为6500~7000lux。
15.进一步,所述无菌混合co2气体中co2与空气的体积比为1.25%-10%。
16.进一步,所述步骤三的具体过程包括:
17.(1)将培养后的栅藻藻细胞悬浮液以3800
×
g离心5min,沉淀用蒸馏水洗涤2次,收集在50ml离心管中,在-80℃的真空冷冻干燥机中冷冻干燥48h直至获得恒重得到干藻粉质量,栅藻生物量计算如下:
[0018][0019]
其中,
[0020]
m为干藻粉质量,g;
[0021]
v为藻液体积,l。
[0022]
(2)通过气相色谱仪测量α-亚麻酸的含量。
[0023]
进一步,上述步骤(2)的具体过程为:
[0024]
首先,称取干藻粉0.2g研磨,加入氯仿:甲醇混合溶液(2:1,v:v),充分振荡提取油脂,将提取的油脂37℃烘干,油脂含量计算如下:
[0025][0026]
其中,
[0027]
m1为油脂质量,mg;
[0028]
m2为称取的干藻粉质量,g。
[0029]
其次,将烘干的油脂加入3%的硫酸甲醇(v/v),70℃水浴3h,冷却至室温,加入正己烷,25℃,150rpm摇床振荡1h,吸取上层正己烷萃取液,即完成脂肪酸甲酯化,转移进样瓶中待测脂肪酸组分;
[0030]
然后,利用岛津gc-2030进行gc分析,色谱条件为:色谱柱sp-2560(聚二氰丙基硅氧烷强极性固定相,柱长100m,内径0.25mm,膜厚0.2μm),进样器温度为270℃,检测器温度为280℃。升温程序为:100℃维持13分钟,10℃/min的速度升温到180℃,维持6min;然后1℃/min的速度将温度增加到200℃,维持20min;再以4℃/min的速度将温度增加到230℃,维持10.5min;载气为氮气;进样量分流比100:1,进样量1μl。
[0031]
最后,利用峰面积归一化法定量测定出脂肪酸各组分之间的相对百分含量,α-亚麻酸ala浓度计算如下:
[0032][0033]
其中,
[0034]
ala%为α-亚麻酸在总脂肪酸组成占比的相对百分含量。
[0035]
α-亚麻酸ala产率计算如下:
[0036][0037]
其中,
[0038]ct1
为在t1天α-亚麻酸的浓度,mg/l;
[0039]ct2
为在t2天α-亚麻酸的浓度,mg/l;
[0040]
t1和t2为栅藻培养的不同时间,单位为天(d)。
[0041]
结合上述的技术方案和解决的技术问题,本发明所要保护的技术方案所具备的优点及积极效果为:
[0042]
第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
[0043]
本发明公开了二氧化碳的新的应用领域,且操作简单易行、成本低,原材料为自己筛选的栅藻菌株,可按常规方法培养,培养完藻的废液可以直接用于灌溉农田,提高利用率,提高培养完藻的废液利用率。
[0044]
第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
[0045]
本发明大幅提高了α-亚麻酸ala的产率,通入1.25%二氧化碳(co2/空气,v/v)的处理组的α-亚麻酸ala产率相比没有通入二氧化碳的对比例提高了51%,达到103.53mg/l/d。
[0046]
第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
[0047]
本发明的技术方案转化后的预期收益和商业价值为:ala是构成细胞膜和生物酶的基础物质,并且在机体内可转化为dha、dpa、epa等ω-3必需脂肪酸,是人们必须的营养素之一。因此,本发明利用栅藻固碳高产ala,对于ala产品的规模化生产,具有一定的经济社会效益。
附图说明
[0048]
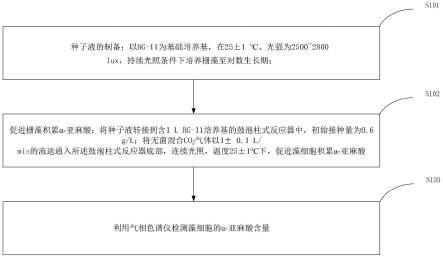
图1是本发明实施例提供的应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法的流程图;
[0049]
图2是本发明实施例提供的实施例1、2、3以及对比例中微藻的α-亚麻酸ala产率对比图。
具体实施方式
[0050]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0051]
为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
[0052]
如图1所示,本发明实施例提供的应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法的具体过程包括:
[0053]
s101,种子液的制备:以bg-11为基础培养基,在25
±
1℃、光强为2500~2800lux,持续光照条件下培养栅藻至对数生长期;
[0054]
s102,促进栅藻积累α-亚麻酸:将栅藻种子液转接到含1l bg-11培养基的鼓泡柱
式反应器中,初始接种量为0.6g/l;将无菌混合co2气体(co2/空气,v/v)以1
±
0.1l/min的流速通入所述鼓泡柱式反应器底部,连续光照,温度25
±
1℃下,促进藻细胞积累α-亚麻酸;
[0055]
s103,利用气相色谱仪检测藻细胞的α-亚麻酸含量。
[0056]
进一步,所述s101中栅藻为栅藻菌株为acutodesmus sp.hlgy,分离自四川省海螺沟雅家梗红石滩。
[0057]
进一步,所述s102中光照强度为6500~7000lux。
[0058]
进一步,所述无菌混合co2气体中co2与空气的体积比为1.25%-10%。
[0059]
进一步,所述s103的具体过程包括:
[0060]
(1)将培养后的栅藻藻细胞悬浮液以3800
×
g离心5min,沉淀用蒸馏水洗涤2次,收集在50ml离心管中,在-80℃的真空冷冻干燥机中冷冻干燥48h直至获得恒重得到干藻粉质量,栅藻生物量计算如下:
[0061][0062]
其中,
[0063]
m为干藻粉质量,g;
[0064]
v为藻液体积,l。
[0065]
(2)通过气相色谱仪测量α-亚麻酸的含量。
[0066]
进一步,上述步骤(2)的具体过程为:
[0067]
首先,称取干藻粉0.2g研磨,加入氯仿:甲醇混合溶液(2:1,v:v),充分振荡提取油脂,将提取的油脂37℃烘干,油脂含量计算如下:
[0068][0069]
其中,
[0070]
m1为油脂质量,mg;
[0071]
m2为称取的干藻粉质量,g。
[0072]
其次,将烘干的油脂加入3%的硫酸甲醇(v/v),70℃水浴3h,冷却至室温,加入正己烷,25℃,150rpm摇床振荡1h,吸取上层正己烷萃取液,即完成脂肪酸甲酯化,转移进样瓶中待测脂肪酸组分;
[0073]
然后,利用岛津gc-2030进行gc分析,色谱条件为:色谱柱sp-2560(聚二氰丙基硅氧烷强极性固定相,柱长100m,内径0.25mm,膜厚0.2μm),进样器温度为270℃,检测器温度为280℃。升温程序为:100℃维持13分钟,10℃/min的速度升温到180℃,维持6min;然后1℃/min的速度将温度增加到200℃,维持20min;再以4℃/min的速度将温度增加到230℃,维持10.5min;载气为氮气;进样量分流比100:1,进样量1μl。
[0074]
最后,利用峰面积归一化法定量测定出脂肪酸各组分之间的相对百分含量,α-亚麻酸ala浓度计算如下:
[0075][0076]
其中,
[0077]
ala%为α-亚麻酸在总脂肪酸组成占比的相对百分含量。
[0078]
α-亚麻酸ala产率计算如下:
[0079][0080]
其中,
[0081]ct1
为在t1天α-亚麻酸的浓度,mg/l;
[0082]ct2
为在t2天α-亚麻酸的浓度,mg/l;
[0083]
t1和t2为栅藻培养的不同时间,单位为天(d)。
[0084]
为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
[0085]
实施例1
[0086]
一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法,具体步骤如下:
[0087]
(1)种子液的制备:以bg-11为基础培养基,在25
±
1℃、光强为2500~2800lux,持续光照条件下培养栅藻至对数生长期;
[0088]
(2)促进栅藻积累α-亚麻酸:将种子液转接到含1l bg-11培养基的鼓泡柱式反应器中,初始接种量为0.6g/l;将无菌混合co2气体1.25%(co2/空气,v/v)以1
±
0.1l/min的流速通入步骤(1)反应器底部,连续光照,温度25
±
1℃条件下,促进藻细胞积累α-亚麻酸。
[0089]
按照实施例1的方法,再进行三组平行实验,将步骤(1)的光强设定为2600lux、2700lux、2800lux,步骤(2)的培养温度分别对应设定为24℃、25℃、26℃,光强设定为6500lux、6800lux、7000lux,其他条件与实施例1相同,连续光照及通入1.25%(co2/空气,v/v)二氧化碳,促进藻细胞积累α-亚麻酸。
[0090]
本实施例培养完的细胞液利用气相色谱仪检测藻细胞的α-亚麻酸含量,其具体步骤为:
[0091]
(1)将培养后的栅藻藻细胞悬浮液以3800
×
g离心5min,沉淀用蒸馏水洗涤2次,收集在50ml离心管中,在-80℃的真空冷冻干燥机中冷冻干燥48h直至获得恒重得到干藻粉质量,栅藻生物量计算如下:
[0092][0093]
其中,
[0094]
m为干藻粉质量,g;
[0095]
v为藻液体积,l。
[0096]
(2)通过气相色谱仪测量α-亚麻酸的含量。
[0097]
进一步,上述步骤(2)的具体过程为:
[0098]
首先,称取干藻粉0.2g研磨,加入氯仿:甲醇混合溶液(2:1,v:v),充分振荡提取油脂,将提取的油脂37℃烘干,油脂含量计算如下:
[0099][0100]
其中,
[0101]
m1为油脂质量,mg;
[0102]
m2为称取的干藻粉质量,g。
[0103]
其次,将烘干的油脂加入3%的硫酸甲醇(v/v),70℃水浴3h,冷却至室温,加入正己烷,25℃,150rpm摇床振荡1h,吸取上层正己烷萃取液,即完成脂肪酸甲酯化,转移进样瓶中待测脂肪酸组分;
[0104]
然后,利用岛津gc-2030进行gc分析,色谱条件为:色谱柱sp-2560(聚二氰丙基硅氧烷强极性固定相,柱长100m,内径0.25mm,膜厚0.2μm),进样器温度为270℃,检测器温度为280℃。升温程序为:100℃维持13分钟,10℃/min的速度升温到180℃,维持6min;然后1℃/min的速度将温度增加到200℃,维持20min;再以4℃/min的速度将温度增加到230℃,维持10.5min;载气为氮气;进样量分流比100:1,进样量1μl。
[0105]
最后,利用峰面积归一化法定量测定出脂肪酸各组分之间的相对百分含量,α-亚麻酸ala浓度计算如下:
[0106][0107]
其中,
[0108]
ala%为α-亚麻酸在总脂肪酸组成占比的相对百分含量。
[0109]
α-亚麻酸ala产率计算如下:
[0110][0111]
其中,
[0112]ct1
为在t1天α-亚麻酸的浓度,mg/l;
[0113]ct2
为在t2天α-亚麻酸的浓度,mg/l;
[0114]
t1和t2为栅藻培养的不同时间,单位为天(d)。
[0115]
检测结果:当二氧化碳浓度为1.25%(二氧化碳:空气,v/v)时,微藻的α-亚麻酸ala产率最高为103.53mg/l/d。且培养完的藻液无污染,可以直接排放,灌溉农田。
[0116]
实施例2
[0117]
一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法,具体步骤如下:
[0118]
(1)种子液的制备:以bg-11为基础培养基,在25
±
1℃、光强为2500~2800lux,持续光照条件下培养栅藻至对数生长期;
[0119]
(2)促进栅藻积累α-亚麻酸:将种子液转接到含1l bg-11培养基的鼓泡柱式反应器中,初始接种量为0.6g/l;将无菌混合co2气体1.25%(co2/空气,v/v)以1
±
0.1l/min的流速通入步骤(1)反应器底部,连续光照,温度25
±
1℃条件下,促进藻细胞积累α-亚麻酸。
[0120]
按照实施例2的方法,再进行三组平行实验,将步骤(1)的光强设定为2600lux、2700lux、2800lux,步骤(2)的培养温度分别对应设定为24℃、25℃、26℃,光强设定为6500lux、6800lux、7000lux,其他条件与实施例2相同,连续光照及通入二氧化碳,促进藻细胞积累α-亚麻酸。
[0121]
按照实施例1的检测结果:当二氧化碳浓度为2.50%(二氧化碳:空气,v/v)时,微藻的α-亚麻酸ala产率最高为87.07mg/l/d。且培养完的藻液无污染,可以直接排放,灌溉农田。
[0122]
实施例3
[0123]
一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法,具体步骤如下:
[0124]
(1)种子液的制备:以bg-11为基础培养基,在25
±
1℃、光强为2500~2800lux,持续光照条件下培养栅藻至对数生长期;
[0125]
(2)促进栅藻积累α-亚麻酸:将种子液转接到含1l bg-11培养基的鼓泡柱式反应器中,初始接种量为0.6g/l;将无菌混合co2气体10.0%(co2/空气,v/v)以1
±
0.1l/min的流速通入步骤(1)反应器底部,连续光照,温度25
±
1℃条件下,促进藻细胞积累α-亚麻酸。
[0126]
按照实施例3的方法,再进行三组平行实验,将步骤(1)的光强设定为2600lux、2700lux、2800lux,步骤(2)的培养温度分别对应设定为24℃、25℃、26℃,光强设定为6500lux、6800lux、7000lux,其他条件与实施例3相同,连续光照及通入10.0%二氧化碳,促进藻细胞积累α-亚麻酸。
[0127]
按照实施例1的检测结果:当二氧化碳浓度为10.0%(二氧化碳:空气,v/v)时,微藻的α-亚麻酸ala产率最高为89.26mg/l/d。且培养完的藻液无污染,可以直接排放,灌溉农田。
[0128]
对比例
[0129]
一种应用二氧化碳(co2)促进栅藻生产α-亚麻酸的方法,具体步骤如下:
[0130]
(1)种子液的制备:以bg-11为基础培养基,在25
±
1℃、光强为2500~2800lux,持续光照条件下培养栅藻至对数生长期;
[0131]
(2)促进栅藻积累α-亚麻酸:将种子液转接到含1l bg-11培养基的鼓泡柱式反应器中,初始接种量为0.6g/l;将无菌空气,以1
±
0.1l/min的流速通入步骤(1)反应器底部,连续光照,温度25
±
1℃条件下,促进藻细胞积累α-亚麻酸。
[0132]
按照对比例的方法,再进行三组平行实验,将步骤(1)的光强设定为2600lux、2700lux、2800lux,步骤(2)的培养温度分别对应设定为24℃、25℃、26℃,光强设定为6500lux、6800lux、7000lux,其他条件与对比例相同,连续光照及通入无菌空气,促进藻细胞积累α-亚麻酸。
[0133]
按照实施例1的检测结果:当二氧化碳浓度为0%(二氧化碳:空气,v/v)时,微藻的α-亚麻酸ala产率最高为81.08mg/l/d。且培养完的藻液无污染,可以直接排放,灌溉农田。
[0134]
本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
[0135]
利用气相色谱测定对比实例和实施例1-3中微藻的α-亚麻酸含量,见图2,图中的含量是每个实施例中的三个平行实验取均质,结果表明:通入二氧化碳培养,促进栅藻积累α-亚麻酸,通过气相色谱测定微藻中α-亚麻酸,结果显示:(1)实施例1中藻细胞α-亚麻酸产率在培养第6天达到最高峰,第9天降低;(2)实施例1、2、3中藻细胞α-亚麻酸产率均高于对比例中没有通入二氧化碳的情况;但是在培养第9天,实施例2,3当二氧化碳浓度达到2.5%以上时,二氧化碳对微藻α-亚麻酸产率没有促进作用,藻细胞α-亚麻酸产率低于对比例中没有通入二氧化碳的情况;说明,当二氧化碳浓度为1.25%(二氧化碳:空气,v/v)时,二氧化碳对微藻α-亚麻酸产率具有促进作用,在微藻培养的第6天,二氧化碳浓度为1.25%(二氧化碳:空气,v/v)时,栅藻内α-亚麻酸产率达到最大为103.53mg/l/d,是对比例空白对照组的1.51倍。
[0136]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何
熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1