SRRP1及其在提高植物抗病性中的应用
agropyroncristatum chromosome 2p.theor appl genet130:109-121.jiang b et al.(2018)physical mapping of a novel locus conferring leaf rust resistance on the long arm of agropyroncristatum chromosome 2p.front plant sci 9:817.),抗叶锈病基因(song lqet al.(2016)cytological and molecular analysis of wheat-agropyroncristatum translocation lines with 6p chromosome fragments conferring superior agronomic traits in common wheat.genome,59:840
–
850.),以及来自冰草7p染色体的高千粒重基因(lu mjet al.(2017)transferring desirable genes from agropyroncristatum 7p chromosome into common wheat.plosone,11:e0159577.)。由于易位系中的外源片段通常携带有遗传累赘,所以易位系是比较难以应用于育种实践中。所以,创制携带有更少外源成分的渐渗系对促进小麦育种是必要的。
4.目前,已有超过80个小麦条锈病抗病基因被命名(gessese m et al.(2019)molecular mapping of stripe rust resistance gene yr81 in a common wheat landrace aus27430.plant disease,103:1166-1171.)。
5.kasp(kompetitive allele specific pcr)标记比传统的凝胶电泳标记相比,不仅操作简单,同时还具有稳定性好等优点,是一种高通量的分子标记。通过开发冰草6p抗病基因的kasp标记,加快分子设计育种进程。
技术实现要素:
6.本发明所要解决的技术问题是如何提高植物尤其是小麦的抗病性。
7.为解决上述技术问题,本发明首先提供了蛋白质或调控所述蛋白质活性或含量的物质的下述任一应用:
8.d1)调控植物抗病性;
9.d2)制备调控植物抗病性产品;
10.d3)提高植物抗病性;
11.d4)制备提高植物抗病性产品;
12.d5)培育抗病植物;
13.d6)制备培育抗病植物产品;
14.所述蛋白质其名称为srrp1,srrp1为如下a1)、a2)或a3):
15.a1)氨基酸序列是序列3的蛋白质;
16.a2)将序列表中序列3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
17.a3)在a1)或a2)的n端或/和c端连接标签得到的融合蛋白质。
18.为了使a1)中的蛋白质便于纯化,可在由序列表中序列3所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如下表所示的标签。
19.表:标签的序列
20.标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddk
strep-tag ii8wshpqfekc-myc10eqkliseedl
21.上述a2)中的srrp1蛋白质,为与序列3所示蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。所述具有75%或75%以上同一性为具有75%、具有80%、具有85%、具有90%、具有95%、具有96%、具有97%、具有98%或具有99%的同一性。
22.上述a2)中的srrp1蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
23.上述a2)中的srrp1蛋白质的编码基因可通过将序列2所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。其中,序列2所示的dna分子编码序列3所示的srrp1蛋白质。
24.上述应用中,所述物质可为下述b1)至b7)中的任一种:
25.b1)编码srrp1的核酸分子;
26.b2)含有b1)所述核酸分子的表达盒;
27.b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
28.b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物;
29.b5)含有b1)所述核酸分子的转基因植物细胞系、或含有b2)所述表达盒的转基因植物细胞系;
30.b6)含有b1)所述核酸分子的转基因植物组织、或含有b2)所述表达盒的转基因植物组织;
31.b7)含有b1)所述核酸分子的转基因植物器官、或含有b2)所述表达盒的转基因植物器官。
32.上述应用中,b1)所述核酸分子可为如下b11)或b12)或b13)或b14)或b15):
33.b11)编码序列是序列表中序列2的cdna分子或dna分子;
34.b12)序列表中序列2所示的cdna分子或dna分子;
35.b13)序列表中序列1的第5261-8734位所示的dna分子;
36.b14)与b11)或b12)或b13)限定的核苷酸序列具有75%或75%以上同一性,且编码srrp1的cdna分子或dna分子;
37.b15)在严格条件下与b11)或b12)或b13)或b14)限定的核苷酸序列杂交,且编码srrp1的cdna分子或dna分子;
38.b2)所述表达盒可为序列1的第1-8734位或序列1所示的dna分子。
39.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
40.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码srrp1蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的srrp1蛋白质的核苷酸序列75%或者更高同一性的核苷酸,只要编码srrp1蛋白质且具有srrp1蛋白质功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
41.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列3所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
42.上述应用中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次;也可为:2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;也可为:0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
43.上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
44.上述应用中,b2)所述的含有编码srrp1蛋白质的核酸分子的表达盒(srrp1基因表达盒),是指能够在宿主细胞中表达srrp1蛋白质的dna,该dna不但可包括启动srrp1基因转录的启动子,还可包括终止srrp1基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子,和诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35s;来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("lap",chao等人(1999)plant physiol120:979-992);来自烟草的化学诱导型启动子,发病机理相关1(pr1)(由水杨酸和bth(苯并噻二唑-7-硫代羟酸s-甲酯)诱导);西红柿蛋白酶抑制剂ii启动子(pin2)或lap启动子(均可用茉莉酮酸甲酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pf128(cn101063139b(中国专利200710099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆beta conglycin的启动子(beachy等人(1985)embo j.4:3047-3053))。它们可单独使用或与其它的植物启动子结合使用。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(nos终止子)、花椰菜花叶病毒camv 35s终止子、tml终止子、豌豆rbcs e9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:odell等人(i
985
)nature 313:810;rosenberg等人(1987)gene,56:125;guerineau等人(1991)mol.gen.genet,262:141;proudfoot(1991)cell,64:671;sanfacon等人genes dev.,5:141;mogen等人(1990)plant cell,2:1261;munroe等人(1990)gene,91:151;ballad等人(1989)nucleic acids res.17:7891;joshi等人(1987)nucleic acid res.,15:9627)。
45.可用现有的表达载体构建含有所述srrp1基因表达盒的重组载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pahc25、pbin438、
pcambia1302、pcambia2301、pcambia1301、pcambia1300、pbi121、pcambia1391-xa、psn1301或pcambia1391-xb(cambia公司)等。所述植物表达载体还可包含外源基因的3
′
端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3
′
端,如农杆菌冠瘿瘤诱导(ti)质粒基因(如胭脂碱合成酶基因nos)、植物基因(如大豆贮存蛋白基因)3
′
端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptii基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对氨甲喋呤抗性的dhfr基因,赋予对草甘磷抗性的epsps基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。
46.上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为pwmb110载体。
47.b3)所述重组载体具体可为pwmb110-srrp1。所述pwmb110-srrp1为将表达载体pwmb110的hindiii和saci识别序列间的dna片段替换为序列表中序列1所示的dna片段得到的重组载体,pwmb110-srrp1能表达序列表中序列3所示的srrp1。
48.上述应用中,所述微生物可为酵母、细菌、藻或真菌。其中,细菌可为农杆菌,如发根农杆菌c58c1。
49.上述应用中,所述转基因植物细胞系、转基因植物组织和转基因植物器官均不包括繁殖材料。
50.为解决上述技术问题,本发明还提供了下述任一方法:
51.x1)培育抗病性增强植物的方法,包括使受体植物中表达srrp1,或提高受体植物中srrp1的含量或活性,得到抗病性增强的目的植物;
52.x2)提高植物抗病性的方法,包括使受体植物中表达srrp1,或提高受体植物中srrp1的含量或活性,得到抗病性增强的目的植物,实现植物抗病性的提高。
53.上述方法中,x1)和x2)所述方法可通过向所述受体植物中导入srrp1的编码基因并使所述编码基因得到表达实现。
54.上述方法中,所述编码基因可为b1)所述核酸分子。
55.上述方法中,其中所述srrp1的编码基因可先进行如下修饰,再导入受体植物中,以达到更好的表达效果:
56.1)根据实际需要进行修饰和优化,以使基因高效表达;例如,可根据受体植物所偏爱的密码子,在保持本发明所述srrp1的编码基因的氨基酸序列的同时改变其密码子以符合植物偏爱性;优化过程中,最好能使优化后的编码序列中保持一定的gc含量,以最好地实现植物中导入基因的高水平表达,其中gc含量可为35%、多于45%、多于50%或多于约
60%;
57.2)修饰邻近起始甲硫氨酸的基因序列,以使翻译有效起始;例如,利用在植物中已知的有效的序列进行修饰;
58.3)与各种植物表达的启动子连接,以利于其在植物中的表达;所述启动子可包括组成型、诱导型、时序调节、发育调节、化学调节、组织优选和组织特异性启动子;启动子的选择将随着表达时间和空间需要而变化,而且也取决于靶物种;例如组织或器官的特异性表达启动子,根据需要受体在发育的什么时期而定;尽管证明了来源于双子叶植物的许多启动子在单子叶植物中是可起作用的,反之亦然,但是理想地,选择双子叶植物启动子用于双子叶植物中的表达,单子叶植物的启动子用于单子叶植物中的表达;
59.4)与适合的转录终止子连接,也可以提高本发明基因的表达效率;例如来源于camv的tml,来源于rbcs的e9;任何已知在植物中起作用的可得到的终止子都可以与本发明基因进行连接;
60.5)引入增强子序列,如内含子序列(例如来源于adhl和bronzel)和病毒前导序列(例如来源于tmv,mcmv和amv)。
61.所述srrp1的编码基因可利用含有所述srrp1的编码基因的重组表达载体导入受体植物。所述重组表达载体具体可为所述pwmb110-srrp1。
62.所述重组表达载体可通过使用ti质粒,植物病毒载体,直接dna转化,微注射,电穿孔等常规生物技术方法导入植物细胞(weissbach,1998,method for plant molecular biology viii,academy press,new york,pp.411-463;geiserson and corey,1998,plant molecular biology(2nd edition).)。
63.所述目的植物理解为不仅包含srrp1蛋白或其编码基因被改变的第一代植物,也包括其子代。对于所述目的植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述目的植物包括种子、愈伤组织、完整植株和细胞。
64.本发明还提供了用于提高植物抗病性的产品,所述产品含有srrp1,或所述调控所述蛋白质活性或含量的物质。
65.所述产品可以srrp1或所述调控所述蛋白质活性或含量的物质作为其活性成分,还可将srrp1或所述调控所述蛋白质活性或含量的物质与其他具有相同功能的物质一起作为其活性成分。
66.本发明中,所述抗病性可为条锈病抗性。所述条锈病可为小麦条锈病菌(如小麦条锈病条中32生理小种)引发的条锈病。
67.本发明中,所述植物可为m1)或m2)或m3):
68.m1)单子叶植物或双子叶植物;
69.m2)禾本科植物;
70.m3)小麦。
71.srrp1,或所述调控所述蛋白质活性或含量的物质,也属于本发明的保护范围。
72.实验结果表明,srrp1转基因植物对小麦条锈病条中32生理小种表现高抗,说明srrp1及其编码基因可以提高小麦的条锈病条中32生理小种的抗病性,可用于植物育种。本发明具有很好的应用前景。
附图说明
73.图1为转基因表达载体pwmb110示意图。
74.图2转基因植株的分子标记检测。从上至下依次为srrp2转基因小麦、srrp1转基因小麦、srrp3转基因小麦。箭头所示为目的片段位置。
75.图3为转基因t1植株进行条锈病生理小种条中32的抗病性鉴定结果。
具体实施方式
76.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
77.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
78.下述实施例中的转基因表达载体pwmb110记载在“anwar a,she m,wang k,ye x.cloning and molecular characterization of triticum aestivum ornithine amino transferase(taoat)encoding genes.bmc plant biol.2020;20(1):187.”一文中,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
79.下述实施例中的普通小麦fielder记载在“ishida y,tsunashima m,hiei y,komari t.2015.wheat(triticum aestivuml.)transformation using immature embryos.in:wang k,ed.agrobacteriumprotocols.methods in molecular biology,vol.1223.new york,ny,usa:springer,189-198.”一文中,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
80.下述实施例中的条锈病生理小种条中32记载在“hu x,li j,wang y,et al.race composition of pucciniastriiformis f.sp.tritici in tibet,china.plant disease,2012;96(11):1615-1620.”一文中,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
81.下述实施例中的铭贤169均记载在“hu x,li j,wang y,et al.race composition of pucciniastriiformis f.sp.tritici in tibet,china.plant disease,2012;96(11):1615-1620.”一文中,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
82.下述实施例中的普通小麦fukuho和易位系wat655记载在“song lq,lu yq,zhang jp,et al.cytological and molecular analysis of wheat-agropyroncristatum translocation lines with 6p chromosome fragments conferring superior agronomic traits in common wheat.genome,59(10):840-850.”一文中,公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
83.实施例1、srrp1、srrp2、srrp3为与条锈病抗性相关的蛋白质
84.本实施例在四倍体冰草(agropyroncristatum)“z559”(li lh,dong ys,zhou rh,li xq,li p,yang xm(1995)cytogenetics and self-fertility of intergeneric hybrids between triticum aestivum l.and agropyroncristatum(l.)gaertn.chin j genet22:105
–
112)中发现了三个条锈病抗性相关蛋白质,分别记为srrp1、srrp2、srrp3,srrp1、srrp2、srrp3的氨基酸序列分别为序列表中序列3、6、9,在四倍体冰草(agropyroncristatum)“z559”中,srrp1基因、srrp2基因、srrp3基因的基因组序列分别为序列1的第5261-8734位、序列4的第3560-10159位、序列7的第3779-6932位,cds序列依次为序列2、5、8。
85.其中,序列1的第5261-6087位、第6749-7208位、第7232-8734位依次为各个外显子序列;
86.序列4的第3560-4312位、第4923-6831位、第6918-7010位、第7139-7194位、第7293-7397位、第8066-8290位、第8361-8924位、第9009-9217位、第9294-9489位、第9781-9896位、第9973-10159位依次为各个外显子序列;
87.序列7的第3779-6437位、第6541-6932位依次为各个外显子序列。
88.一、重组表达载体的构建
89.1)以四倍体冰草(agropyroncristatum)“z559”的bac克隆质粒dna(含有“z559”的染色体片段)为模板(或以四倍体冰草(agropyroncristatum)“z559”的基因组dna为模板),分别利用表1中扩增相应基因的引物进行扩增,分别得到pcr产物—srrp1、srrp2、srrp3的基因组dna。
90.2)将转基因表达载体pwmb110(图1)利用限制性内切酶hindiii和saci切除ubiquitin启动子,回收载体骨架。
91.3)将步骤2)得到的载体骨架分别与步骤1)得到的srrp1、srrp2、srrp3的基因组dna利用同源重组酶按照表2的反应体系进行重组,反应体系在50℃条件下重组60min,将所得重组产物转化大肠感受细胞trans1-t1 phage resistant chemically competent cell,对长出的克隆提取质粒进行测序。将含有序列表中序列1、4、7所示dna片段的重组载体分别记为pwmb110-srrp1、pwmb110-srrp2、pwmb110-srrp3。
92.pwmb110-srrp1为将表达载体pwmb110的hindiii和saci识别序列间的dna片段替换为序列表中序列1所示的dna片段得到的重组载体,pwmb110-srrp1能表达序列表中序列3所示的srrp1。
93.序列1中,第1-5260位为srrp1的启动子的序列。
94.pwmb110-srrp2为将表达载体pwmb110的hindiii和saci识别序列间的dna片段替换为序列表中序列4所示的dna片段得到的重组载体,pwmb110-srrp2能表达序列表中序列6所示的srrp2。
95.序列4中,第1-3559位为srrp2的启动子的序列。
96.pwmb110-srrp3为将表达载体pwmb110的hindiii和saci识别序列间的dna片段替换为序列表中序列7所示的dna片段得到的重组载体,pwmb110-srrp3能表达序列表中序列9所示的srrp3。
97.序列7中,第1-3778位为srrp3的启动子的序列。
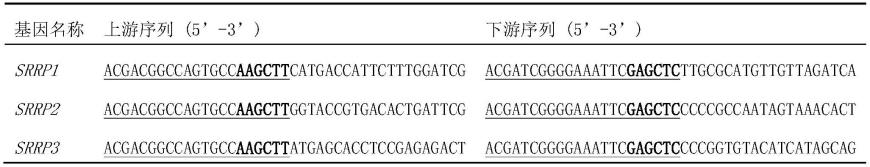
98.表1、引物序列
[0099][0100]
表1中,下划线序列为同源臂序列,加粗部分分别为hindiii和saci的识别序列。
[0101]
表2、同源重组反应体系
[0102][0103]
表2中,2
×
multif seamless assembly mix(武汉爱博泰克(abclonal)生物科技有限公司,货号rk21020)。
[0104]
二、转基因植株的构建
[0105]
将步骤一所得三个重组载体导入农杆菌c58c1中,然后利用农杆菌介导的遗传转化方法以普通小麦fielder为转基因受体进行遗传转化,分别得到srrp1转基因小麦、srrp2转基因小麦、srrp3转基因小麦。
[0106]
在dna水平上分别对所得各转基因小麦t1代进行鉴定,所用引物序列如表3所示。结果如图2所示。srrp1转基因小麦中,t1_1+、t1_2+、t1_3+、t1_4+均为阳性转基因植株,t1_5-、t1_6-非阳性转基因植株;srrp2转基因小麦中,t1_1+、t1_2+、t1_3+、t1_4+、t1_5+、t1_6+、t1_7+均为阳性转基因植株,t1_8-、t1_9-非阳性转基因植株;srrp3转基因小麦中,t1_1+、t1_2+、t1_3+、t1_4+、t1_5+均为阳性转基因植株,t1_6-、t1_7-非阳性转基因植株。
[0107]
表3用于转基因植株的分子标记检测的引物序列
[0108][0109]
三、转基因小麦的表型鉴定
[0110]
将步骤二得到的各t1代阳性转基因小麦进行条锈病生理小种条中32的抗病性鉴定,利用普通小麦fielder,fukuho和铭贤169作为感病对照,利用易位系wat655作为抗病对照,利用非阳性植株作为阴性对照,侵染性按0-9级鉴定。
[0111]
育苗:选用直径10cm,高度10cm的花盆,富含有机质的土壤,每盆播种20粒~25粒健康饱满的籽粒,覆土1cm,之后将育苗钵置于盛水的育苗盘内,使水从育苗钵底部缓慢吸
收至土体表面完全湿润,移出,置于15℃~18℃室温内培养6~8天,待用。
[0112]
接种:条锈病菌条中32的接种再在操作台内进行。首先用清水喷雾净化净化,再用75%的酒精对操作台,接种针,以及手进行消毒,然后将幼苗放在接种台上,在幼苗转移时要套袋或采取其他措施防止空中的孢子污染。写标签,标注接种日期,品种,菌种编号;用手蘸取条锈菌夏孢子,接种到无菌的幼苗的第一片叶上。
[0113]
保湿:将接菌后的幼苗置于接种桶中,用清水喷雾,使叶片表面附着一层均匀的雾滴,密封,在9℃~13℃黑暗条件下保湿18h~24h,然后置于15℃~18℃室温内培养,15天左右后进行调查记录。
[0114]
鉴定标准:如表4。
[0115]
表4侵染性鉴定标准
[0116]
侵染性症状特点0级叶片上不产生任何症状。1级叶片上产生零星的小型坏死斑,不产生夏孢子堆。2级叶片上出现较大的坏死,并且连成片,不产生夏孢子堆。3级叶片上出现成片的大片坏死斑,坏死斑上零星的散生很小的夏孢子堆。4级叶片上产生坏死斑,坏死斑上着生着较多的很小的夏孢子。5级叶片褪绿或坏死,夏孢子堆小且较少。6级叶片褪绿或坏死,夏孢子堆中等大小且较少。7级夏孢子堆中等大小且较多,孢子堆之间叶片褪绿。8级叶片偶有褪绿,夏孢子堆大且数量多。9级叶片不褪绿,着生大量夏孢子堆。
[0117]
抗病性鉴定结果表明,基因srrp1和基因srrp2的转基因植物均对小麦条锈病条中32生理小种表现高抗,基因srrp3的转基因植物对小麦条锈病条中32生理小种表现中抗(表5,图3)。说明,srrp1、srrp2、srrp3及其编码基因可以提高小麦的条锈病条中32生理小种的抗病性。
[0118]
表5、转基因t1植株条锈病鉴定调查结果
[0119][0120][0121]“+”代表阳性植株;
“‑”
代表阴性植株。
[0122]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1