用于单细胞三维培养的微流控芯片和单细胞三维培养方法
1.本发明涉及一种微流控芯片,具体的为一种用于单细胞三维培养的微流控芯片和单细胞三维培养方法
背景技术:
2.利用各类凝胶材料充当细胞外基质替代物是细胞体外三维培养的一种常用方法,细胞外的凝胶层形成细胞的三维空间支架,能够有效阻挡外界大尺寸物质与封装细胞的直接接触,如抗体、酶等物质;同时保证氧气、营养物质、代谢物等小分子物质的自由交换,从而维持细胞各项生物学活动和正常功能。研究凝胶内细胞的生理行为在细胞治疗、组织工程、再生医学等领域具有很大的价值,在单细胞水平上的细胞生物组学研究方面也具有显著优势。
3.液滴微流控技术能精准控制载细胞微液滴的生成,将活细胞引入微液滴中并进行凝胶固化得到的载细胞微凝胶具有良好的生物活性,使其在细胞递送、细胞治疗、组织工程、3d生物打印等领域中具有重要的应用前景。现有的研究往往聚焦在用不同的方法使载细胞微凝胶制备更加稳定、粒径更小、细胞包封率更高、细胞活性更高等方面,通常将得到的混合液进行离心操作得到微凝胶,然后将其移入培养基中进行常规培养,然后对整个细胞群进行检测得到统计学结果,无法实现对单个细胞进行研究,而且长期培养会导致凝胶粘连甚至融合而影响细胞所需氧气和营养物质的运输。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种用于单细胞三维培养的微流控芯片和单细胞三维培养方法,集载细胞微凝胶制备、固定、片上三维培养于一体,可以实现单个细胞的三维培养,在此基础上实现单细胞研究。
5.为达到上述目的,本发明提供如下技术方案:
6.本发明首先提出了一种用于单细胞三维培养的微流控芯片,包括芯片本体,所述芯片本体内设有微流体控制通道;
7.所述微流体控制通道包括载细胞微滴生成区、微滴固化区、微滴冲洗区和微滴捕获培养区;
8.所述载细胞微滴生成区包括第一十字型聚焦结构,所述第一十字型聚焦结构连接分散相通道、第一连接通道段和两条连续相通道,所述分散相通道连接分散相入口,两条所述连续相通道连接连续相入口;所述分散相通道和第一连接通道段位于同一条直线上,两条所述连续相通道对称设置在所述分散相通道的两侧;
9.所述微滴固化区内设有微滴固化通道,所述微滴固化通道的两端分别设有第一连接通道段和第二连接通道段;
10.所述微滴冲洗区包括第二十字型聚焦结构,所述第二十字型聚焦结构连接第二连接通道段、微滴冲洗通道和两条缓冲液通道,所述微滴冲洗通道用于冲洗和调节ph值,两条
所述缓冲液通道连接缓冲液入口;所述第二连接通道段和微滴冲洗通道位于同一条直线上,两条所述缓冲液通道对称设置在所述第二连接通道段的两侧;
11.所述微滴捕获培养区包括捕获阵列和培养液通道;所述捕获阵列包括至少两条相互平行的微滴捕获支通道,所有的所述微滴捕获支通道之间首尾相连以构成蛇形的微滴捕获通道,相邻的微滴捕获支通道之间设有捕获结构,所述微滴捕获通道的一端与所述微滴冲洗通道相连、另一端与废液口相连;所述培养液通道包括与每一条所述微滴捕获支通道两端相连的培养液注入支通道和培养液排出支通道,所有的所述培养液注入支通道与培养液入口相连,所有的所述培养液排出支通道与培养液出口相连。
12.进一步,所述连续相通道与所述分散相通道之间的夹角等于90
°
;所述缓冲液通道与所述第二连接通道段之间的夹角等于90
°
;所述微滴固化通道位于所述第一连接通道段和第二连接通道段之间的部分以及所述微滴冲洗通道均设为蛇形通道结构。
13.进一步,所述微滴冲洗通道的宽度大于等于所述微滴固化通道的宽度。
14.进一步,所述分散相通道、连续相通道、微滴固化通道、缓冲液通道和微滴捕获通道的宽度相等;所述培养液注入支通道和培养液排出支通道的宽度相等并小于等于所述微滴捕获通道的四分之一。
15.进一步,所述捕获结构包括捕获腔室,捕获腔室上设有入口,且所述捕获腔室的宽为90μm、长为80μm,入口的宽为70μm,所述微流体控制通道的高度为50μm。
16.进一步,所述培养液通道还包括与培养液入口相连的培养液缓冲腔,所有的所述培养液注入支通道均与所述培养液缓冲腔相连。
17.进一步,所述芯片本体采用两片pdms片材键合而成,所述微流体控制通道设置在其中一片所述pdms片材上,或所述微流体控制通道设置在两片所述pdms片材之间。
18.本发明还提出了一种采用如上所述微流控芯片的单细胞三维培养方法,包括如下步骤:
19.步骤一:连续生产包载单个细胞的水凝胶微球
20.11)关闭培养液入口和培养液出口,将分散相溶液、连续相溶液和缓冲液分别通过分散相入口、连续相入口和缓冲液入口注入到微流体控制通道内;
21.12)分散相溶液和连续相溶液流入到第一十字型聚焦结构并连续生成载细胞微滴,载细胞微滴通过第一连接通道段进入微滴固化通道使微滴形成包载有单个细胞的水凝胶微球;
22.13)生成的水凝胶微球通过第二连接通道段进入第二十字型聚焦结构并利用缓冲液对其进行冲洗,冲洗掉水凝胶微球表面及通道内残留的连续相溶液、并起到调节ph值的作用;
23.14)经冲洗后的水凝胶微球进入捕获阵列,利用捕获结构捕获水凝胶微球,直至所有捕获结构内均捕获有水凝胶微球;
24.15)关闭分散相入口和连续相入口,通过缓冲液入口继续通入缓冲液,清除微流体控制通道内的分散相液体和连续相液体后,关闭缓冲液入口和废液口;
25.步骤二:单个细胞培养
26.21)将微流控芯片置于水浴锅内并保持38℃;
27.22)打开培养液入口和培养液出口;将培养液通过培养液入口注入捕获阵列,实现
单个细胞三维培养,以实时观察细胞的生长情况。
28.进一步,所述分散相溶液采用0.1mol/l的ca-edta溶液与2wt%的海藻酸钠等体积混合得到分散混合液,在分散混合液内加入k562细胞后得到分散相溶液,且细胞密度(2-3)
×
106个/ml;;0.1mol/l的ca-edta溶液由0.2mol/l的氯化钙溶液与0.2mol/l的edta-2na等体积混合得到。
29.进一步,所述连续相溶液由0.2v/v%的乙酸、6v/v%的pfo和93.8v/v%的hfe-7100制备得到;所述缓冲液和培养液由45ml的细胞培养基与5ml的血清混合后再加入500μl的双抗得到。
30.进一步,所述步骤12)中,分散相溶液的流速10-150μl/h,连续相溶液的流速200-1200μl/h。
31.本发明的有益效果在于:
32.本发明的用于单细胞三维培养的微流控芯片,通过将微流体控制通道设置为载细胞微滴生成区、微滴固化区、微滴冲洗区和微滴捕获培养区;使用时,将分散相溶液、连续相溶液和缓冲液分别通过分散相入口、连续相入口和缓冲液入口注入,分散相溶液和连续相溶液分别通过分散相通道和两条连续相通道通入到第一十字型聚焦结构以得到包载有单个细胞的载细胞微滴;载细胞微滴进入微滴固化通道内固化为包载有单个细胞的水凝胶微球,水凝胶微球再进入到第二十字型聚焦结构,利用两条缓冲液通道注入的缓冲液冲洗水凝胶微球内残留的连续相溶液并调节ph值;经过微滴冲洗通道后的水凝胶微球被捕获在捕获阵列内;而后通过培养液入口注入培养液,使培养液通过各个培养液注入支通道进入到每一条微滴捕获支通道内并通过培养液排出支通道排出,实现单个细胞三维培养,以观察单个细胞的生长情况;即本发明的用于单细胞三维培养的微流控芯片集载细胞微凝胶制备、固定、片上三维培养于一体,可以实现单个细胞的三维培养及单细胞分析。
附图说明
33.为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
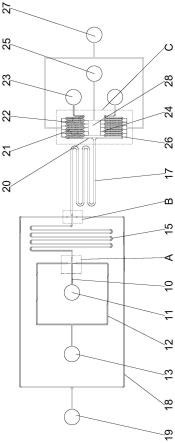
34.图1为本发明用于单细胞三维培养的微流控芯片的微流体控制通道的结构示意图;
35.图2为图1的a详图;
36.图3为图1的b详图;
37.图4为图1的c详图;
38.图5为微流体控制通道在连续生产包载单个细胞的水凝胶微球过程中的液体填充状态;
39.图6为微流体控制通道在单个细胞培养过程中的液体填充状态。
40.附图标记说明:
41.10-分散相通道;11-分散相入口;12-连续相通道;13-连续相入口;14-第一连接通道段;15-微滴固化通道;16-第二连接通道段;17-微滴冲洗通道;18-缓冲液通道;19-缓冲液入口;20-微滴捕获通道;21-微滴捕获支通道;22-捕获结构;23-废液口;24-培养液注入支通道;25-培养液入口;26-培养液排出支通道;27-培养液出口;28-培养液缓冲腔。
具体实施方式
42.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
43.如图1所示,本实施例的用于单细胞三维培养的微流控芯片,包括芯片本体,芯片本体内设有微流体控制通道。本实施例的微流体控制通道包括载细胞微滴生成区、微滴固化区、微滴冲洗区和微滴捕获培养区。
44.具体的,本实施例的载细胞微滴生成区包括第一十字型聚焦结构,第一十字型聚焦结构连接分散相通道10、第一连接通道段14和两条连续相通道12,分散相通道10连接分散相入口11,两条连续相通道12连接连续相入口13。本实施例中,分散相通道10和第一连接通道段14位于同一条直线上,两条连续相通道12对称设置在分散相通道10的两侧。具体的,本实施例的连续相通道12与分散相通道10之间的夹角等于90
°
。
45.本实施例的微滴固化区内设有微滴固化通道15,微滴固化通道15的两端分别设有第一连接通道段14和第二连接通道段16。
46.本实施例的微滴冲洗区包括第二十字型聚焦结构,第二十字型聚焦结构连接第二连接通道段16、微滴冲洗通道17和两条缓冲液通道18,微滴冲洗通道17用于冲洗和调节ph值。两条缓冲液通道18连接缓冲液入口19。具体的,本实施例中,第二连接通道段16和微滴冲洗通道17位于同一条直线上,两条缓冲液通道18对称设置在第二连接通道段16的两侧。具体的,本实施例中,缓冲液通道18与第二连接通道段16之间的夹角等于90
°
。在本实施例的优选方案中,第一连接通道段14和第二连接通道段16为直线通道段,而微滴固化通道15位于第一连接通道段14和第二连接通道段16之间的部分设为蛇形通道。另外,本实施例的微滴冲洗通道17也设为蛇形通道,能够有效增加微滴固化通道15和微滴冲洗通道17的长度,同时减小占用面积空间。
47.本实施例的微滴捕获培养区包括捕获阵列和培养液通道;捕获阵列包括至少两条相互平行的微滴捕获支通道21,所有的微滴捕获支通道21之间首尾相连以构成蛇形的微滴捕获通道20,相邻的微滴捕获支通道21之间设有捕获结构22,微滴捕获通道20的一端与微滴冲洗通道17相连、另一端与废液口23相连。具体的,捕获结构22包括捕获腔室,捕获腔室上设有入口,且捕获腔室的宽为90μm、高为80μm,入口的宽为70μm。每一个捕获阵列包括143个捕获腔室。本实施例的培养液通道包括与每一条微滴捕获支通道两端相连的培养液注入支通道24和培养液排出支通道26,所有的培养液注入支通道24与培养液入口25相连,所有的培养液排出支通道26与培养液出口27相连。具体的,捕获阵列设为至少一个,每一个捕获阵列的微滴捕获通道20均与微滴冲洗通道17相连。在本实施例的优选方案中,培养液通道还包括与培养液入口25相连的培养液缓冲腔28,所有的培养液注入支通道24均与培养液缓冲腔28相连,如此,可以使培养液更加均匀地进入每一条培养液注入支通道24,使所有细胞能够均匀地获取培养液;另外,培养液在缓冲腔内被水浴锅加热,使培养液的温度与芯片内的温度保持一致。
48.具体的,微滴冲洗通道17的宽度大于等于微滴固化通道15的宽度。具体的,本实施例中。分散相通道10、连续相通道12、微滴固化通道15、缓冲液通道18和微滴捕获通道20的宽度相等。培养液注入支通道24和培养液排出支通道26的宽度相等并小于等于微滴捕获通道20的四分之一。本实施例中,捕获阵列设为两个,微滴冲洗通道17的宽度为240μm,分散相
通道10、连续相通道12、微滴固化通道15、缓冲液通道18和微滴捕获通道20的宽度均为120μm;培养液注入支通道和培养液排出支通道的宽度为30μm,微流体控制通道的高度统一为50μm。
49.在本实施例的优选方案中,本实施例的芯片本体采用两片pdms片材键合而成,微流体控制通道设置在其中一片pdms片材上,或微流体控制通道设置在两片pdms片材之间。现有用于制备微凝胶的微流控芯片通常将带有结构的pdms片材与平整的载玻片或者玻璃等键合,由于pdms片材是疏水的;而玻璃与水的接触角小,是亲水的,分散相容易粘连在上面,所以必须通过疏水处理改变其亲水性。本发明采用两片pdms片材键合得到芯片本体,整个芯片本体都是疏水的,省去了通道改性的过程,不仅节约了成本,还缩减了工序。具体的,本实施例的微流体控制通道设置在其中一片pdms片材上。
50.下面结合上述用于单细胞三维培养的微流控芯片,对本实施例的单细胞三维培养方法的具体实施方式进行详细说明。
51.本实施例的单细胞三维培养方法,包括如下步骤:
52.步骤一:连续生产包载单个细胞的水凝胶微球
53.11)关闭培养液入口和培养液出口,将分散相溶液、连续相溶液和缓冲液分别通过分散相入口、连续相入口和缓冲液入口注入到微流体控制通道内;
54.12)分散相溶液和连续相溶液流入到第一十字型聚焦结构并连续生成载细胞微滴,载细胞微滴通过第一连接通道段进入微滴固化通道使微滴形成包载有单个细胞的水凝胶微球;分散相溶液的流速10-150μl/h,连续相溶液的流速200-1200μl/h。本实施例中,分散相溶液的流速30μl/h,连续相溶液的流速600μl/h。
55.13)生成的水凝胶微球通过第二连接通道段进入第二十字型聚焦结构并利用缓冲液对其进行冲洗,冲洗掉水凝胶微球表面及通道内残留的连续相溶液、并起到调节ph值的作用;
56.14)经冲洗后的水凝胶微球进入捕获阵列,利用捕获结构捕获水凝胶微球,直至所有捕获结构内均捕获有水凝胶微球;
57.15)关闭分散相入口和连续相入口,通过缓冲液入口继续通入缓冲液,清除微流体控制通道内的分散相液体和连续相液体后,关闭缓冲液入口和废液口。
58.步骤二:单个细胞培养
59.21)将微流控芯片置于水浴锅内并保持38℃;
60.22)打开培养液入口和培养液出口;将培养液通过培养液入口注入捕获阵列,实现单个细胞三维培养,以观察单个细胞的生长情况,如图6所示。
61.具体的,本实施例中,分散相溶液采用0.1mol/l的ca-edta溶液与2wt%的海藻酸钠等体积混合得到分散混合液,在分散混合液内加入k562细胞后得到分散相溶液,具体的,细胞密度(2-3)
×
106个/ml;0.1mol/l的ca-edta溶液由0.2mol/l的氯化钙溶液与0.2mol/l的edta-2na等体积混合得到。连续相选择生物相容性更好,透气性更好的氟化碳油,表面活性剂选择更容易清除的短链小分子氟化醇。具体的,本实施例的连续相溶液由0.2v/v%的乙酸、6v/v%的pfo和93.8v/v%的hfe-7100制备得到。缓冲液和培养液由45ml的细胞培养基与5ml的血清混合后再加入500μl的双抗得到。
62.以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范
围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1