一种用于快速检测骆驼源性核酸的试剂盒和检测方法与流程
1.本发明涉及骆驼源性核酸的检测。更具体的本发明涉及一种检测驼源性核酸的引物组、探针、试剂盒和快速检测方法;尤其涉及快速、高特异性、高精密度和高仪器适用性的用于骆驼源性核酸检测的骆驼源性核酸检测试剂盒和检测方法。
背景技术:
[0002][0003]
骆驼是大型养殖动物,单匹骆驼的产肉量十分可观。除用于货物运输以外,骆驼在世界各地都是常见的肉食动物。我国骆驼多产于内蒙古、新疆、甘肃、青海、宁夏等地,是世界上最大产地之一。骆驼全身都是宝,驼肉、驼奶、驼毛的开发利用价值大,是农牧民发家致富的好项目。驼肉肉质细嫩,适口性好,并且含有大量的糖原,故肉甜,很像马肉,可与牛肉媲美。驼峰和驼掌具有很高的医药价值,是高档食品。性味甘温无毒,具有润燥、祛风、活血、消肿的功效。适宜顽痹不仁之风疾者食用。现代科学研究表明:驼奶属于蛋白类型乳,蛋白质含量远高于马奶和牛奶,而脂肪含量比牛奶和马奶低,是典型的高蛋白低脂肪奶类,驼奶含有丰富的乳糖、维生素c、a、b1、b2、e等成分,易被消化吸收,尤其是生物价值特高的天然胰岛素的含量远远高于牛奶和马奶,并且胆固醇含量低,鲜味氨基酸和各种微量元素含量高。驼奶具有清洁肺和肠道功能,被认为是最具营养和保健作用的产品,将成为继牛奶产业后的第二奶产业。明代李时珍在《本草纲目》中记载:“驼乳味甘、温、无毒,可补中益气,壮筋骨,令人不饥。”实践证明,驼乳能助食开胃,促进新陈代谢,对肺结核、消化道溃疡、高血压、糖尿病等均有一定的辅助治疗作用。
[0004][0005]
目前,已经存在两项骆驼源性检测方法标准:动物源性饲料中骆驼源性成分定性检测方法pcr方法(gb/t 21100-2007);出口食品中骆驼源性成分的检测实时荧光pcr法(sn/t4418-2016)。上述检测标准采用传统的手工法进行样本的处理和核酸提取、pcr检测时间也较传统,整体操作过程繁琐,耗时长。
技术实现要素:
[0006]
为解决上述问题,本发明的目标在于提供一种基于多重实时荧光pcr法、同管质量控制体系、针对肉乳制品的骆驼源性成分检测方法的试剂盒和检测方法。
[0007]
为达到上述目的,本发明所采用的的技术方案如下所示:
[0008]
本发明的第一个目的是提供一种检测骆驼源性核酸的引物探针组合,所述引物探针组合包括用于检测骆驼源性核酸的引物序列和第一探针序列:
[0009]
seq id no.1所示第一引物:5'-gattcttygccttccayttcatcc-3';
[0010]
seq id no.2所示第二引物:5'-ggaatgggattttrtctatgtctgagga-3';
[0011]
seq id no.3所示第一探针:5'-acacgaaacaggytctaataacccracagg-3',所述第一探针的5'标记fam荧光基团,3'标记bhq1荧光猝灭基团;
[0012]
所述引物探针组合还包括用于检测内标的引物序列和第二探针序列:
[0013]
seq id no.4所示第三引物:5'-tctgccctatcaactttcgatg-3';
[0014]
seq id no.5所示第四引物:5'-aatttgcgcgcctgctg-3';
[0015]
seq id no.6所示第二探针:5'-ccgtttctcaggctccctctccg-3',所述第二探针的5'标记vic荧光素,3'标记bhq1荧光猝灭基团。
[0016]
本发明的第二个目的是提供前述的引物探针组合在制备检测骆驼源性核酸的试剂中的应用。
[0017]
本发明的第三个目的是提供一种检测骆驼源性核酸的试剂盒,所述试剂盒核酸扩增反应液、驼源检测液、阳性对照和空白对照;所述驼源检测液中包括前述引物探针组合。
[0018]
进一步的,所述核酸扩增反应液包括:荧光pcr缓冲液、dntp(u)s、mg
2+
、热启动taq dna聚合酶和und酶;
[0019]
优选的,每12.5μl所述核酸扩增反应液中包括荧光pcr缓冲液4μl、dntp(u)s 0.2mm、mg
2+
3mm、热启动taq dna聚合酶0.6u和udg酶0.15u。
[0020]
进一步的,所述驼源检测液中各引物浓度为400nm,各探针浓度为400nm。所述驼源检测液溶剂为te。
[0021]
进一步的,所述阳性对照包括seq id no.7所示的内标模板核苷酸序列和seq id no.8所示的驼源性基因核苷酸序列。
[0022]
seq id no.7所述内标模板为哺乳动物18s rrna全长:
[0023]
seq id no.7所示内标模板核苷酸序列:
[0024]5’‑
tacctgggtgatcctgccagtagcatatgcttgtctcaaagattaagccatgcatgtctaagtac gcacggcggtacagtgaaactgcgaatggctcattaaatcagttatggttcctttggtcgctcgctcctctctacttggatactgtggtaattctagagctaatacatgcgacgggcgctgaccccttcgcggggggatgcgtgcatttatcagatcaaaaccaacccggtcagcctcccccgcccccggccggggggggcgggcgccggcggctttggtgactctagataacctcgggccgatcgcacgccccccgtggcggcgacgacccattcgaacgtctgccctatcaactttcgatggtagtcgccgtgcctaccatggtgaccacgggtgacggggaatcagggttcgattccggagagggagcctgagaaacggctaccacatccaaggaaggcagcaggcgcgcaaattacccactcccgacccggggaggtagtgacgaaaaataacaatacaggactctttcgaggccctgtaattggaatgagtccactttaaatccttccgcgaggatccattggagggcaagtctggtgccagcagccgcggtaattccagctccaatagcgtatattaaagttgctgcagttaaaaagctcgtagttggatcttgggagcgggcgggcggtccgccgcgaggcgagccaccgcccgtccccgccccttgcctctcggcgccccctcgatgctcttagctgagtgtcccgcggggcccgaagcgtttactttgaaaaaattagagtgttcaaagcaggcccgagccgcctggataccgcagctaggaataatggaataggaccgcggttctattttgttggttttcggaactgaggccatgattaagagggacggccgggggcattcgtattgcgccgctagaggtgaaattcttggaccggcgcaagacggaccagagcgaaagcatttgccaagaatgttttcattaatcaagaacgaaagtcggaggttcgaagacgatcagataccgtcgtagttccgaccataaacgatgccgactggcgatgcggcggcgttattcccatgacccgccgggcagcttccgggaaaccaaagtctttgggttccggggggagtatggttgcaaagctgaaacttaaaggaattgacggaagggcaccaccaggagtggagcctgcggcttaatttgactcaacacgggaaacctcacccggcccggacacggacaggattgacagattgatagctctttctcgattccgtgggtggtggtgcatggccgttcttagttggtggagcgatttgtctggttaattccgataacgaacgagactctggcatgctaactagttacgcgacccccgagcggtcggcgtcccccaacttcttagagggacaagtggcgttcagccacccgagattgagcaataacaggtctgtgatgcccttagatgtccg
gggctgcacgcgcgctacactgactggctcagcgtgtgcctaccctacgccggcaggcgcgggtaacccgttgaaccccattcgtgatggggatcggggattgcaattattccccatgaacgaggaa ttcccagtaagtgcgggtcataagcttgcgttgattaagtccctgccctttgtacacaccgcccgtcgctactaccgattggatggtttagtgaggccctcggatcggcccc-gcgggtgcggcccacggccctggcg gagcgctgagaaggacggtcgaacttgactatctagaggaagtaaaagtcgtaacaaggtttccgta ggtgaacctgcggaaggatcatta
ꢀ‑3’
[0025]
seq id no.8驼源性基因核苷酸序列:
[0026]5’‑
atgacaaacatccgaaaatcacacccacttctaaaaattataaacgacgcattcattgaccttcc agccccctccaatatttcatcatgatgaaacttcggctctctactaggagtttgcttaattatacaaatcctgacaggactattcctggcaatacattatacatccgacacaacaacagccttctcttcagtcgcacacatctgccgagatgttaactacggctgaatcattcgatatttacatgctaacggagcttccatattcttcatttgcttatatattcacgtgggtcgcgggctttattacggctcgtataccttttcagaaacctgaaacgttggaattgttttattgttcacagtaatagcaacagctttcatgggctacgtccttccatgaggacagatatcattctgaggagcaacagtaattactaatttgctctcagcaatcccctatatcggcacaacactagtagaatggatttgaggtggtttctccgtagataaagccaccctcacacgattcttcgccttccatttcatcctaccattcattatcacggctctagtagccctatacatactatttcaacacgaaacaggttctaataacccaacaggaatttcctcagacatagataaaatcccattccatccctattacacgattaaagatatcctaggagcactactactgatgctagccctacttatcctcgtattattctcaccagacttattaggagaccctgacaactacactcccgccaaccccctcaatacaccaccacatatcaagccggaatgatatttcctgttcgcatacgctattctacgatcaatccccaacaaattaggaggcgtactggccttagttctctccatcttaatcctagcatttatccccgcactacacacatcaaaacaacgaagcataacattccgtcccattagtcaatgcctgttttgagtactagtagctgatctactaaccctgacatgaattgggggacaaccagtagaacccccattcatcataattggccaagtggcatctatcctgtacttctccctaatcctaattctcatgcccgtagcaggaatcattgaaaaccgtatcctaaaatgaaga
ꢀ‑3’
[0027]
优选的,阳性对照中seq id no.7所示内标模板核苷酸和seq id no.8所示的驼源性基因核苷酸序列浓度均为1e+5copies/ml。
[0028]
优选的,所述阳性对照为将seq id no.7所示的内标模板核苷酸序列和seq id no.8所示的驼源性基因核苷酸序列分别连入质粒后,用去rna酶水稀释为相应浓度制备得到,所述质粒种类无限制。
[0029]
进一步的,所述空白对照为去rna酶水。
[0030]
本发明的第四个目的是提供一种骆驼源性核酸的检测方法,所述方法包括以下步骤:
[0031]
步骤1,提取待测样品基因组dna;
[0032]
步骤2,对待测样品基因组dna进行实时荧光pcr检测:
[0033]
2-1,试剂准备:
[0034]
计算配制份数n,所述n=检测样本份数+1份阳性对照+1份空白对照;配制相应配制份数的骆驼源性核酸检测反应液,所述各份骆驼源性核酸检测反应液包括核酸扩增反应液和驼源检测液;
[0035]
优选的,各份骆驼源性核酸检测反应液包括12.5μl核酸扩增反应液和7.5μl驼源检测液;
[0036]
2-2,核酸加样:
[0037]
将步骤1提取的待测样品dna、阳性对照、空白对照分别加入2-1所述骆驼源性核酸检测反应液中;
[0038]
优选的,所述待测样品dna、阳性对照、空白对照的加入量均为5μl;
[0039]
2-3,pcr扩增检测:
[0040]
将2-2获得的反应体系置于荧光定量pcr仪进行检测;
[0041]
步骤3,结果判读:
[0042]
3-1,检测有效性判读:
[0043]
当阳性对照的fam通道检测结果在ct≤30,且内标vic通道检测结果ct≤30;同时,空白对照的fam和vic通道无ct值,为有效结果;
[0044]
3-2,阳性判读:
[0045]
当待测样本在vic通道检测结果ct≤40,fam通道检测结果ct≤40,曲线呈s型且有明显指数增长期,判读为阳性,所述待测样品含有骆驼源性基因;
[0046]
当待测样本在vic通道检测结果ct≤40,fam通道ct>40或者未检出时,判读为阴性;
[0047]
所述待测样品不含有骆驼源性基因。
[0048]
当待测样本的内标在vic通道检测结果ct>40或者未检出时,为无效结果。
[0049]
进一步的,步骤1所述提取待测样品基因组dna使用基因组dna提取试剂或基因组dna提取试剂盒提取,优选的,步骤1所述提取待测样品基因组dna使用江苏硕世生物科技股份有限公司sdkf60102核酸提取试剂盒进行核酸提取,按照说明书操作。
[0050]
进一步的,步骤2-3中扩增程序为:
[0051]
步骤
①
:95℃
×
30s;1cycles
[0052]
步骤
②
:95℃
×
1s,58℃
×
10s;40cycles
[0053]
在步骤
②
58℃时时荧光检测,fam和vic检测通道采集荧光信号。
[0054]
本发明核苷酸序列中所述“r”是指腺嘌呤或鸟嘌呤中任意嘌呤,“y”是指胞嘧啶或胸腺嘧啶中任意嘧啶。
[0055]
本发明技术方案相对于现有技术具有以下有益效果:
[0056]
本发明提供了一款快速、特异性高、假阴性率低、仪器适用性广且精密度高的骆驼源性核酸检测试剂盒和一种高效快速的检测骆驼源性核酸的方法,其中所述试剂盒成本低,检测时间短;所述检测方法准确率高、减少了操作步骤且缩短了操作时间,不论是试剂盒还是检测方法均具有很好的市场价值。
[0057]
国家质量监督检验检疫总局、国家市场监督管理总局、海关总署和内蒙古自治区市场监督管理局于2016-2020年陆续发布了关于骆驼源性成分检测的相关标准,从样本前处理、核酸提取和pcr时间几个指标方面与本试剂盒与方法进行对比,具体数据如表1所示:
[0058]
表1
[0059][0060]
上述数据分析显示,从样本前处理、核酸提取到pcr时间,本试剂盒与方法比当前标准有从操作便捷性和时间上都显示出明显的优势,并且本试剂盒设置了哺乳动物的18s rrna作为内标,可有效监控从样本采集、样本处理、核酸提取到pcr的整个过程,保证实验的有效性。
附图说明
[0061]
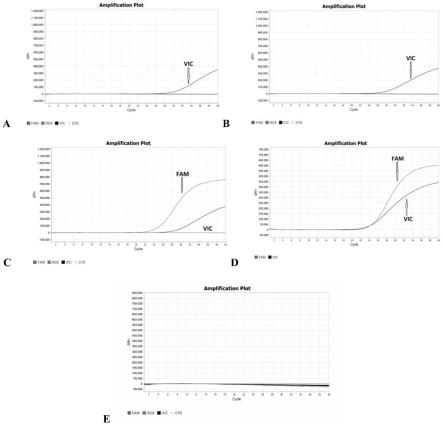
图1奶粉类样本特异性验证荧光pcr的扩增检测结果图;其中,图1a为牛奶粉样本检测结果图,图1b为羊奶粉样本检测结果图,图1c为驼奶粉样本检测结果图,图1d为阳性对照检测结果图,图1e为空白对照检测结果图;
[0062]
图2猪肉鲜肉、骆驼肉制品和骆驼鲜肉样本荧光pcr的扩增检测结果图;其中,图2a为猪肉鲜肉样本检测结果图,图2b为千驹烤驼肉样本检测结果图,图2c为大漠烤驼肉样本检测结果图,图2d为骆驼鲜肉样本检测结果图,图2e为阳性对照检测结果图,图2f为空白对照检测结果图;
[0063]
图3不同质量浓度驼奶粉样本荧光pcr的扩增检测结果图,其中,图3a、b、c、d、e、f、g、h、i、j分别依次是30%、20%、10%、8%、5%、3%、1%、0.5%、0.1%质量浓度和空白对照的结果图。
具体实施方式
[0064]
以下结合实施例来进一步解释本发明,但实施例并不对本发明做任何形式的限定。
[0065]
实施例1
[0066]
1、设计用于检测骆驼源性核酸的引物序列和第一探针序列,并人工合成上述所设计的引物序列和第一探针序列:
[0067]
第一引物:5’gattcttygccttccayttcatcc 3’(seq id no.1);
[0068]
第二引物:5’ggaatgggattttrtctatgtctgagga 3’(seq id no.2);
[0069]
第一探针:5’acacgaaacaggytctaataacccracagg 3’(seq id no.3),所述第一探针的5'标记fam荧光基团,3'标记bhq1荧光猝灭基团;。
[0070]
2、设计针对内标的引物序列和第二探针序列,并人工合成上述所设计的引物序列和第二探针序列:
[0071]
第三引物:5’tctgccctatcaactttcgatg 3’(seq id no.4);
[0072]
第四引物:5’aatttgcgcgcctgctg 3’(seq id no.5);
[0073]
第二探针:5’ccgtttctcaggctccctctccg 3’(seq id no.6),所述第二探针的5'标记vic荧光素,3'标记bhq1荧光猝灭基团。
[0074]
3、设计内标模板序列,并参照该内标模板序列人工制备内标质粒:
[0075]
1)内标模板序列为如seq id no.7所示的哺乳动物的18s rrna全长核苷酸序列:
[0076]
2)参照seq id no.7所示核苷酸序列进行内标质粒的制备,然后用去rna酶水将制备好的内标质粒稀释到1e+5copies/ml,将该稀释好的液体作为所述试剂盒中的阳性对照的组分。
[0077]
4、设计驼源性基因的核苷酸序列,并参照该序列人工制备驼源性基因质粒:
[0078]
1)驼源性基因序列为如seq id no.8所示的核苷酸序列:
[0079]
2)参照seq id no.8所示核苷酸序列进行驼源性基因质粒的制备,然后用去rna酶水将制备好的内标质粒稀释到1e+5copies/ml,将该稀释好的液体作为所述试剂盒中的阳性对照的组分。
[0080]
5、制备试剂盒:
[0081]
所述试剂盒核酸扩增反应液、驼源检测液、阳性对照和空白对照。
[0082]
每12.5μl所述核酸扩增反应液中包括荧光pcr缓冲液4μl、dntp(u)s 0.2mm、mg
2+
3mm、热启动taq dna聚合酶0.6u和udg酶0.15u。
[0083]
所述驼源检测液中包括seq id no.1~seq id no.6所述引物探针组合,所述驼源检测液中各引物浓度为400nm,各探针浓度为400nm,所述驼源检测液溶剂为te。
[0084]
所述阳性对照如上述步骤“3,2)”和步骤“4,2)”方法制备。
[0085]
所述空白对照为去rna酶水
[0086]
以上试剂-20℃保存。
[0087]
6、提取待测样品基因组dna
[0088]
本实施例待测样品为市售骆驼奶及乳粉或市售骆驼肉及肉制品。
[0089]
6-1样本前处理:
[0090]
1)乳粉样本处理:
[0091]
称取乳粉100mg,加入600ul蒸馏水充分溶解混匀备用。
[0092]
2)肉及肉制品样本处理:
[0093]
称取25mg鲜肉或肉制品,剪成小碎块,备用。
[0094]
6-2骆驼源性核酸样本的提取:
[0095]
经步骤6-1前处理后的样本,使用sdkf60102(江苏硕世生物科技股份有限公司)核酸提取试剂盒进行核酸提取,具体步骤按照说明书操作进行,获得待测样品基因组dna。
[0096]
7.对待测样品基因组dna进行实时荧光pcr检测:
[0097]
7-1试剂准备
[0098]
计算配制份数n,所述n=检测样本份数+1份阳性对照+1份空白对照;取出步骤5制备的“驼源核酸检测试剂盒(荧光pcr法)”,在室温下融化并振荡混匀后,低速离心10秒,计
算需准备反应试剂反应数(n=样本数+2管对照)。根据下述表2配置驼源性核酸检测反应液:
[0099]
表2
[0100]
反应液组份加量(μl)/每反应核酸扩增反应液12.5驼源检测液7.5总体积20
[0101]
7-2核酸加样
[0102]
取n个pcr反应管,将表1所述骆驼源性核酸检测反应液按20μl的量分装到n个pcr反应管中。
[0103]
检测样本管为向pcr反应管中分别加入处理好的待测样本核酸5μl,1份阳性对照管加入阳性对照5μl、1份空白对照管中加入空白对照5μl,终体积为25μl/管,盖紧管盖,瞬时低速离心。
[0104]
7-3pcr扩增检测
[0105]
采用的荧光定量pcr仪为quantstudio
tm
5,根据下述表3设置扩增程序:
[0106]
表3
[0107][0108]
7-4结果判读
[0109]
在仪器正常,阳性对照和空白对照均正常的情况下进行结果分析,根据下述进行结果判读:
[0110]
检测有效性判读:
[0111]
当阳性对照的fam通道检测结果在ct≤30,且内标vic通道检测结果ct≤30;同时,空白对照的fam和vic通道无ct值,为有效结果;
[0112]
阳性判读:
[0113]
当待测样本的内标在vic通道检测结果ct≤40,fam通道检测结果ct≤40,曲线呈s型且有明显指数增长期,判读为阳性,所述待测样品含有骆驼源性基因;
[0114]
当待测样本的内标在vic通道检测结果ct≤40,fam通道ct>40或者未检出时,判读为阴性;所述待测样品不含有骆驼源性基因。
[0115]
当待测样本的内标在vic通道检测结果ct>40或者未检出时,为无效结果。
[0116]
下列实施例中未注明具体条件的实施方法,通常按照常规条件或者试剂盒生产厂家推荐的方法进行。
[0117]
实施例2:本发明所述含内标的用于检测骆驼源性核酸的试剂盒的特异性
[0118]
1.奶粉类样本
[0119]
购买市场常见的皇家美素佳儿牛奶粉(购自菲仕兰食品贸易有限公司)、佳贝艾特
羊奶粉(购自海普诺凯营养品有限公司)、原始黄金驼奶粉(购自新疆原始黄金乳业有限公司),经实施例1所述方法进行检测,验证检测试剂的特异性,结果如图1所示:
[0120]
阳性对照的fam通道ct值为22,vic通道ct值为23,空白对照的fam和vic通道均无ct值,表明该检测有效;牛羊奶粉fam通道(驼源性基因)未检出、vic通道检测ct值分别为34和29;驼奶粉fam通道检测ct值为22、vic通道检测ct值为27,曲线呈s型且有明显指数增长期,结果说明骆驼源性核酸试剂盒可以特异性检测出奶粉类驼源性样本核酸。
[0121]
2.骆驼鲜肉样本
[0122]
随机选择市售的猪肉鲜肉、骆驼肉制品(商品名称分别为:千驹烤驼肉、大漠烤驼肉)和骆驼鲜肉,将肉剪成小碎块直接放入核酸提取试剂盒进行核酸提取(各样本分别设置3个重复进行实验),随后使用实施例1所述本研究建立的方法进行检测,结果如图2所示:
[0123]
阳性对照的fam通道ct值为22,vic通道ct值为23,空白对照的fam和vic通道均无ct值,表明该检测有效;猪肉鲜肉fam通道(驼源性基因)未检出,vic通道ct值在29左右,千驹和大漠烤驼肉样本fam通道ct值分别在26和20左右,vic通道ct值分别在27和30左右,骆驼鲜肉fam通道ct值在19左右,vic通道ct值在31左右,各通道曲线呈s型且有明显指数增长期,其中骆驼肉制品三个样本间ct值差异较大,可能是受样品中佐料的影响,结果说明本研究的检测方法通过骆驼源性核酸试剂盒可以直接特异性检测出骆驼肉制品和鲜肉中的骆驼源性核酸。
[0124]
实施例3:本发明所述含内标的用于检测骆驼源性核酸的试剂盒的奶粉样本灵敏度
[0125]
骆驼乳制品中掺入其他源性成分乳粉,使其成本大大降低,这种制假、掺假的恶劣行为不仅会损害消费者的经济利益,还会对身体造成不同程度的损害。如果消费者对掺入的乳粉成分过敏,在不知情的情况下误食极小微量也可能会产生过敏反应,甚至危及生命。因此,检测方法的灵敏度对于乳及乳制品的掺杂掺假判定具有重要意义。本研究将驼奶粉按30%、20%、10%、8%、5%、3%、1%、0.5%、0.1%的质量浓度混入10g牛奶粉中,加入60ml水混匀,经核酸提取(每个样本设置8个重复)采用实施例1所述方法进行检测,结果如表4、图3所示:
[0126]
表4
[0127]
质量浓度(%)ct均值(fam)ct均值(vic)10022.8627.553029.5232.322030.0432.041030.9332.55832.4532.86532.7932.62333.1233.18135.7932.670.537.2132.82
[0128]
当驼奶粉按照30%、20%、10%、8%、5%、3%、1%和0.5%的质量浓度掺入至牛奶粉中时,fam通道(检测驼源性基因)均能检出,检出率为100%,0.1%质量浓度的样本,fam
通道检出率为12.5%,0.05%质量浓度的样本,fam通道检出率为0%。从表5中可以明显看出fam通道ct值随驼奶质量浓度升高而逐渐变小,不同质量浓度样本的vic通道(检测内标)均能检出,检测ct值<34。上述结果表明,本研究建立的检测奶粉类样本方法的灵敏度为驼奶粉的质量浓度0.5%。
[0129]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1