一种基于双重PCR检测羊肚菌交配型的引物组、试剂盒和检测方法
一种基于双重pcr检测羊肚菌交配型的引物组、试剂盒和检测方法
技术领域
1.本发明属于生物学鉴定技术领域,具体涉及一种基于双重pcr检测羊肚菌交配型的引物组、试剂盒和检测方法。
背景技术:
2.羊肚菌在生物分类上属于子囊菌门,为世界著名的食药兼用用菌,风味独特,并具有抗氧化、消炎、抗菌、免疫刺激和抗肿瘤等多种生物活性。2012年以来,羊肚菌首次在我国四川实现大田栽培,并快速向全国辐射,栽培规模逐年扩大。
3.羊肚菌中包含两种交配型菌丝,分别为mat1-1和mat1-2。2017年首次确定羊肚菌的有性生殖方式为异宗配合,即需要含有不同交配型的单倍体融合后才能进行有性生殖(杜习慧,杨祝良,cn107151698a)。
4.在羊肚菌菌种生产的全部环节(母种,原种,栽培种),对其交配型基因进行检测,确保在菌种生产过程中两个交配型基因均不丢失,从源头上保障菌种质量,为羊肚菌产业的发展提供良种保障,对羊肚菌产业的健康发展具重要意义。目前,对羊肚菌交配型的检测方法主要是pcr。当前交配型基因检测方法主要为单重pcr检测技术,一次只能检测一种交配型基因,比较费时间。因此,在羊肚菌的大规模生产和商业化种植过程中,急需建立一种准确,快速,简便的羊肚菌交配型基因检测方法。
技术实现要素:
5.本发明的目的在于提供一种基于双重pcr检测羊肚菌交配型的引物组、试剂盒和检测方法,只需一次双重pcr反应和一次电泳即可同时检测出mat1-1和mat1-2基因2个目的片段,节约昂贵试剂、pcr反应时间和电泳时间,且具有非常好的特异性,广泛适用性和实用性。
6.本发明提供了一种基于双重pcr检测羊肚菌交配型的引物组,包括针对羊肚菌交配型基因mat1-1和mat1-2设计得到的引物对;
7.其中针对mat1-1设计的引物对的核苷酸序列如seq id no.1和seq id no.2所示;
8.针对mat1-2设计的引物对的核苷酸序列如seq id no.3和seq id no.4所示。
9.本发明还提供了一种基于双重pcr检测羊肚菌交配型的试剂盒,包括上述引物组。
10.优选的,所述试剂盒中还包括阳性对照和阴性对照;
11.所述阳性对照为分别包含羊肚菌交配型基因mat1-1和mat1-2的基因。
12.优选的,所述试剂盒中还包括构建双重pcr检测体系的其他试剂。
13.本发明还提供了一种基于双重pcr鉴定羊肚菌交配型的方法,包括以下步骤:构建包含上述引物组和待测样品基因组模板dna的双重pcr检测体系;
14.对所述双重pcr检测体系进行pcr扩增,当扩增产物同时出现650bp和428bp两个条带,表明待测样品同时含有mat1-1和mat1-2两种交配型基因;
15.当扩增产物只出现650bp的一个条带,表明待测样品只含有mat1-1一种交配型基因;
16.当扩增产物只出现428bp的一个条带,表明待测样品只含有mat1-2一种交配型基因。
17.优选的,所述双重pcr检测体系以25μl计,包括:2
×
taq dna聚合酶混合液12.5μl,ddh2o 7.5μl,mat1-1引物对各1μl,mat1-2引物对各1μl和模板dna 1μl。
18.优选的,所述双重pcr检测体系中mat1-1引物对中上下游引物的终浓度均为0.4μm,mat1-2引物对中上下游引物的终浓度均为0.05~0.2μm。
19.优选的,所述pcr扩增的程序,包括:94℃预变性3min;94℃变性60s,50~53℃退火30s,72℃延伸60~120s,35个循环;72℃延伸10min。
20.本发明还提供了上述引物组或上述试剂盒或上述方法在鉴定羊肚菌交配型中的应用。
21.本发明还提供了上述引物组或上述试剂盒或上述方法在培育目标交配型羊肚菌新品种中的应用。
22.有益效果:本发明提供了一种基于双重pcr检测羊肚菌交配型的引物组,可作为羊肚菌交配型检测引物,特异性强,具有非常好的敏感性,检测限低。并且本发明所述引物组彼此间无交叉,假阳性率低,能够特异性的检测出不同羊肚菌菌株的2种交配型基因,具有非常好的特异性,广泛适用性和实用性。
23.本发明还基于上述引物组构建了检测试剂盒和检测方法,通过一次双重pcr同时检测双交配型基因位点,节约昂贵试剂、pcr反应时间和电泳时间等,具有稳定、准确、高效和经济等特性。本发明所述检测试剂盒和检测方法,可在羊肚菌菌种生产的各个环节(母种、原种和栽培种)进行交配型基因鉴定,对羊肚菌菌种生产的各环节都具有重大应用价值。利用上述检测试剂盒和检测方法进行交配型鉴定,无需再进行克隆、测序和序列比对,一次实验即可检测出待测样品中的交配型,克服了以往单一检测的操作繁琐、灵敏度低、适用性低等诸多限制,具有广阔的应用前景。
附图说明
24.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
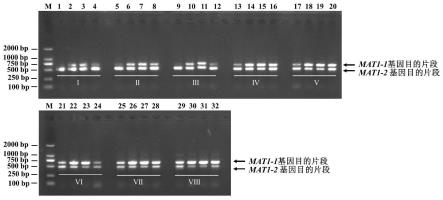
25.图1为不同mat1-2引物浓度下交配型基因检测双重pcr电泳图;其中m:dnamarker;泳道1、5、9、13、17、21、25和29为羊肚菌母种1,泳道2、6、10、14、18、22、26和30为羊肚菌母种2,泳道3、7、11、15、19、23、27和31为羊肚菌母种3,泳道4、8、12、16、20、24、28和32为羊肚菌母种4,在扩增体系中mat1-1引物终浓度为0.4μm,将mat1-2引物终浓度按不同比例降低,编号i-viii扩增体系中mat1-2引物终浓度分别为0.4μm,0.2μm,0.133μm,0.08μm,0.067μm,0.057μm,0.05μm;
26.图2为不同退火温度下交配型基因检测双重pcr电泳图;其中m:dna marker;泳道1、5、9和13为羊肚菌母种1,泳道2、6、10和14为羊肚菌母种2,泳道3、7、11和15为羊肚菌母种
3,泳道4、8、12和16为羊肚菌母种4;
27.图3为不同延伸时间下羊肚菌母种交配型检测双重pcr电泳图;其中m:dnamarker;泳道1、5、9、13和17为羊肚菌母种1,泳道2、6、10、14和18为羊肚菌母种2,泳道3、7、11、15和19为羊肚菌母种3,泳道4、8、12、16和20为羊肚菌母种4;
28.图4为羊肚菌不同母种交配型基因双重pcr扩增结果电泳图;其中m:dna marker,编号1~6分别代表6个不同母种;pc:阳性对照;nc:阴性对照;
29.图5为羊肚菌不同原种交配型基因双重pcr扩增结果电泳图;其中m:dna marker,编号1~6分别代表6个不同原种;pc:阳性对照;nc:阴性对照;
30.图6为羊肚菌不同栽培种交配型基因双重pcr扩增结果电泳图;其中m:dnamarker,编号1~6分别代表6个不同栽培种;pc:阳性对照;nc:阴性对照;
31.图7为羊肚菌不同母种交配型基因单重pcr扩增结果电泳图;其中m:dna marker,编号1-6分别代表6个不同母种;pc:阳性对照;nc:阴性对照;a:mat1-1基因pcr扩增结果,b:mat1-2基因pcr扩增结果;
32.图8为羊肚菌不同原种交配型基因单重pcr扩增结果电泳图;其中m:dna marker,编号1-6分别代表6个不同原种;pc:阳性对照;nc:阴性对照;a:mat1-1基因pcr扩增结果,b:mat1-2基因pcr扩增结果;
33.图9为羊肚菌不同栽培种交配型基因单重pcr扩增结果电泳图;其中m:dnamarker,编号1-6分别代表6个不同栽培种;pc:阳性对照;nc:阴性对照;a:mat1-1基因pcr扩增结果,b:mat1-2基因pcr扩增结果。
具体实施方式
34.本发明提供了一种基于双重pcr检测羊肚菌交配型的引物组,包括针对羊肚菌交配型基因mat1-1和mat1-2设计得到的引物对;
35.其中针对mat1-1设计的引物对的核苷酸序列如seq id no.1和seq id no.2所示;
36.针对mat1-2设计的引物对的核苷酸序列如seq id no.3和seq id no.4所示。
37.本发明中,羊肚菌交配型基因mat1-1的引物对:
38.上游引物序列:5
’‑
ccaccttctgagtccattac-3’seq id no.1;
39.下游引物序列:5
’‑
gttattctcgacaaggtgtgg-3’seq id no.2;
40.羊肚菌交配型基因mat1-2:
41.上游引物序列:5
’‑
ttattagaccatgttcctcga-3’seq id no.3;
42.下游引物序列:5
’‑
cagtattatcaccaaccgtac-3’seq id no.4。
43.本发明还提供了一种基于双重pcr检测羊肚菌交配型的试剂盒,包括上述引物组。
44.本发明所述试剂盒中优选还包括阳性对照和阴性对照;其中阳性对照为分别包含羊肚菌交配型基因mat1-1和mat1-2的基因片段,实施例中以含有羊肚菌交配型基因mat1-1和mat1-2的样品dna完整序列的质粒作为模板的阳性对照组,以不含有羊肚菌交配型基因mat1-1和mat1-2的样品dna作为模板的阴性对照组,且对于阴性对照组中的dna序列及来源都没有特殊限定。
45.本发明所述试剂盒中优选还包括构建双重pcr检测体系的其他试剂,如2
×
taq dna聚合酶混合液和ddh2o。
46.本发明还提供了一种基于双重pcr鉴定羊肚菌交配型的方法,包括以下步骤:构建包含上述引物组和待测样品基因组模板dna的双重pcr检测体系;
47.对所述双重pcr检测体系进行pcr扩增,当扩增产物同时出现650bp和428bp两个条带,表明待测样品同时含有mat1-1和mat1-2两种交配型基因;
48.当扩增产物只出现650bp的一个条带,表明待测样品只含有mat1-1一种交配型基因;
49.当扩增产物只出现428bp的一个条带,表明待测样品只含有mat1-2一种交配型基因。
50.本发明所述双重pcr检测体系以25μl计,优选包括:2
×
taq dna聚合酶混合液12.5μl,ddh2o 7.5μl,mat1-1引物对各1μl,mat1-2引物对各1μl和模板dna 1μl。且在所述双重pcr检测体系中mat1-1引物对上下游引物的终浓度优选均为0.4μm,mat1-2引物对上下游引物的终浓度优选均为0.05~0.2μm。本发明对所述模板dna的取样并没有特殊限定,利用羊肚菌的在任意时期的任意组织均可进行提取,如母种、原种或栽培种。本发明对所述模板dna的提取方法并没有特殊限定,只需要满足a260/280比值为1.8~2.0即可。
51.本发明所述pcr扩增的程序,优选包括:94℃预变性3min;94℃变性60s,50~53℃退火30s,72℃延伸60~120s,35个循环;72℃延伸10min;更有选包括:94℃预变性3min;94℃变性1min,52℃退火30s,72℃延伸120s,35个循环;72℃延伸10min。本发明利用所述pcr扩增的产物进行结果判定时,当阳性对照的mat1-1和mat1-2都出现目的条带,阴性对照无目的条带时,检测结果有效。当阴性对照出现条带时,表明操作过程中有试剂污染,检测结果无效;当阳性对照无条带时,表明引物或者试剂盒中相关试剂降解,引物或试剂盒失效。
52.表1羊肚菌交配型基因mat1-1和mat1-2 pcr检测结果判定标准
[0053][0054]
本发明所述检测方法或所述试剂盒适用于羊肚菌菌种选育、栽培、交配型基因和系统发育等方面,因此提出如下应用:
[0055]
本发明还提供了上述引物组或上述试剂盒或上述方法在鉴定羊肚菌交配型中的应用。
[0056]
本发明在所述应用中进行羊肚菌交配型的鉴定方法优选与上述相同,在此不再赘述。
[0057]
本发明还提供了上述引物组或上述试剂盒或上述方法在培育目标交配型羊肚菌新品种中的应用。
[0058]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种基于双重pcr检测羊肚菌交配型的引物组、试剂盒和检测方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0059]
实施例1
[0060]
羊肚菌双重pcr交配型基因检测技术优化
[0061]
1.样品采集:供试菌株在羊肚菌培养基培养,在平板生长的菌丝用刀片刮出,原种或栽培种用镊子夹出菌丝,置于离心管中,迅速放入液氮中30s,快速取出后放入-20℃保存备用。
[0062]
2.羊肚菌总dna的提取:取0.1g真菌菌丝样品,用液氮研磨至颗粒均匀的粉末状,用真菌基因组dna提取试剂盒,提取羊肚菌总dna。提取结束后用核酸分析仪检测dna质量,当a260/280比值为1.8~2.0时,可用于pcr扩增,也可采用琼脂糖凝胶电泳,弱电泳后出现基因组条带,可用于pcr扩增。
[0063]
3.所用引物:羊肚菌交配型基因mat1-1:
[0064]
上游引物序列:5
’‑
ccaccttctgagtccattac-3’seq id no.1;
[0065]
下游引物序列:5
’‑
gttattctcgacaaggtgtgg-3’seq id no.2;
[0066]
羊肚菌交配型基因mat1-2:
[0067]
上游引物序列:5
’‑
ttattagaccatgttcctcga’seq id no.3;
[0068]
下游引物序列:5
’‑
cagtattatcaccaaccgtac-3’seq id no.4。
[0069]
4.pcr扩增体系:采用25μl反应体系,成分如下:2
×
taq mix12.5μl,ddh2o7.5μl,mat1-1和mat1-2上下游引物各1μl,模板dna 1μl,在0.2ml pcr管中加入上述成分,充分混匀,置于pcr仪样本室,执行以下pcr扩增程序:94℃预变性3min;94℃变性1min,52℃退火30s,72℃延伸60s,35个循环;72℃延伸10min,4℃保温。
[0070]
5.pcr扩增产物的检测:所有扩增产物在1.5%(w/v)琼脂糖凝胶上电泳检测,结束电泳后,取出凝胶置于凝胶成像仪中观察结果并拍照。
[0071]
6.结果判定:当阳性对照的mat1-1和mat1-2都出现目的条带,阴性对照无目的条带时,检测结果有效。当检测结果有效时,参照表1进行结果判定。
[0072]
7.不同mat1-2引物浓度下交配型基因双重pcr扩增效果:以羊肚菌母种dna样品1,2,3,4为模板,进行引物浓度筛选试验,在扩增体系中保持mat1-1引物终浓度为0.4μm不变,将mat1-2引物终浓度按不同比例降低,编号i-viii扩增体系中mat1-2引物终浓度分别为0.4μm,0.2μm,0.133μm,0.08μm,0.067μm,0.057μm,0.05μm。
[0073]
结果如图1所示,在扩增体系中mat1-1和mat1-2的引物终浓度分别为0.4μm和0.05~0.2μm时,可有效扩增出两个交配型基因;在扩增体系中mat1-1和mat1-2的引物终浓度分别为0.4μm和0.1μm时,两个目的条带的亮度相近,扩增效果最好。
[0074]
8.不同退火温度下羊肚菌交配型基因双重pcr扩增效果:以羊肚菌母种dna样品1,2,3,4为模板,设置50℃,51℃,52℃,53℃四个温度梯度,进行退火温度筛选试验,如图2所示,在退火温度为50~52℃时,均可有效扩增出目的条带;在退火温度为52℃,两个目的条带的亮度相近,扩增效果最好,为最优退火温度。
[0075]
9.不同延伸时间下羊肚菌交配型基因双重pcr扩增效果:以羊肚菌母种dna样品1,2,3,4为模板,设置60s,75s,90s,105s,120s五个延伸时间,进行延伸时间筛选试验,确立双重pcr最佳延伸时间,结果如图3所示,在延伸时间为60~120s时,均可有效扩增出两条目的条带;在延伸时间为120s时,两个目的条带的亮度相近,亮度最高,扩增效果最好,pcr扩增的最优程序为:94℃预变性3min;94℃变性1min,52℃退火30s,72℃延伸120s,35个循环;72
℃延伸10min。
[0076]
实施例2
[0077]
羊肚菌不同母种交配型鉴定
[0078]
利用实施例1优化的双重pcr方法对来自柏乡县的羊肚菌不同母种菌株,编号为1,2,3,4,5,6进行交配型基因检测,以通过单重pcr证明包含mat1-1和mat1-2两个交配型基因的dna为阳性对照,以不含mat1-1和mat1-2基因的dna为阴性对照,电泳结果如图4所示,实施例1优化的双重pcr检测方法,能够同时有效检测出不同羊肚菌母种中的两种交配型基因。
[0079]
采用已知专利中的单重pcr方法对结果进行验证(鉴定黑色羊肚菌类群中四个种的交配型方法和引物对,cn 106282397),能够有效扩增出两种交配型基因(图7)。
[0080]
实施例3
[0081]
羊肚菌不同原种交配型鉴定
[0082]
利用实施例1优化的双重pcr方法对来自柏乡县的羊肚菌不同原种菌株,编号为1,2,3,4,5,6进行交配型基因检测,以通过单重pcr证明包含mat1-1和mat1-2两个交配型基因的dna为阳性对照,以不含mat1-1和mat1-2基因的dna为阴性对照,电泳结果如图5所示,实施例1优化的双重pcr检测方法,能够同时有效检测出不同羊肚菌原种中的两种交配型基因。采用已知专利中的单重pcr方法对结果进行验证(鉴定黑色羊肚菌类群中四个种的交配型方法和引物对,cn 106282397),能够有效扩增出两种交配型基因(图8)。
[0083]
实施例4
[0084]
羊肚菌不同栽培种交配型鉴定
[0085]
利用实施例1优化的双重pcr方法对来自柏乡县的羊肚菌不同栽培种菌株,编号为1,2,3,4,5,6进行交配型基因检测,以通过单重pcr证明包含mat1-1和mat1-2两个交配型基因的dna为阳性对照,以不含mat1-1和mat1-2基因的dna为阴性对照,电泳结果如图6所示,实施例1优化的双重pcr检测方法,能够同时有效检测出不同羊肚菌栽培种中的两种交配型基因。采用已知专利中的单重pcr方法对结果进行验证(鉴定黑色羊肚菌类群中四个种的交配型方法和引物对,cn 106282397),能够有效扩增出两种交配型基因(图9)。
[0086]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1