一种利用生物源纳米颗粒影响细胞趋能运动活性的方法
1.本发明属于生物源纳米颗粒应用领域,涉及一种利用生物源纳米颗粒影响细胞趋能运动活性的方法,具体是一种通过调控细胞表面生物源纳米颗粒种类和浓度等特性实现影响细胞趋能运动活性的方法。
背景技术:
2.趋向运动是细菌在长期进化过程中形成的趋利避害的能力,是细菌通过感应环境中物理化学因素的变化,而调控其自身运动行为的一种生理机制。
3.常见的细菌趋向运动包括趋化运动和趋能运动等不同形式。趋化运动并不依赖于细菌细胞对趋化效应物的能量代谢,趋化效应物与趋化受体的结合足以启动趋化运动。与之相对,趋能运动则通常伴随着细胞对趋化效应物的能量代谢,影响细胞内电子传递链的氧化还原状态和质子动力势水平,从而引发细菌趋能运动行为。
4.希瓦氏菌是备受关注的一种典型异化金属还原菌,广泛分布于油田废弃物、水体氧化还原界面、地下含水层和水底沉积物等地球上几乎所有的中温环境中。研究发现,在水底沉积物等电子受体匮乏的天然环境中,shewanella oneidensis mr-1具有趋能运动的能力,经常聚集在局部高浓度电子受体区域。nealson等人在1995年applied and environmental microbiology第61卷第1551-1554页所发表的论文报道了趋能运动强度与趋向效应物(电子受体)的氧化还原电位有关。例如,氧气和硝酸盐具有较高的氧化还原电位从而使细胞表现出较强的趋能运动活性,而mr-1对二甲基亚砜和硫代硫酸盐等氧化还原电位较低的电子受体的趋能运动活性较弱。
5.harris等在2012年proceedings of the national academy of sciences第107卷第326-331页所发表的论文报道了s.oneidensis mr-1能够依靠泳动的方式靠近不溶性电子受体(如铁/锰矿物和电极等),即表现出直接趋能运动行为。细胞在不溶性电子受体附近的泳动速度显著提高,泳动方向变化频率增大,与电子受体直接接触碰撞的次数增多,而缺失胞外电子传递能力的突变株并无直接趋能运动行为。li等在2012年environmental science&technology第46卷第2813-2820页所发表的论文报道了采用群集运动平板法探究mr-1对铁/锰矿物的趋能运动,发现mr-1能够向胞外分泌微量的黄素类物质(~200nm),作为胞外电子传递穿梭体,介导细胞游向不溶性电子受体,即表现出介导趋能运动行为。
6.研究表明,不论是直接趋能运动行为或介导趋能运动行为,s.oneidensis mr-1向不溶性电子受体的趋能运动均以胞外电子传递为基础。mr-1细胞在进行胞外电子传递的过程中,将质子动力势或电子传递链氧化还原状态的变化情况转变成趋向响应行为的调控信号,并通过调用甲基趋化受体蛋白、趋化性组氨酸激酶和胞内信号转导通路等一系列组分最终传递至鞭毛运动系统,引发细胞向不溶性电子受体的趋能运动行为。
7.liu等人在2021年environmental science&technology第55卷第5559-5568页所发表的论文发现微生物细胞自身的趋能运动活性显著影响其在土壤和地下含水层中的扩散、运移和分布,进而可能影响通过生物强化等方式对污染土壤场地的修复效果。因此,利
用生物细胞自身合成活性,人为在细胞表面负载生物源纳米颗粒,影响细胞的趋能运动活性,可以有效调控细胞在待修复污染环境中的运移和分布,提高生物修复过程中投加和输送菌剂的可控性,改善修复效果。
8.综上可知,对于趋能运动活性的影响,可以从两方面进行改善:一方面增加细胞自身质量可以给细胞带来额外的“负担”,从而抑制细胞的趋能运动能力。另一方面可以通过促进细胞的胞外电子传递活性,从而促进细胞的趋能运动能力。因此,对于开发出一种新的手段来调控细胞质量以及胞外电子传递来调控趋能运动活性,从而改善土壤修复效果。
技术实现要素:
9.本发明提供一种利用微生物自身代谢活性制备负载生物源纳米颗粒的微生物细胞,通过调控纳米颗粒的种类以及浓度影响细胞趋能运动活性的方法。
10.本发明的技术方案如下:
11.一种利用生物源纳米颗粒影响细胞趋能运动活性的方法,步骤如下:
12.步骤1:负载生物源纳米颗粒细胞的制备
13.(1)负载硫化亚铁纳米颗粒细胞的制备
14.向厌氧瓶中加入1mm的硫代硫酸钠溶液和1mm氯化铁溶液,接种菌悬液后密封并静置培养,30℃条件下反应4、8、12和24h后,分别获得负载不同浓度硫化亚铁纳米颗粒的细胞;
15.(2)负载不同浓度硒单质纳米颗粒细胞的制备
16.向厌氧瓶中加入40mm的亚硒酸钠溶液,接种菌悬液后密封并静置培养,30℃条件下反应10、60、120、180min后,分别获得负载不同浓度硒单质纳米颗粒的细胞;
17.步骤2:泳动平板的制备
18.在lm培养基中制备含质量分数0.25%的琼脂的软琼脂板,倾倒平板前向其中加入8mm的水铁矿,得到用于测定细胞直接趋能运动活性的泳动平板;向加入水铁矿的平板中加入10~30μm aqds,得到间接趋能运动平板;
19.步骤3:微生物趋能运动活性测试
20.将步骤1中培养不同时间所收集的纳米颗粒细胞分别分散重悬于去离子水中,取2-3μl菌悬液接种至泳动平板,30℃条件下厌氧培养一定时间后测定并比较不同情形下扩散圈直径;
21.其中,硒单质纳米颗粒的细胞的泳动平板厌氧培养时间为48h,硫化亚铁纳米颗粒细胞的泳动平板厌氧培养时间为30h。
22.本发明的有益效果:
23.(1)本发明方法利用硫化亚铁颗粒具有导电作用,实验证明生物源硫化亚铁纳米颗粒可以镶嵌于细胞表面并与外膜细胞色素直接接触,可以促进细胞的胞外电子传递活性,从而促进细胞的趋能运动能力,提高生物修复过程中投加和输送菌剂的可控性,改善修复效果。
24.(2)本发明方法利用负载生物源硒纳米颗粒会增加细胞自身质量,给细胞带来额外的“负担”,从而抑制细胞的趋能运动能力。因此,负载硒纳米颗粒可以有效调控细胞在待修复污染环境中的运移和分布,改善修复效果。
附图说明
25.图1是负载不同浓度硫化亚铁纳米颗粒的希瓦氏菌泳动平板照片;(a)为直接趋能运动;(b)为10μm aqds条件下间接趋能运动;(c)为30μm aqds条件下间接趋能运动。
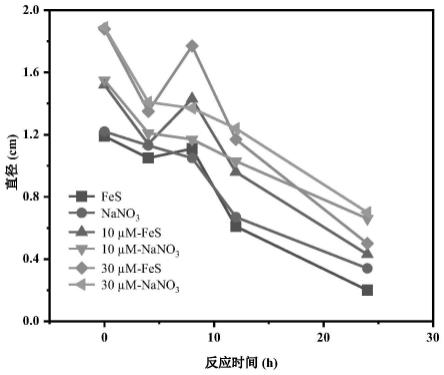
26.图2是负载不同浓度硫化亚铁纳米颗粒的希瓦氏菌泳动平板扩散圈直径随反应时间的变化情况。
27.图3是负载不同浓度硒单质纳米颗粒的希瓦氏菌泳动平板照片;(a)为直接趋能运动;(b)为10μm aqds条件下间接趋能运动。
28.图4是负载不同浓度硒单质纳米颗粒的希瓦氏菌游泳平板扩散圈直径随反应时间的变化情况。
具体实施方式
29.以下结合附图和技术方案,进一步说明本发明的具体实施方式。
30.实施例1:调控细胞负载硫化亚铁纳米颗粒浓度影响希瓦氏菌趋能运动活性
31.(1)向去离子水中分别加入胰蛋白胨0.05g/l、酵母浸粉0.1g/l、乳酸钠15mm、琼脂粉(0.25%),调节ph至7.2,曝n
2 30min,121℃高压灭菌20min后冷却备用;倾倒平板前向其中加入8mm的水铁矿及0~30μmaqds。
32.(2)向100ml的培养基中接种mr-1,置于30℃、100r/min恒温摇床中培养12h。吸取60ml菌液,低速离心(2000r/min,3min)以避免破坏细胞鞭毛,影响其泳动能力;将收集到的细胞洗涤2次后重悬于60ml去离子水得到菌悬液备用。
33.(3)称取0.79g硫代硫酸钠加入100ml去离子水中,溶解后得到50mm的硫代硫酸钠母液。称取0.81g氯化铁加入100ml去离子水中,溶解后即得到50mm的氯化铁母液。向厌氧瓶中分别加入1.05ml上述硫代硫酸钠和氯化铁母液、接种15ml菌悬液后静置培养,于反应0、4、8、12和24h分别取样离心。
34.(4)低速离心(2000r/min,3min)收集培养一定时间的细胞,重悬于20μl去离子水后,取2.5μl接种于泳动平板培养30h。
35.图2是泳动平板上扩散圈直径随时间变化的情形。随着培养时间的延长,细胞上负载硫化亚铁的浓度逐渐增加,在直接趋能运动实验中,当培养时间从0h到4h时,平板直径从1.19cm减小到1.05cm,下降了11.7%;培养时间为8h时,平板直径增加到1.11cm,提高了5.7%;培养时间为12h,平板直径减小到0.61cm,下降了45.0%;培养时间为24h时,平板直径继续减小到0.2cm,下降了67.2%。随着培养时间的增加,趋能运动先减弱再增强后减弱。
36.在加入10μm aqds的间接趋能运动实验中,当培养时间从0h到4h时,平板直径从1.52cm减小到1.14cm,下降了25.0%;培养时间为8h时,平板直径增加到1.43cm,提高了25.4%;培养时间为12h,平板直径减小到0.96cm,下降了32.8%;培养时间为24h时,平板直径继续减小到0.43cm,下降了55.2%。随着培养时间的增加,趋能运动先减弱再增强后减弱。
37.在加入30μm aqds的间接趋能运动实验中,当培养时间从0h到4h时,平板直径从1.88cm减小到1.35cm,下降了28.2%;培养时间为8h时,平板直径增加到1.77cm,提高了31.1%;培养时间为12h,平板直径减小到1.17cm,下降了33.9%;培养时间为24h时,平板直径继续减小到0.5cm,下降了57.2%。随着培养时间的增加,趋能运动先减弱再增强后减弱。
38.实施例2:调控硒单质纳米颗粒浓度影响希瓦氏菌趋能运动活性
39.(1)向去离子水中分别加入胰蛋白胨0.05g/l,酵母浸粉0.1g/l,乳酸钠15mm,琼脂粉(0.25%),调节ph至7.2,曝n
2 30min,121℃高压灭菌20min后冷却备用。倾倒平板前向其中加入8mm的水铁矿及0~30μm aqds。
40.(2)向100ml的培养基中接种mr-1,置于30℃、100r/min恒温摇床中培养12h。吸取60ml菌液,低速离心(2000r/min,3min)以避免破坏细胞鞭毛,影响其泳动能力;将收集到的细胞洗涤2次后重悬于60ml去离子水得到菌悬液备用。
41.(3)称取6.9gna2seo3粉末加入100ml超纯水中,溶解后即得到400mm的na2seo3母液。向厌氧瓶中加入4ml上述亚硒酸钠母液,接种8ml菌悬液后静置培养,于反应0、4、8、12和24h分别取样离心。
42.(4)低速离心(2000r/min,3min)收集培养一定时间的细胞,重悬于20μl去离子水后,取2.5μl接种于泳动平板培养48h。
43.图4是泳动平板上扩散圈直径随时间变化的情形。随着培养时间的延长,细胞上负载硒单质纳米颗粒的浓度逐渐增加,从0mm/个细胞到1.9
×
10-9
mm/个细胞。培养时间从0到180min,扩散圈直径持续下降,直接趋能运动平板上扩散圈直径从1.04cm降低至0.12cm,下降幅度达88.5%;间接趋能运动平板上扩散圈直径从1.16cm降低至0.15cm,下降幅度达87.1%,趋能运动活性持续减弱。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1