一种簸箕柳叶肉原生质体游离方法及瞬时表达体系的建立方法
1.本发明涉及分子生物学技术领域,尤其涉及一种簸箕柳叶肉原生质体游离方法及瞬时表达体系的建立方法。
背景技术:
2.簸箕柳(salixsuchowensis)隶属于杨柳科柳属,是原产于中国的小灌木,与木本植物模式物种-杨树是姊妹属。但与杨树相比,簸箕柳幼龄期短,一般杂交当年即可开花,而且植株矮小,可以进行大规模的田间实验,是进行木本植物遗传学研究的理想材料。随着簸箕柳全基因组测序、组装的完成,该树种有望成为新一代木本植物模式物种。但簸箕柳高效、稳定的遗传转化体系尚未建立,制约了其功能基因组学的研究。原生质体经过处理可以摄取病毒、质粒、dna等各种大分子,是进行遗传转化的理想受体材料,广泛应用于植物分子生物学与基因工程研究。为此,有必要提出一种簸箕柳叶肉原生质体游离及瞬时表达体系建立的方法,为高通量开展簸箕柳关键基因的功能研究与利用提供有力工具。
技术实现要素:
3.本发明的目的在于提供一种簸箕柳叶肉原生质体游离方法及瞬时表达体系的建立方法。
4.为了实现上述发明目的,本发明提供以下技术方案:
5.本发明提供了一种簸箕柳叶肉原生质体游离方法,包括如下步骤:
6.(1)酶溶液配制:在无菌双蒸水中加入甘露醇、kcl和mes缓冲液,进行第一水浴保温,然后加入纤维素酶r10、离析酶r10,进行第二水浴保温,然后冰浴,使溶液温度降为室温,再向溶液中加入cacl2、bsa、β-巯基乙醇,混匀后依次进行过滤、真空渗透,去除气泡,得酶溶液;
7.(2)酶解:将簸箕柳叶片沿垂直叶脉方向切成叶条,浸泡于步骤(1)所得酶溶液中,真空渗透25~35min,然后室温避光,酶解3.5~4.5h;
8.(3)w5溶液配制:在无菌双蒸水中加入nacl、cacl2、kcl和mes缓冲液,混匀得w5溶液;
9.(4)mmg溶液配制:在无菌双蒸水中加入甘露醇、mgcl2和mes缓冲液,混匀得mmg溶液;
10.(5)将步骤(2)酶解完成的簸箕柳叶片与等体积的w5溶液混合,得混合液;
11.(6)对所得混合液进行过滤、离心,吸掉上清液,沉淀部分即为原生质体;
12.(7)加入w5溶液重悬原生质体,冰浴25~35min,原生质体沉淀到底部,吸掉上清,将沉淀重悬于mmg溶液中,得簸箕柳叶肉原生质体悬浮液。
13.优选的,步骤(1)中所述甘露醇的浓度为0.3~0.5m,所述kcl的浓度为15~25mm,所述mes缓冲液的浓度为15~25mm,所述mes缓冲液的ph值为5~6,所述第一水浴保温的温
度为50~60℃,所述第一水浴保温的时间为4~6min,所述纤维素酶r10的浓度为10~20g/l,所述离析酶r10的浓度为3~5g/l,所述第二水浴保温的温度为50~60℃,所述第二水浴保温的时间为8~12min,所述cacl2的浓度为8~12mm,所述bsa的浓度为0.05~0.15wt%,所述β-巯基乙醇的浓度为4~6mm,所述过滤的孔径为0.2~0.4mm,所述真空渗透的时间为10~20min。
14.优选的,步骤(2)中所述簸箕柳叶片的来源为簸箕柳容器苗或簸箕柳组培苗,所述叶条的宽度为0.5~1mm,所述叶条与酶溶液的用量比为0.5~1.5g:100ml,所述酶解在摇动条件下进行,所述摇动的转速为45~55rpm。
15.优选的,步骤(3)中所述nacl的浓度为150~155mm,所述cacl2的浓度为120~130mm,所述kcl的浓度为4~6mm,所述mes缓冲液的浓度为1~3mm,所述mes缓冲液的ph值为5~6;
16.步骤(4)中所述甘露醇的浓度为0.3~0.5m,所述mgcl2的浓度为10~20mm,所述mes缓冲液的浓度为3~5mm,所述mes缓冲液的ph值为5~6。
17.优选的,步骤(6)中所述过滤采用细胞筛网进行,所述细胞筛网的孔径为65~75μm,所述离心的转速为80
×
g~120
×
g,所述离心的时间为1~3min;
18.步骤(7)中所述w5溶液的用量为0.8~1.2ml,所述mmg溶液的用量为0.8~1.2ml。
19.本发明还提供了上述游离方法得到的簸箕柳叶肉原生质体悬浮液。
20.本发明还提供了一种簸箕柳叶肉原生质体瞬时表达体系的建立方法,包括如下步骤:
21.(1)提取8~12μl的p2gwf7质粒dna;
22.(2)加入80~120μl簸箕柳叶肉原生质体悬浮液,混匀得混合液a;
23.(3)加入与所得混合液a等体积的peg溶液,混匀,室温孵育10~15min,间歇混匀,得混合液b;
24.(4)加入所得混合液b的两倍体积的w5溶液,混匀,终止转化;
25.(5)室温离心,吸掉上清液,将沉淀重悬于wi溶液中,得原生质体wi溶液;
26.(6)利用无菌小牛血清对6孔细胞培养皿润洗1~2s;
27.(7)将所述原生质体wi溶液移入细胞培养皿中,室温黑暗孵育10~14h;
28.(8)室温离心,弃掉上清液,簸箕柳叶肉原生质体瞬时表达体系建立完成。
29.优选的,步骤(1)中所述p2gwf7质粒dna的浓度为1.5~2.5μg/μl;
30.步骤(2)中所述簸箕柳叶肉原生质体悬浮液的细胞个数为1.5
×
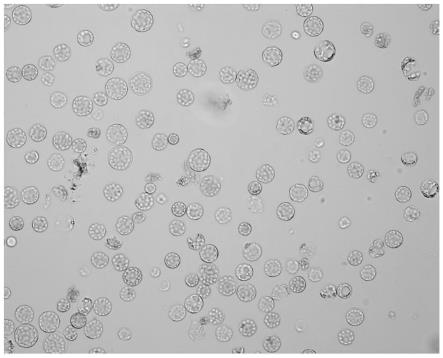
104~2.5
×
104。
31.优选的,步骤(3)中所述的peg溶液在转化前1~1.5h配制,所述peg溶液的配制过程为在无菌双蒸水中加入35~45%peg 4000、0.1~0.3m甘露醇、80~120mm cacl2;
32.步骤(4)中所述w5溶液的配制过程为在无菌双蒸水中加入150~155mm nacl、120~130mm cacl2、4~6mm kcl和1~3mm mes缓冲液,所述mes缓冲液的ph值为5~6;
33.步骤(5)和步骤(8)中所述室温离心的转速独立为80
×
g~120
×
g,所述室温离心的时间独立为1~3min。
34.优选的,步骤(5)中所述wi溶液的用量为0.8~1.2ml,所述wi溶液的配制过程为在无菌双蒸水中加入0.4~0.6m甘露醇、18~22mm kcl和3~5mm mes缓冲液,所述mes缓冲液的ph值为5~6;
35.步骤(6)中所述无菌小牛血清的浓度为4~6%。
36.与现有技术相比,本发明的有益效果如下:
37.本发明以簸箕柳组培苗及容器苗叶片为材料,利用酶解法游离叶肉原生质体,最终得到组培苗叶片原生质体产量最高为1.57
×
107个/gfw,容器苗叶片原生质体产量最高为7.20
×
106个/gfw。本发明利用聚乙二醇(peg)法将载体p2gwf7导入原生质体进行瞬时表达,以绿色荧光蛋白(gfp)基因作为报告基因,结果表明原生质体转化效率最高可达74.3%,建立了簸箕柳原生质体瞬时表达体系,为高通量开展簸箕柳关键基因的功能研究与利用提供了有力工具。
附图说明
38.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
39.图1为显微镜下本发明实施例1获得的簸箕柳叶肉原生质体;
40.图2为显微镜下本发明实施例3中绿色荧光蛋白(gfp)在簸箕柳叶肉原生质体内的表达情况。
具体实施方式
41.本发明提供了一种簸箕柳叶肉原生质体游离方法,包括如下步骤:
42.(1)酶溶液配制:在无菌双蒸水中加入甘露醇、kcl和mes缓冲液,进行第一水浴保温,然后加入纤维素酶r10、离析酶r10,进行第二水浴保温,然后冰浴,使溶液温度降为室温,再向溶液中加入cacl2、bsa、β-巯基乙醇,混匀后依次进行过滤、真空渗透,去除气泡,得酶溶液;
43.(2)酶解:将簸箕柳叶片沿垂直叶脉方向切成叶条,浸泡于步骤(1)所得酶溶液中,真空渗透25~35min,然后室温避光,酶解3.5~4.5h;
44.(3)w5溶液配制:在无菌双蒸水中加入nacl、cacl2、kcl和mes缓冲液,混匀得w5溶液;
45.(4)mmg溶液配制:在无菌双蒸水中加入甘露醇、mgcl2和mes缓冲液,混匀得mmg溶液;
46.(5)将步骤(2)酶解完成的簸箕柳叶片与等体积的w5溶液混合,得混合液;
47.(6)对所得混合液进行过滤、离心,吸掉上清液,沉淀部分即为原生质体;
48.(7)加入w5溶液重悬原生质体,冰浴25~35min,原生质体沉淀到底部,吸掉上清,将沉淀重悬于mmg溶液中,得簸箕柳叶肉原生质体悬浮液。
49.在本发明中,步骤(1)中所述甘露醇的浓度优选为0.3~0.5m,进一步优选为0.4m;所述kcl的浓度优选为15~25mm,进一步优选为18~22mm,更进一步优选为20mm;所述mes缓冲液的浓度优选为15~25mm,进一步优选为18~22mm,更进一步优选为20mm;所述mes缓冲液的ph值优选为5~6,进一步优选为5.7;所述第一水浴保温的温度优选为50~60℃,进一步优选为52~58℃,更进一步优选为55℃;所述第一水浴保温的时间优选为4~6min,进一
步优选为5min;所述纤维素酶r10的浓度优选为10~20g/l,进一步优选为12~18g/l,更进一步优选为15g/l;所述离析酶r10的浓度优选为3~5g/l,进一步优选为4g/l;所述第二水浴保温的温度优选为50~60℃,进一步优选为52~58℃,更进一步优选为55℃;所述第二水浴保温的时间优选为8~12min,进一步优选为10min;所述cacl2的浓度优选为8~12mm,进一步优选为10mm;所述bsa的浓度优选为0.05~0.15wt%,进一步优选为0.08~0.12wt%,更进一步优选为0.1wt%;所述β-巯基乙醇的浓度优选为4~6mm,进一步优选为5mm;所述过滤的孔径优选为0.2~0.4mm,进一步优选为0.22mm;所述真空渗透的时间优选为10~20min,进一步优选为12~18min,更进一步优选为15min。
50.在本发明中,步骤(2)中所述将簸箕柳叶片沿垂直叶脉方向切成叶条,浸泡于步骤(1)所得酶溶液中,真空渗透25~35min,然后室温避光,酶解3.5~4.5h,进一步优选为将簸箕柳叶片沿垂直叶脉方向切成叶条,浸泡于步骤(1)所得酶溶液中,真空渗透30min,然后室温避光,酶解4h。
51.在本发明中,步骤(2)中所述簸箕柳叶片的来源优选为簸箕柳容器苗或簸箕柳组培苗,进一步优选为簸箕柳组培苗;所述叶条的宽度优选为0.5~1mm,进一步优选为0.8mm;所述叶条与酶溶液的用量比优选为0.5~1.5g:100ml,进一步优选为1g:100ml;所述酶解优选在摇动条件下进行,所述摇动的转速优选为45~55rpm,进一步优选为48~52rpm,更进一步优选为50rpm。
52.在本发明中,步骤(3)中所述nacl的浓度优选为150~155mm,进一步优选为154mm;所述cacl2的浓度优选为120~130mm,进一步优选为125mm;所述kcl的浓度优选为4~6mm,进一步优选为5mm;所述mes缓冲液的浓度优选为1~3mm,进一步优选为2mm;所述mes缓冲液的ph值优选为5~6,进一步优选为5.7;
53.步骤(4)中所述甘露醇的浓度优选为0.3~0.5m,进一步优选为0.4m;所述mgcl2的浓度优选为10~20mm,进一步优选为15mm;所述mes缓冲液的浓度优选为3~5mm,进一步优选为4mm;所述mes缓冲液的ph值优选为5~6,进一步优选为5.7。
54.在本发明中,步骤(6)中所述过滤优选采用细胞筛网进行,所述细胞筛网的孔径优选为65~75μm,进一步优选为70μm;所述离心的转速优选为80
×
g~120
×
g,进一步优选为100
×
g;所述离心的时间优选为1~3min,进一步优选为2min;
55.步骤(7)中所述w5溶液的用量优选为0.8~1.2ml,进一步优选为1ml;所述mmg溶液的用量优选为0.8~1.2ml,进一步优选为1ml。
56.在本发明中,步骤(7)中所述加入w5溶液重悬原生质体,冰浴25~35min,原生质体沉淀到底部,吸掉上清,将沉淀重悬于mmg溶液中,得簸箕柳叶肉原生质体悬浮液,进一步优选为加入w5溶液重悬原生质体,冰浴30min,原生质体沉淀到底部,吸掉上清,将沉淀重悬于mmg溶液中,得簸箕柳叶肉原生质体悬浮液。
57.本发明还提供了上述游离方法得到的簸箕柳叶肉原生质体悬浮液。
58.本发明还提供了一种簸箕柳叶肉原生质体瞬时表达体系的建立方法,包括如下步骤:
59.(1)提取8~12μl的p2gwf7质粒dna;
60.(2)加入80~120μl簸箕柳叶肉原生质体悬浮液,混匀得混合液a;
61.(3)加入与所得混合液a等体积的peg溶液,混匀,室温孵育10~15min,间歇混匀,
得混合液b;
62.(4)加入所得混合液b的两倍体积的w5溶液,混匀,终止转化;
63.(5)室温离心,吸掉上清液,将沉淀重悬于wi溶液中,得原生质体wi溶液;
64.(6)利用无菌小牛血清对6孔细胞培养皿润洗1~2s;
65.(7)将所述原生质体wi溶液移入细胞培养皿中,室温黑暗孵育10~14h;
66.(8)室温离心,弃掉上清液,簸箕柳叶肉原生质体瞬时表达体系建立完成。
67.在本发明中,步骤(1)中所述提取8~12μl的p2gwf7质粒dna,进一步优选为提取10μl的p2gwf7质粒dna。
68.在本发明中,步骤(1)中所述p2gwf7质粒dna的浓度优选为1.5~2.5μg/μl,进一步优选为1.8~2.2μg/μl,更进一步优选为2μg/μl;
69.步骤(2)中所述簸箕柳叶肉原生质体悬浮液的细胞个数优选为1.5
×
104~2.5
×
104,进一步优选为1.8
×
104~2.2
×
104,更进一步优选为2
×
104。
70.在本发明中,步骤(2)中所述加入80~120μl簸箕柳叶肉原生质体悬浮液,混匀得混合液a,进一步优选为加入100μl簸箕柳叶肉原生质体悬浮液,混匀得混合液a。
71.在本发明中,步骤(3)中所述加入与所得混合液a等体积的peg溶液,混匀,室温孵育10~15min,间歇混匀,得混合液b,进一步优选为加入与所得混合液a等体积的peg溶液,混匀,室温孵育10min,间歇混匀,得混合液b。
72.在本发明中,步骤(3)中所述的peg溶液优选在转化前1~1.5h配制,进一步优选在转化前1h配制;所述peg溶液的配制过程优选为在无菌双蒸水中加入35~45%peg 4000、0.1~0.3m甘露醇、80~120mm cacl2,进一步优选为在无菌双蒸水中加入40%peg 4000、0.2m甘露醇、100mm cacl2;
73.步骤(4)中所述w5溶液的配制过程优选为在无菌双蒸水中加入150~155mm nacl、120~130mm cacl2、4~6mm kcl和1~3mm mes缓冲液,进一步优选为在无菌双蒸水中加入154mm nacl、125mm cacl2、5mm kcl和2mm mes缓冲液;所述mes缓冲液的ph值优选为5~6,进一步优选为5.7;
74.步骤(5)和步骤(8)中所述室温离心的转速独立优选为80
×
g~120
×
g,进一步优选为100
×
g;所述室温离心的时间独立优选为1~3min,进一步优选为2min。
75.在本发明中,步骤(5)中所述wi溶液的用量优选为0.8~1.2ml,进一步优选为1ml;所述wi溶液的配制过程优选为在无菌双蒸水中加入0.4~0.6m甘露醇、18~22mm kcl和3~5mm mes缓冲液,进一步优选为在无菌双蒸水中加入0.5m甘露醇、20mm kcl和4mm mes缓冲液;所述mes缓冲液的ph值优选为5~6,进一步优选为5.7;
76.步骤(6)中所述无菌小牛血清的浓度优选为4~6%,进一步优选为5%。
77.在本发明中,步骤(6)中所述利用无菌小牛血清对6孔细胞培养皿润洗1~2s,进一步优选为利用无菌小牛血清对6孔细胞培养皿润洗1.5s,其中,润洗的目的在于防止原生质体贴壁生长。
78.在本发明中,步骤(7)中所述将所述原生质体wi溶液移入细胞培养皿中,室温黑暗孵育10~14h,进一步优选为将所述原生质体wi溶液移入细胞培养皿中,室温黑暗孵育12h。
79.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
80.实施例1
81.一种簸箕柳叶肉原生质体游离方法,步骤如下:
82.(1)酶溶液配制:在无菌双蒸水中加入0.4m甘露醇、20mm kcl、20mm mes(ph 5.7),55℃水浴保温5min,然后加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l,55℃水浴保温10min,使酶溶解完全,然后冰浴8,min,使溶液温度降为室温。再向溶液中加入10mm cacl2、0.1wt%bsa、5mmβ-巯基乙醇,混匀后通过0.22mm过滤器将最终的酶溶液过滤到一个培养皿中,真空渗透酶溶液15min,去除气泡,得酶溶液;
83.(2)酶解:将簸箕柳组培苗叶片沿垂直叶脉方向切成0.8mm的叶条,浸泡于步骤(1)所得酶溶液中(1g:100ml),真空渗透30min,然后室温避光,摇动(50rpm)酶解4h;
84.(3)w5溶液配制:在无菌双蒸水中加入154mm nacl、125mm cacl2、5mm kcl、2mm mes(ph 5.7),混匀得w5溶液,置于室温下备用;
85.(4)mmg溶液配制:在无菌双蒸水中加入0.4m甘露醇、15mm mgcl2、4mm mes(ph 5.7),混匀得mmg溶液,置于室温下备用;
86.(5)将步骤(2)酶解完成的簸箕柳叶片与等体积的w5溶液轻柔混匀,得混合液;
87.(6)用70μm细胞筛网对所得混合溶液进行过滤,去掉未消化的叶片,将滤液收集到50ml离心管内,然后将滤液于室温离心(100
×
g)2min,吸掉上清液,离心管底部沉淀即为原生质体;
88.(7)加入1ml w5溶液重悬原生质体,冰浴30min,原生质体沉淀到底部,吸掉上清,将沉淀重悬于1ml mmg溶液中,得簸箕柳叶肉原生质体悬浮液。
89.实施例2
90.一种簸箕柳叶肉原生质体游离方法,步骤如下:
91.(1)酶溶液配制:在无菌双蒸水中加入0.4m甘露醇、20mm kcl、20mm mes(ph 5.7),55℃水浴保温5min,然后加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l,55℃水浴保温10min,使酶溶解完全,然后冰浴8,min,使溶液温度降为室温。再向溶液中加入10mm cacl2、0.1wt%bsa、5mmβ-巯基乙醇,混匀后通过0.22mm过滤器将最终的酶溶液过滤到一个培养皿中,真空渗透酶溶液15min,去除气泡,得酶溶液;
92.(2)酶解:将簸箕柳容器苗叶片沿垂直叶脉方向切成0.8mm的叶条,浸泡于步骤(1)所得酶溶液中(1g:100ml),真空渗透30min,然后室温避光,摇动(50rpm)酶解4h;
93.(3)w5溶液配制:在无菌双蒸水中加入154mm nacl、125mm cacl2、5mm kcl、2mm mes(ph 5.7),混匀得w5溶液,置于室温下备用;
94.(4)mmg溶液配制:在无菌双蒸水中加入0.4m甘露醇、15mm mgcl2、4mm mes(ph 5.7),混匀得mmg溶液,置于室温下备用;
95.(5)将步骤(2)酶解完成的簸箕柳叶片与等体积的w5溶液轻柔混匀,得混合液;
96.(6)用70μm细胞筛网对所得混合溶液进行过滤,去掉未消化的叶片,将滤液收集到50ml离心管内,然后将滤液于室温离心(100
×
g)2min,吸掉上清液,离心管底部沉淀即为原生质体;
97.(7)加入1ml w5溶液重悬原生质体,冰浴30min,原生质体沉淀到底部,吸掉上清,将沉淀重悬于1ml mmg溶液中,得簸箕柳叶肉原生质体悬浮液。
98.实施例3
99.以实施例1所得的簸箕柳叶肉原生质体悬浮液为例,进行簸箕柳叶肉原生质体瞬时表达体系的建立,步骤如下:
100.(1)提取10μl的p2gwf7质粒dna(2μg/μl)于1.5ml离心管中;
101.(2)加入100μl簸箕柳叶肉原生质体悬浮液(2
×
104),混匀得混合液a;
102.(3)加入与所得混合液a等体积(110μl)的peg溶液,轻柔混匀,室温孵育10min,间歇混匀,得混合液b,其中,peg溶液在转化前1h配制,所述peg溶液的配制过程为在无菌双蒸水中加入40%peg 4000、0.2m甘露醇、100mm cacl2;
103.(4)加入所得混合液b的两倍体积(440μl)的w5溶液,轻柔混匀,终止转化,其中,w5溶液的配制过程为在无菌双蒸水中加入154mm nacl、125mm cacl2、5mm kcl和2mm mes(ph5.7);
104.(5)室温(100
×
g)离心2min,吸掉上清液,将沉淀重悬于1ml wi溶液中,得原生质体wi溶液,其中,wi溶液的配制过程为在无菌双蒸水中加入0.5m甘露醇、20mm kcl和4mm mes(ph5.7);
105.(6)利用5%无菌小牛血清对6孔细胞培养皿润洗1.5s,防止原生质体贴壁生长;
106.(7)将所述原生质体wi溶液移入细胞培养皿中,室温黑暗孵育12h;
107.(8)室温(100
×
g)离心2min,吸掉大部分上清液,簸箕柳叶肉原生质体瞬时表达体系建立完成。
108.实施例4
109.以实施例1所得的簸箕柳叶肉原生质体悬浮液为例,进行簸箕柳叶肉原生质体瞬时表达体系的建立,步骤如下:
110.(1)提取10μl的p2gwf7质粒dna(2μg/μl)于1.5ml离心管中;
111.(2)加入100μl簸箕柳叶肉原生质体悬浮液(2
×
104),混匀得混合液a;
112.(3)加入与所得混合液a等体积(110μl)的peg溶液,轻柔混匀,室温孵育15min,间歇混匀,得混合液b,其中,peg溶液在转化前1h配制,所述peg溶液的配制过程为在无菌双蒸水中加入40%peg 4000、0.2m甘露醇、100mm cacl2;
113.(4)加入所得混合液b的两倍体积(440μl)的w5溶液,轻柔混匀,终止转化,其中,w5溶液的配制过程为在无菌双蒸水中加入154mm nacl、125mm cacl2、5mm kcl和2mm mes(ph5.7);
114.(5)室温(100
×
g)离心2min,吸掉上清液,将沉淀重悬于1ml wi溶液中,得原生质体wi溶液,其中,wi溶液的配制过程为在无菌双蒸水中加入0.5m甘露醇、20mm kcl和4mm mes(ph5.7);
115.(6)利用5%无菌小牛血清对6孔细胞培养皿润洗1.5s,防止原生质体贴壁生长;
116.(7)将所述原生质体wi溶液移入细胞培养皿中,室温黑暗孵育12h;
117.(8)室温(100
×
g)离心2min,吸掉大部分上清液,簸箕柳叶肉原生质体瞬时表达体系建立完成。
118.对比例1
119.除将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解2h”之外,其余步骤及步骤参数均与实施例1保持一致。
120.对比例2
121.除将步骤(2)中的“酶解4h”改为“酶解2h”之外,其余步骤及步骤参数均与实施例1保持一致
122.对比例3
123.除将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解3h”之外,其余步骤及步骤参数均与实施例1保持一致。
124.对比例4
125.除将步骤(2)中的“酶解4h”改为“酶解3h”之外,其余步骤及步骤参数均与实施例1保持一致。
126.对比例5
127.除将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解4h”之外,其余步骤及步骤参数均与实施例1保持一致。
128.对比例6
129.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解2h”之外,其余步骤及步骤参数均与实施例1保持一致。
130.对比例7
131.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“酶解4h”改为“酶解2h”之外,其余步骤及步骤参数均与实施例1保持一致。
132.对比例8
133.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解3h”之外,其余步骤及步骤参数均与实施例1保持一致。
134.对比例9
135.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“酶解4h”改为“酶解3h”之外,其余步骤及步骤参数均与实施例1保持一致。
136.对比例10
137.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解4h”之外,其余步骤及步骤参数均与实施例1保持一致。
138.对比例11
139.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”之外,其余步骤及步骤参数均与实施例1保持一致。
140.对比例12
141.除将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解2h”之外,其余步骤及步骤参数均与实施例2保持一致。
142.对比例13
143.除将步骤(2)中的“酶解4h”改为“酶解2h”之外,其余步骤及步骤参数均与实施例2保持一致。
144.对比例14
145.除将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解3h”之外,其余步骤及步骤参数均与实施例2保持一致。
146.对比例15
147.除将步骤(2)中的“酶解4h”改为“酶解3h”之外,其余步骤及步骤参数均与实施例2保持一致。
148.对比例16
149.除将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解4h”之外,其余步骤及步骤参数均与实施例2保持一致。
150.对比例17
151.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解2h”之外,其余步骤及步骤参数均与实施例2保持一致。
152.对比例18
153.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“酶解4h”改为“酶解2h”之外,其余步骤及步骤参数均与实施例2保持一致。
154.对比例19
155.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解3h”之外,其余步骤及步骤参数均与实施例2保持一致。
156.对比例20
157.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“酶解4h”改为“酶解3h”之外,其余步骤及步骤参数均与实施例2保持一致。
158.对比例21
159.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”以及将步骤(2)中的“摇动(50rpm)酶解4h”改为“静置酶解4h”之外,其余步骤及步骤参数均与实施例2保持一致。
160.对比例22
161.除将步骤(1)中的“加入纤维素酶r10(yakult)15g/l、离析酶r10(yakult)4g/l”改为“加入纤维素酶r10(yakult)30g/l、离析酶r10(yakult)8g/l”之外,其余步骤及步骤参数均与实施例2保持一致。
162.对比例23
163.除将步骤(3)中的“室温孵育10min”改为“室温孵育5min”以及将“40%peg 4000”改为“30%peg 4000”之外,其余步骤及步骤参数均与实施例3保持一致。
164.对比例24
165.除将步骤(3)中的“40%peg 4000”改为“30%peg 4000”之外,其余步骤及步骤参数均与实施例3保持一致。
166.对比例25
167.除将步骤(3)中的“40%peg 4000”改为“30%peg 4000”之外,其余步骤及步骤参数均与实施例4保持一致。
168.对比例26
169.除将步骤(3)中的“室温孵育10min”改为“室温孵育5min”之外,其余步骤及步骤参数均与实施例3保持一致。
170.对比例27
171.除将步骤(3)中的“室温孵育10min”改为“室温孵育5min”以及将“40%peg 4000”改为“50%peg 4000”之外,其余步骤及步骤参数均与实施例3保持一致。
172.对比例28
173.除将步骤(3)中的“40%peg 4000”改为“50%peg 4000”之外,其余步骤及步骤参数均与实施例3保持一致。
174.对比例29
175.除将步骤(3)中的“40%peg 4000”改为“50%peg 4000”之外,其余步骤及步骤参数均与实施例4保持一致。
176.实验例1
177.以实施例1~2和对比例1~22为例,分别用移液器取10μl原生质体悬浮液滴入细胞计数板中,利用显微镜观察原生质体的形态,计算比较不同处理所得原生质体的产量,并进行产量显著性分析。结果如表1和表2所示。
178.表1不同处理条件下簸箕柳叶肉原生质体产量
179.[0180][0181]
由表1可知,无论是簸箕柳组培苗还是容器苗,均以本发明处理条件下的原生质体产量更高,选用簸箕柳组培苗时,本发明簸箕柳叶肉原生质体产量可达1.57
×
107个/gfw,选用簸箕柳容器苗时,本发明簸箕柳叶肉原生质体产量可达7.20
×
106个/gfw。
[0182]
表2不同处理条件下簸箕柳叶肉原生质体产量显著性分析
[0183]
[0184]
[0185]
[0186]
[0187]
[0188][0189]
注:“*”表示在0.05水平上显著相关(p<0.05),“**”表示在0.01水平上显著相关(p<0.01)。
[0190]
实验例2
[0191]
以实施例3~4和对比例23~29为例,于共聚集显微镜下观察不同处理条件下原生质体的转化效率,结果如表3所示。
[0192]
表3不同处理条件下簸箕柳原生质体的转化效率
[0193][0194][0195]
由表3可知,与对比例23~29相比,采用本发明实施例3~4的方法获得的簸箕柳原生质体的转化效率更高,最高可达74.3%。
[0196]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人
员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1