一株高产β-葡萄糖苷酶的毕赤酵母工程菌及其应用的制作方法
一株高产
β-葡萄糖苷酶的毕赤酵母工程菌及其应用
技术领域:
1.本发明涉及生物技术领域,具体涉及一株高产β-葡萄糖苷酶的毕赤酵母工程菌。
背景技术:
2.β-葡萄糖苷酶(β-d-葡萄糖糖苷水解酶,ec 3.2.1.21),是一类纤维素酶,能够从含糖化合物中催化水解末端的非还原性β-d-糖苷键,释放出β-d-葡萄糖及相应的单糖、寡糖或复合糖,是一种具有生物催化剂功能的蛋白质。β-葡萄糖苷酶基因广泛存在于自然界各种微生物,包括细菌、放线菌、酵母和丝状真菌等,在一些动物体内也存在。β-葡萄糖苷酶除在降解纤维素方面有着重要作用外,还广泛应用于其他领域,例如食品、造酒、医药和化学工业。
3.β-葡萄糖苷酶作为一类重要的纤维素生物转化用酶,在纤维素糖化水解中起关键性作用,但是微生物所产纤维素酶系中β-葡萄糖苷酶所占比例不足1%,这使得β-葡萄糖苷酶成为纤维素降解成单糖的关键因素,工业上通过往纤维素酶水解系统中添加β-葡萄糖苷酶来提高纤维素的水解效率。
4.目前的β-葡萄糖苷酶产品主要来源于天然的霉菌。由于天然的菌株产酶性能差,β-葡萄糖苷酶产品不能满足市场的需求。而毕赤酵母是近些年来迅速发展的一种真核表达宿主,营养要求低,适合于高密度发酵的大规模生产方式,尤其是毕赤酵母分泌自身的蛋白很少,有利于表达产物的纯化。因此,本发明通过对本公司一株产β-葡萄糖苷酶的黑曲霉,通过基因工程手段进行改造,获得一种耐酸性提高的β-葡萄糖苷酶突变体,并且通过构建相应的毕赤酵母工程菌,使其表达,对满足纤维素生物转化工业生产的需求,降低生产成本具有重大意义。
技术实现要素:
5.本发明的目的在于提供一种耐酸性提高的β-葡萄糖苷酶突变体及其毕赤酵母工程菌菌株。旨在解决β-葡萄糖苷酶在工业生产中酶活力较低、纤维素生物转化应用不理想的问题。
6.本发明具体通过以下技术方案实现:
7.一种耐酸性提高的β-葡萄糖苷酶突变体,该突变体由申请人实验室保藏的黑曲霉菌株(aspergillus niger)pt003经过亚硝基胍诱变的方法筛选获得,将β-葡萄糖苷酶突变体编码基因从诱变菌株中克隆并构建重组质粒后,在毕赤酵母gs115中进行表达,从而获得毕赤酵母工程菌菌株。
8.本发明提供的技术方案之一:是一种β-葡萄糖苷酶突变体,所述β-葡萄糖苷酶突变体是在seq id no.2所示的pt003野生型β-葡萄糖苷酶的基础上,将其中第60位丝氨酸突变为亮氨酸、第303位缬氨酸突变为丙氨酸所得,所述β-葡萄糖苷酶突变体的氨基酸序列如seq id no.4所示;
9.本发明还提供上述-葡萄糖苷酶突变体的编码基因;
10.进一步地,所述β-葡萄糖苷酶突变体的编码基因具有seq id no.3所示的核苷酸序列。
11.所述β-葡萄糖苷酶突变体的酶学性质如下:
12.(1)最适ph:ph 3.5-5.5酶活稳定,最适作用ph 4.0;
13.(2)最适温度:35℃-55℃酶活稳定,最适作用温度为45℃;
14.(3)耐酸性:该酶在ph 3.5的条件下,24h后酶活力仍存留80%以上。
15.本发明提供的技术方案之三:是包含上述β-葡萄糖苷酶突变体编码基因的重组载体或重组菌株,将上述β-葡萄糖苷酶突变体编码基因重新构建重组载体,并在毕赤酵母中高效表达,得到产高活力β-葡萄糖苷酶的重组菌株,通过发酵、提取等技术获得高活力β-葡萄糖苷酶;
16.进一步地,用于表达所述的β-葡萄糖苷酶突变体的宿主细胞为毕赤酵母gs115;
17.进一步地,用于表达所述的β-葡萄糖苷酶突变体的表达载体为ppic9k质粒;
18.优选地,所述重组菌株是将seq id no.3所示的β-葡萄糖苷酶突变体编码基因连接表达载体ppic9k,并在毕赤酵母gs115中表达所得。
19.本发明提供的技术方案之四:是技术方案三所述重组载体或重组菌株的应用,特别是在发酵生产seq id no.4所示的β-葡萄糖苷酶突变体中的应用。
20.本发明提供的技术方案之五:是seq id no.4所示β-葡萄糖苷酶突变体的应用,特别是在催化糖苷键水解中的应用,更特别地是在纤维素生物转化产业中的应用。
21.在本发明中采用如下定义:
22.1.氨基酸和dna核酸序列的命名法
23.使用氨基酸残基的公认iupac命名法,用三字母或单字母代码形式。dna核酸序列采用公认iupac命名法。
24.2.β-葡萄糖苷酶突变体的标识
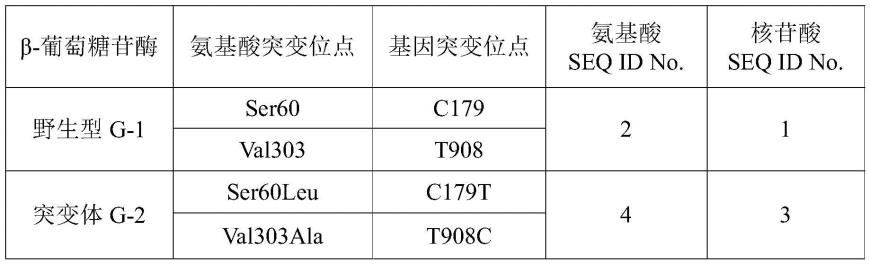
25.采用“原始氨基酸位置替换的氨基酸”来表示突变体中突变的氨基酸。如s60l,表示位置60的氨基酸由野生型的ser替换成leu,位置的编号对应于seq id no.2中野生型β-葡萄糖苷酶的氨基酸序列编号。在本发明中,g-1表示野生型β-葡萄糖苷酶,g-2表示β-葡萄糖苷酶突变体,信息如下表。
26.β-葡萄糖苷酶氨基酸突变位点氨基酸seqidno.核苷酸seqidno.野生型g-1ser60、val30321突变体g-2ser60leu、val303ala43
27.有益效果:
28.本发明公布了一种全新的β-葡萄糖苷酶突变体,该突变体具有酶活高,耐酸性高的特点,该突变体发酵液酶活可达51000u/ml以上。
29.本发明获得的β-葡萄糖苷酶的最适反应ph在4.0酶活力最高,与野生型pt003的β-葡萄糖苷酶相比,最适反应ph降低了0.5,说明耐酸性提高。
30.本发明获得的β-葡萄糖苷酶在ph 3.5的条件下,24h后酶活力仍存留80%以上,与野生型pt003的β-葡萄糖苷酶相比,耐酸性显著提高。
附图说明:
31.图1最适ph曲线;
32.图2最适温度曲线;
33.图3耐酸性曲线。
具体实施方式:
34.通过具体实施例对本发明作出更详尽的说明,仅作为举例说明,而不作为对本发明实施范围的限定。对于本领域技术人员,在本发明原理基础上还可做出的改进,这些改进也应视为本发明保护的范围。本实施例中未作具体说明的分子生物学实验方法,可参照《分子克隆实验指南》。
35.本发明提供一种耐酸性提高β-葡萄糖苷酶突变体,该突变体由申请人实验室保藏的黑曲霉菌株(aspergillus niger)pt003经过亚硝基胍诱变后筛选获得,通过基因测序得到突变的位点为将第60位丝氨酸突变为亮氨酸、第303位的缬氨酸变为丙氨酸。本发明首先获得β-葡萄糖苷酶突变体的编码基因,将该突变体编码基因与ppic9k载体相连接构建重组质粒,转入相应宿主菌gs115中进行异源表达,发酵获得该突变体相应的β-葡萄糖苷酶。该β-葡萄糖苷酶具有较高的酶活力,适合工业化生产和纤维素生物转化行业。
36.1、实验材料和试剂:
37.实验菌株和载体:基因来源菌株:由本公司保存的黑曲霉pt003;表达宿主菌及载体:gs115和ppic9k均购自美国invitrogen公司;宿主菌:dh5α。
38.主要试剂:dna聚合酶、t4 dna连接酶、dna凝胶回收试剂盒、质粒提取试剂盒、rna提取试剂盒、pnpg、dnamarker、琼脂糖、氨苄青霉素、iptg、x-gal:均购自上海生工;各种限制性内切酶:购自neb公司。
39.实验仪器:凝胶成像仪(bio-rad)、蛋白电泳仪(bio-rad)、核酸电泳仪(bio-rad)、pcr扩增仪(bio-rad)、高速离心机(eppendorf)。
40.2、本发明采用的β-葡萄糖苷酶活力测定方法:
41.(1)取200μl 0.2m乙酸-乙酸钠缓冲液(ph 5.0),样品管中加入50μl适当稀释的发酵上清即酶液,空白对照加入50μl缓冲液,50℃水浴预热平衡5min;(2)同时也对pnpg溶液(5.0mm)进行50℃预热平衡;
42.(3)酶液样品的预平衡液中加入250μl预热平衡的pnpg底物溶液,构成500μl酶反应体系,恒温水浴锅中50℃反应10min;
43.(4)立即加入500μl 1.0m na2co3溶液增强显色并终止反应,混合均匀后在室温下静置5min;
44.(5)酶标仪405nm测量对硝基苯酚(p-nitrophenol)吸光值a405。每个样品做三个平行测量。
45.酶活力单位定义:以pnpg为底物,在测定条件下(如非特别说明,测定条件为ph 5.0,50℃),每分钟水解底物产生1μmol对硝基苯酚(p-nitrophenol)所需的酶量为一个酶活力单位(u/ml)。即:
46.酶活力单位(u/ml)=(c
×
n)/t
47.式中,n:原酶液稀释倍数;t:反应时间(min);c:不同吸光值a405对应于标准曲线
上对硝基苯酚的浓度(μmol/ml)。
48.本发发明及实施例所述野生型β-葡萄糖苷酶g-1编码基因的核苷酸序列为seq id no.1所示:
49.atgggttcagcaacagcttcaaccttgcctccggactttctctggggtttcgcgactgccagctaccagattgaaggcgcagt
50.aaccgaagatggccgtggtccttctatctgggacactttctgcaaaatccctggcaagatagccgggggagccaacggag
51.acgtagcatgcgactcgtaccaccgtacagctgaagacatcgcactgttaaaggaatgcggtgctcaggcttaccgcttctc
52.aatctcatggtcgcgcatcattcccctcggaggccgcaacgaccccatcaacgataagggtgtccaacattatgtcaagttc
53.gtcgacgatcttctagcagcggggatcacaccccttgtgacactgttccactgggatctccccgatgcattagacaagcgct
54.acggtgggctcctcaacaaggaggagttcgttgcagatttcgccaactacgcgcgagtcatgttccgggccctgggctcaa
55.aagtcaagcattggatcaccttcaatgagccgtggtgttccagtgtccttgggtataacgtcggtcagtttgctcccggtcgg
56.acgagtgatcggagcaagagcgcagagggagatagctcgagggagtgctggatcgtggggcacaatatcctcgtggct
57.catggagctgcggtgaagatctaccgagaggagttcaagagtagagatggtggggagatcgggatcacacttaacggag
58.actgggctgagccctgggatcccgagaatccggccgacatcgaagcctgcgaccgcaagatcgaattcgccatttcctgg
59.tttgcagaccccatctatcatggaaggtatccagacagcatgataaagcagcttggcgaccgactccccagctggaccgca
60.gaagacatcgctctcgtccacggcagcaatgacttctatggcatgaaccactactgcgccaactacatcaaagccaaaacc
61.ggcgaagcggatcccaacgatactgccggaaatctggagatcctgctcaagaacaagaagggcgagttcatcggcccag
62.agacacagtctgcatggctgagaccgtatgcacttgggttccggaagctgttgaaatggctaagcgatagatacggtcagc
63.ctaagatctacgttactgagaatgggacgagcttgaagggtgagaatgacttgccggtggaggagctgctgaaggatgaat
64.tccggacgcagtacttccgtgattatattgctgctatggctgatgcgtacacgctggatggggtgaatgtgagggcttatatg
65.gcttggagtttgatggataacttcgaatgggctgaaggttacgaaacccggtttgggtcgacctacgtcgactacgaacatg
66.gccagaagaggatcccgaaggacagtgcgaaacagatcggccagattttcagccagtatatcgagaagaaataa
67.本发发明及实施例所述野生型β-葡萄糖苷酶g-1的氨基酸序列如序列表seq id no.2所示:
68.mgsatastlppdflwgfatasyqiegavtedgrgpsiwdtfckipgkiaggang
69.dvacdsyhrtaediallkecgaqayrfsiswsriiplggrndpindkgvqhyv
70.kfvddllaagitplvtlfhwdlpdaldkryggllnkeefvadfanyarvmfr
71.algskvkhwitfnepwcssvlgynvgqfapgrtsdrsksaegdssrecwivg
72.hnilvahgaavkiyreefksrdggeigitlngdwaepwdpenpadieacdrkie
73.faiswfadpiyhgrypdsmikqlgdrlpswtaedialvhgsndfygmnhyca
74.nyikaktgeadpndtagnleillknkkgefigpetqsawlrpyalgfrkllk
75.wlsdrygqpkiyvtengtslkgendlpveellkdefrtqyfrdyiaamada
76.ytldgvnvraymawslmdnfewaegyetrfgstyvdyehgqkripkdsak
77.qigqifsqyiekk
78.本发发明及实施例所述β-葡萄糖苷酶突变体g-2的编码基因的核苷酸序列为seq id no.3所示:
79.atgggttcagcaacagcttcaaccttgcctccggactttctctggggtttcgcgactgccagctaccagattgaaggcgcagt
80.aaccgaagatggccgtggtccttctatctgggacactttctgcaaaatccctggcaagatagccgggggagccaacggag
81.acgtagcatgcgacttgtaccaccgtacagctgaagacatcgcactgttaaaggaatgcggtgctcaggcttaccgcttctc
82.aatctcatggtcgcgcatcattcccctcggaggccgcaacgaccccatcaacgataagggtgtccaacattatgtcaagttc
83.gtcgacgatcttctagcagcggggatcacaccccttgtgacactgttccactgggatctccccgatgcattagacaagcgct
84.acggtgggctcctcaacaaggaggagttcgttgcagatttcgccaactacgcgcgagtcatgttccgggccctgggctcaa
85.aagtcaagcattggatcaccttcaatgagccgtggtgttccagtgtccttgggtataacgtcggtcagtttgctcccggtcgg
86.acgagtgatcggagcaagagcgcagagggagatagctcgagggagtgctggatcgtggggcacaatatcctcgtggct
87.catggagctgcggtgaagatctaccgagaggagttcaagagtagagatggtggggagatcgggatcacacttaacggag
88.actgggctgagccctgggatcccgagaatccggccgacatcgaagcctgcgaccgcaagatcgaattcgccatttcctgg
89.tttgcagaccccatctatcatggaaggtatccagacagcatgataaagcagcttggcgaccgactccccagctggaccgca
90.gaagacatcgctctcgcccacggcagcaatgacttctatggcatgaaccactactgcgccaactacatcaaagccaaaacc
91.ggcgaagcggatcccaacgatactgccggaaatctggagatcctgctcaagaacaagaagggcgagtt
catcggcccag
92.agacacagtctgcatggctgagaccgtatgcacttgggttccggaagctgttgaaatggctaagcgatagatacggtcagc
93.ctaagatctacgttactgagaatgggacgagcttgaagggtgagaatgacttgccggtggaggagctgctgaaggatgaat
94.tccggacgcagtacttccgtgattatattgctgctatggctgatgcgtacacgctggatggggtgaatgtgagggcttatatg
95.gcttggagtttgatggataacttcgaatgggctgaaggttacgaaacccggtttgggtcgacctacgtcgactacgaacatg
96.gccagaagaggatcccgaaggacagtgcgaaacagatcggccagattttcagccagtatatcgagaagaaataa
97.本发发明及实施例所述β-葡萄糖苷酶突变体g-2的氨基酸序列如序列表seq id no.4所示:
98.mgsatastlppdflwgfatasyqiegavtedgrgpsiwdtfckipgkiaggang
99.dvacdlyhrtaediallkecgaqayrfsiswsriiplggrndpindkgvqhyv
100.kfvddllaagitplvtlfhwdlpdaldkryggllnkeefvadfanyarvmfr
101.algskvkhwitfnepwcssvlgynvgqfapgrtsdrsksaegdssrecwivg
102.hnilvahgaavkiyreefksrdggeigitlngdwaepwdpenpadieacdrkie
103.faiswfadpiyhgrypdsmikqlgdrlpswtaedialahgsndfygmnhyca
104.nyikaktgeadpndtagnleillknkkgefigpetqsawlrpyalgfrkllk
105.wlsdrygqpkiyvtengtslkgendlpveellkdefrtqyfrdyiaamada
106.ytldgvnvraymawslmdnfewaegyetrfgstyvdyehgqkripkdsak
107.qigqifsqyiekk
108.以下通过具体实施方式对本发明作进一步地解释说明。
109.实施例1β-葡萄糖苷酶突变体g-2编码基因的获得
110.本公司保藏的一株产β-葡萄糖苷酶的黑曲霉菌株(aspergillus niger)pt003,经亚硝基胍诱变筛选得到一株具有耐酸β-葡萄糖苷酶活性的菌株,根据野生型β-葡萄糖苷酶g-1编码基因的核苷酸序列设计pcr引物,5'端加入酶切位点xho i,3'端加入酶切位点not i,通过pcr得到突变体g-2的编码基因,经过测序得到其核苷酸序列为seq id no.3,对应的氨基酸序列为seq id no.4。
111.在本发明中,通过野生型和突变体的核苷酸序列的比较,得到突变位点信息如下表。
112.113.实施例2重组载体ppic9k-g-2的构建
114.分别对突变体g-2编码基因(seq id no.3)和质粒ppic9k进行xho i和not i酶切,回收产物,将回收后的g-2编码基因和ppic9k按比例混合,用t4连接酶在16℃条件下连接过夜,连接产物转化大肠杆菌dh5α感受态细胞,转化产物涂布在lb(含氨苄霉素)固体平板上,33℃倒置培养过夜,挑取单菌落至lb液体培养基,33℃培养,经菌落pcr得到目的序列,测序比对均显示为seq id no.3所示的核苷酸序列,即所得重组载体含有正确的突变基因,将所得重组载体命名为ppic9k-g-2。
115.实施例3重组质粒转化毕赤酵母
116.1.毕赤酵母gs115感受态细胞的制备
117.(1)挑取毕赤酵母平板单菌落,接种于5ml的ypd培养基,30℃,220r/min振荡过夜;
118.(2)取0.5ml的过夜培养的菌液,接种于50ml新鲜配制的ypd培养基,30℃,220r/min振荡培养,使od
600
值达到1.3-1.5;
119.(3)取上述培养液于4℃,3000r/min,离心5min;
120.(4)弃去上清液,加入50ml冰上预冷的无菌水,振荡重悬菌体;
121.(5)4℃,3000r/min,离心5min,弃去上清液,吸干管壁残余液体,加入25ml冰上预冷的无菌水,振荡重悬菌体;
122.(6)4℃,3000r/min,离心5min,弃去上清液,吸干管壁残余液体,加入10ml冰上预冷的1mol/l的无菌山梨醇溶液,重悬菌体;
123.(3)4℃,3000r/min,离心5min,弃去上清液,吸干管壁残余液体,加入1ml冰上预冷的1mol/l的无菌山梨醇溶液(预先加入甘油至终浓度15%),振荡混匀;
124.(8)分装100μl/管至无菌ep罐,-30℃冰箱冰冻保藏(新鲜制备的感受态细胞效果更佳)。
125.2.线性化质粒的转化
126.将实施例2得到的阳性克隆子进行抽提得到重组质粒ppic9k-g-2,用sal i进行单酶切,得到线性化质粒。取新鲜制备的(或-30℃冻存的)gs115感受态细胞置于冰浴中,使其完全解冻。
127.(1)将100μl感受态细胞移出至一新的无菌ep管中,加入10μl线性化质粒,轻吹混匀,吸出转移到0.2cm型的电穿孔转化杯中;
128.(2)转化杯置于冰浴中5-10min,保持低温;
129.(3)电穿孔转化电击条件:1500v,200ω,25μf,放电时间5ms左右,一次电击;
130.(4)电击后,马上在电击转化杯中加入1ml 4℃预冷的1mol/l的山梨醇溶液,用移液枪吹打均匀,置于冰浴中;
131.(5)在超净工作台上无菌操作涂布md培养基(1.34% ynb;4
×
10-5
%生物素;2%葡萄糖平板),150μl/板,涂好的平板30℃倒置培养3-4天;
132.(6)在md平板上筛选得到两株重组菌,经菌落pcr得到目的序列,测序比对均显示为seq id no.3所示的核苷酸序列,即所得重组菌株含有正确的突变基因,两株重组菌株分别命名为n-01,n-02。
133.实施例4含有重组质粒ppic9k-g-2的酵母菌的诱导表达
134.bmgy培养基配方:1.5%酵母浸出物,2.5%蛋白胨,0.1mol/l ph 6.0磷酸盐缓冲
液,1.34% ynb,4
×
10-5
%生物素,1%甘油,其余为水。
135.bmmy培养基配方:1.5%酵母浸出物,2.5%蛋白胨,0.1mol/l ph 6.0磷酸盐缓冲液,1.34% ynb,4
×
10-5
%生物素,0.6%甲醇,其余为水。
136.将重组菌n-01,n-02,以及采用实施例3同样方法以野生型β-葡萄糖苷酶编码基因(seq id no.1所示的核苷酸序列)构建的重组菌株nd-01分别接种于装有30ml bmgy培养基的三角瓶中,30℃,220r/min培养至od
600
为10左右,离心收集菌体,用35ml的bmmy诱导培养基重悬菌体,并在30℃,220r/min条件下继续培养50h,发酵液离心后测定上清中的β-葡萄糖苷酶酶活,结果如下表。
137.菌株β-葡萄糖苷酶酶活(u/ml)nd-018123n-0113519n-0213334
138.实施例5重组菌n-02发酵性能验证
139.以实施例3获得的重组菌n-02为生产菌株。
140.种子罐培养基配方:3.8%甘油,1.4%磷酸二氢铵,0.3%磷酸二氢钾,0.5%硫酸镁,0.6%硫酸钾,0.08%硫酸钙,0.4%氢氧化钾,其余为水,ph 4.5;
141.发酵罐培养基配方:3.8%甘油,1.4%磷酸二氢铵,0.3%磷酸二氢钾,0.5%硫酸镁,0.6%硫酸钾,0.08%硫酸钙,0.4%氢氧化钾,其余为水,ph 4.5;
142.碳源:50%甘油;
143.甲醇:纯甲醇;
144.种子罐培养:培养温度30℃,初始转速200r/min,初始风量2m3/h,通风搅拌培养,ph 4.5,溶氧保持30-40%,当溶氧低于30%时通过增加转速和风量进行控制,湿重增长至85g/l时移种;
145.发酵罐培养:培养温度30℃,初始转速200r/min,初始风量2m3/h,通风搅拌培养,接种量10%,ph 4.5,第0-22h周期,按流速600g/h流加碳源50%甘油,溶氧保持30-40%,当低于30%时通过增加转速和风量进行控制,培养菌体至湿重230g/l;第22h周期后,停补碳源,溶氧反弹至80%以上,保持0.5h;之后按照220g/h的速度流加甲醇,溶氧保持20-30%,培养至总发酵周期为160h发酵结束。
146.采用以上发酵方法进行50l发酵罐放大验证实验,发酵周期160h,其3批次的发酵产酶情况如下表,平均产酶水平为52106u/ml,说明菌株不仅高产酸性β-葡萄糖苷酶而且其发酵性能以及其所产的β-葡萄糖苷酶的酶活均具有一定的稳定性。
147.3批次基因工程菌的发酵产酶情况
148.批次发酵周期(h)发酵活力(u/ml)116051892216052443316051985
149.实施例6β-葡萄糖苷酶的酶学性质
150.(1)最适作用ph
151.以实施例4所得n-02发酵液上清液为突变后β-葡萄糖苷酶样品,以nd-01发酵液上
清液为野生型对照样品,采用本发明采用的β-葡萄糖苷酶活力测定方法,在50℃的条件下,测定不同ph 3.0、3.5、4.0、4.5、5.0、5.5、6.0条件下的相对酶活力,以两种酶各自测得的β-葡萄糖苷酶最高酶活为基准。由图1可知,本发明β-葡萄糖苷酶突变体在ph范围3.5-5.0酶活稳定,最适作用ph 4.0,其最适ph较对照降低0.5。上述结果表明,与突变前相比,本发明突变后的β-葡萄糖苷酶在更高的酸性条件下的酶活力更高,其作用ph范围更为宽泛,更适合纤维素生物转化行业。
152.(2)最适作用温度
153.以实施例4所得n-02发酵液上清液为突变后β-葡萄糖苷酶样品,以nd-01发酵液上清液为野生型对照样品,采用本发明采用的β-葡萄糖苷酶活力测定方法,在ph 4.0的条件下,测定不同温度30℃、35℃、40℃、45℃、50℃、55℃、60℃条件下的酶活力,以两种酶各自测得的β-葡萄糖苷酶最高酶活为基准,计算相对酶活力,结果如图2所示,本发明β-葡萄糖苷酶突变体在35-55℃酶活稳定,最适作用温度为45℃,相较于野生型β-葡萄糖苷酶,最适反应温度没有变化,但是最适温度范围有提高。
154.(3)耐酸性
155.以实施例4所得n-02发酵液上清液为突变后β-葡萄糖苷酶样品,以nd-01发酵液上清液为野生型对照样品,以各自不作处理的β-葡萄糖苷酶酶活为100%基准,两个样品分别在ph 3.5的条件下进行45℃保温处理,每隔2h,在温度50℃、缓冲液ph 5.0的条件下测定酶活力,计算剩余酶活,从图3中可以看出,在24h后,本发明β-葡萄糖苷酶突变体相对活性仍存留80%以上,与野生型β-葡萄糖苷酶相比,突变体β-葡萄糖苷酶的耐酸性有很大提高,说明本发明β-葡萄糖苷酶突变体具有良好的耐酸性。上述结果表明,与突变前相比,耐酸性的提高使突变后的β-葡萄糖苷酶更适合在纤维素生物转化行业中应用。
156.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1