用于核酸的无亚磷酰胺酶促合成的组合物和方法与流程
背景技术:
1、本领域需要一种合成核酸的方法,它能显著降低与亚磷酰胺介导的化学合成相关的错误率和有机废物的产生。此外,本领域需要以显著降低的成本合成核酸。本文描述了使用完全天然的核酸源合成任何核酸(na)序列而不需要大规模亚磷酰胺介导的化学合成的物质组合物和方法。
技术实现思路
1、本公开提供了一种或多种addamer,其中每种addamer携带至少三个碱基对(bp)的有效载荷。全套3-聚体供体或受体addamer设计包括所有64种3-聚体bp可能性作为有效载荷。其他实施方案具有类似的发夹设计,有效载荷的长度增加。有效载荷为三时,存在64种可能的addamer。有效载荷为4bp时,在给定的文库中存在256种可能的addamer。同样,对于5-聚体有效载荷,存在1,024个元素,并且对于6-聚体有效载荷,存在4,096个元素。由于addamer是双链的,通过放置各种设计特征,对于给定的文库,使用比所有可能的n-聚体最大值少的n-聚体是可能的,并且仍然实现完整的序列覆盖。
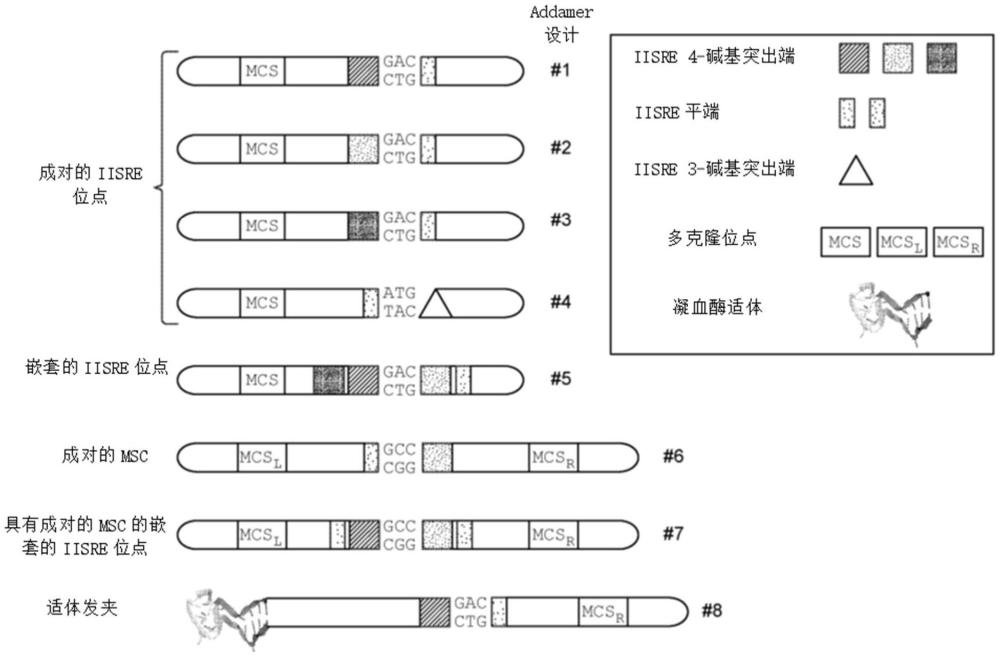
2、addamer可包含几个碱基的发夹弯和一段短序列,其可用于指导用内切核酸酶从发夹区裂解有效载荷。此外,为了便于附着到固体支持物上,发夹区可以包含几种可能的特定结构序列中的任一种,诸如:用于亲和纯化或附着的适体序列;用于受控自动裂解的酶序列(脱氧核酶(dnazyme));嵌套的内切核酸酶识别位点以用于通过粘性末端附着到固体支持物;或通过杂交固体支持物结合的锚序列附着的不成对的单链区域。
3、addamer可包含多种偏移切割ii型s限制性内切核酸酶位点,以实现多种突出端长度或允许整个给定构建体被切割成特定的较短长度。随着更长na序列的产生,不同的左侧和右侧内切核酸酶位点允许产生特定的‘供体’和‘受体’addamer中间体。如熟练的技术人员将理解,已经鉴定了数百种ii型s限制性内切核酸酶(iisre)。它们的特征在于双链dna识别位点与裂解位点分离的事实。由于由addamer合成寡核苷酸的方法依赖于连接,5’突出端是优选的,并且存在产生1个、2个、3个、4个和5个碱基的5’突出端以及平端的多个iisre。
4、在一个实施方案中,独特的受体和供体起始有效载荷的阵列通过3-聚体addamer的顺序附着产生。最初,在负载阶段,用合适的限制性内切核酸酶(re)(诸如bamhi)消化已经预先负载有携带‘附着螺柱’的双链多克隆位点(mcs)的不同固体表面。类似地,第一3-聚体addamer是re消化的并附着到‘附着螺柱’。在外切核酸酶处理和冲洗后,用适当的平切iisre消化附着的addamer构建体,从而产生平端,或者是末端带有暴露的3-聚体序列的附着的addamer(受体),或者是末端带有暴露的3-聚体的游离平端addamer(供体)。将含供体addamer的溶液转移至所需的含受体addamer的孔中,并且使用人dna连接酶iii(hlig3)将两种addamer平接在一起,其对于平接具有>60%的高效率。在连接后,将外切核酸酶施加到孔中以去除未反应的位点并冲洗孔。在这一点上,所述孔含有携带六聚体有效载荷的固体支持物结合的addamer(参见图8)。然后,可以通过施加适当的iisre来组合六聚体有效载荷以产生受体和供体版本。然后将供体溶液施加到受体孔中并通过粘性末端连接以产生延长的有效载荷,然后对其进行外切核酸酶处理和漂洗,从而留下所需的中间有效载荷。重复这个反应循环,并且增加有效载荷长度,直到产生所需na序列的有效载荷(参见图8)。
5、本公开提供了addamer文库,其包含64种可能的3-聚体、256种可能的4-聚体、1,024种可能的5-聚体或4,096种可能的6-聚体有效载荷,其具有以下特征:a)d双链双发夹总体结构;和b)允许产生0bp、1bp、2bp、3bp、4bp或5bp突出端的独特的左侧和右侧ii型s限制性内切核酸酶(re)位点。
6、在一些方面,发夹区可以包含诸如适体的结构特征,其可以用于通过适体配体的分子亲和力将addamer固定到固体支持物上。在一些方面,发夹区可以包含用于限制性内切核酸酶裂解的限制性内切核酸酶位点以允许addamer连接到先前固定到固体支持物的核酸。在一些方面,发夹区可以包含λ噬菌体cos位点,其可以被λ终止酶裂解以允许addamer连接到先前固定到固体支持物的核酸上。在一些方面,发夹区可以包含可以与先前固定到固体支持物的核酸杂交的单链区域。
7、本公开提供了在限制性内切核酸酶裂解和随后的连接之后由addamer的组合衍生的核酸序列。
8、本公开提供了具有5’末端修饰以附着到固体支持物的双链dna锚序列,其含有多克隆位点、发夹结构和修饰的抗外切核酸酶的3’末端。
9、本公开提供了具有5’末端修饰以附着到固体支持物的单链dna锚序列,其含有与合适的addamer序列互补的序列和修饰的抗外切核酸酶的3’末端。
10、本公开提供了一种用于产生addamer文库的方法,其包括:a)设计文库元件,包括发夹、ii型s限制性内切核酸酶位点、有效载荷、其他限制性内切核酸酶位点和用于插入物切除的靶位点的序列和位置;b)将文库的每个不同addamer元件克隆到高拷贝数质粒中,作为单个拷贝或多个拷贝插入物;c)纯化每个质粒或噬细菌体dna;d)使用以下中的至少一种切除插入物:i)切口酶;ii)具有合适指导rna的cas9切口酶;和iii)反式或顺式作用的脱氧核酶;e)连接插入物以产生addamer结构;和f)任选地,进行处理以纯化addamer。
11、本公开提供了一种用于产生addamer文库的方法,其包括:a)设计文库元件,包括发夹、ii型s限制性内切核酸酶位点、有效载荷、其他限制性内切核酸酶位点和用于插入物切除的靶位点的序列和位置;b)进行特定addamer的单独的顶部和底部链的亚磷酰胺合成;c)任选地用muts或类似的纠错酶处理前addamer双链体;d)使特定addamer的顶部和底部链与连接酶接触以产生addamer结构;和e)用外切核酸酶处理步骤(d)的产物以纯化功能性addamer。
12、本公开提供了一种用于将一种或多种addamer附着到固体支持物的方法,其包括:a)将含有5’修饰的双链锚序列负载到固体表面上;b)进行锚序列的噬细菌体λ终止酶消化;c)进行一种或多种addamer的噬细菌体λ终止酶消化;d)将消化的一种或多种addamer与消化的锚序列一起孵育;和e)连接消化的一种或多种addamer和消化的锚序列。
13、本公开提供了一种用于将一种或多种addamer附着到固体支持物的方法,其包括:a)将含有5’修饰的双链锚序列负载到固体表面上;b)进行锚序列的限制性内切核酸酶消化;c)进行一种或多种addamer的限制性内切核酸酶消化;d)孵育消化的一种或多种addamer和消化的锚序列;连接消化的一种或多种addamer和消化的锚序列。
14、本公开提供了一种用于将包含适体序列的一种或多种addamer附着到固体支持物的方法,其包括:a)将至少一种化学配体附着到固体支持物,其中所述至少一种化学配体与适体序列结合;和b)孵育一种或多种addamer和固体支持物,从而将一种或多种addamer附着到固体支持物。
15、本公开提供了一种核酸合成方法,其包括:a)将一种或多种addamer附着到至少一种固体支持物;b)通过合适的iisre对受体和供体addamer进行独立的限制性酶消化;c)洗涤受体addamer反应体积;d)将供体addamer溶液与受体addamer反应体积一起孵育;e)连接消化的供体和受体addamer;f)进行外切核酸酶消化;和g)任选地洗涤步骤(f)的产物。所得产物可在随后的步骤中用作受体或供体addamer,重复a.至g.直到产生所需的最终产物。
16、本公开提供了双链addamer,其中addamer包含:a)第一ii型s限制性内切核酸酶(iisre)序列;b)n-聚体序列;c)至少第二iisre序列;并且其中addamer的至少一个末端包含发夹结构。在一些方面,addamer可以在addamer的两端包含发夹结构。在一些方面,addamer可以包含a)第一iisre序列;b)第二iisre序列;c)n-聚体序列;和d)至少第三iisre序列。在一些方面,addamer可以包含a)第一iisre序列;b)第二iisre序列;c)n-聚体序列;d)第三iisre序列;和e)至少第四iisre序列。在一些方面,addamer还可包含多克隆位点(mcs)序列,其中mcs序列包含一个或多个限制性内切核酸酶序列。
17、在一些方面,iisre序列可选自mlyi序列、ngoavii序列、sspd5i序列、alwi序列、bcci序列、bcefi序列、plei序列、bceai序列、bcesiv序列、bscai序列、bspd6i序列、faui序列、eari序列、bspqi序列、bfuai序列、paqci序列、esp3i序列、bbsi序列、bbvi序列、btgzi序列、foki序列、bsmfi序列、bsai序列、bcodi序列和hgai序列。
18、在一些方面,发夹结构可包含适体序列。在一些方面,适体序列可选自pl1适体序列、凝血酶29-聚体适体序列、s2.2适体序列、art1172适体序列、r12.45适体序列、rb008适体序列和38nt selex适体序列。
19、本公开提供了一种组合物,其包含固定到固体支持物上的本公开的addamer。在一些方面,固体支持物可以是珠。在一些方面,珠可以包含聚丙烯酰胺、聚苯乙烯、琼脂糖或它们的任何组合。在一些方面,固体支持物可以是孔或室的表面。在一些方面,孔或室可以是多孔板的部分。
20、在一些方面,其中addamer被固定到固体支持物,addamer包含含有至少一个适体序列的发夹结构,固体表面包含与适体序列结合的至少一种配体,并且addamer通过至少一个适体序列与至少一种配体的结合而固定到固体表面。
21、在一些方面,其中addamer被固定到固体支持物,addamer包含至少一个5’突出端或3’突出端,固体表面包含至少一个单链或部分双链核酸分子,其单链部分与至少一个5’突出端或3’突出端互补,并且addamer通过将至少一个5’突出端或3’突出端与固体表面上的至少一个单链或部分双链核酸杂交而固定到固体表面。
22、在一些方面,其中addamer被固定到固体支持物,addamer包含至少一个5’突出端或3’突出端,固体表面包含至少一个单链或部分双链核酸分子,其单链部分与至少一个5’突出端或3’突出端互补,并且addamer通过将至少一个5’突出端或3’突出端与固体表面上的至少一个单链或部分双链核酸杂交并将addamer与至少一个单链或部分双链核酸连接而固定到固体表面。
23、本公开提供了产生本公开的addamer的方法,所述方法包括:a)化学合成第一单链核酸分子和第二单链核酸分子,其中第一单链核酸分子和第二单链核酸分子的序列包含待产生的addamer的部分,其中第一单链核酸分子包含与第二单链核酸分子上的第二区域互补的第一区域和自身互补的第二区域,并且所述第二单链核酸分子包含自身互补的第一区域和与第一单链核酸分子上的第一区域互补的第二区域;b)将第一单链核酸和第二单链核酸杂交以产生双链核酸分子;c)使双链核酸分子与连接酶接触以形成两端被发夹封端的双链addamer结构。在一些方面,前述方法还可包括用外切核酸酶处理步骤(c)的产物,从而纯化适当连接的addamer。在一些方面,前述方法还可包括在步骤(b)之后和在步骤(c)之前,使部分双链核酸分子与muts酶接触。
24、本公开提供了产生本公开的addamer的方法,所述方法包括:a)将addamer序列克隆到噬菌粒中,使得addamer序列的两侧上侧接一种或多种可被选择性活化的脱氧核酶;b)使用辅助噬菌体将噬菌粒转化为包装的噬细菌体,其中包装的噬细菌体产生包含两侧上侧接一种或多种脱氧核酶的addamer序列的单链dna;c)纯化由包装的噬细菌体产生的单链dna;d)使纯化的单链dna折叠以产生一种或多种脱氧核酶结构和双链addamer序列的大部分;e)活化一种或多种脱氧核酶,从而从由包装的噬细菌体产生的单链dna中切除addamer序列;f)使切除的addamer与连接酶接触。前述方法还可包括用外切核酸酶处理步骤(f)的产物,从而纯化适当连接的addamer。
25、本公开提供了产生本公开的addamer的方法,所述方法包括:a)将addamer序列克隆到质粒中;b)在合适的宿主生物中繁殖质粒;c)从宿主生物中纯化质粒;d)用一种或多种切口酶和限制性内切核酸酶或仅一种或多种切口酶处理纯化的质粒以从质粒中切除addamer序列;和e)使切除的addamer序列与连接酶接触以产生两端被发夹结构封端的双链addamer结构。
26、本公开提供了一种合成包含靶核酸序列的核酸分子的方法,所述方法包括:a)提供固定到固体支持物的本公开的第一addamer,其中第一addamer包含第一iisre序列,接着是第一n-聚体序列,接着是第二iisre序列,接着是发夹结构;b)提供固定到固体支持物的本公开中的任一项的第二addamer,其中第二addamer包含第三iisre序列,接着是第二n-聚体序列,接着是第四iisre序列,接着是发夹结构;c)使第一addamer与裂解位于第一addamer中的第二iisre序列的iisre接触,从而产生第一裂解产物,所述第一裂解产物被固定到固体支持物并且包含第一iisre序列、第一n-聚体序列以及3’突出端、5’突出端或平端;d)使所述第二addamer与裂解位于第二addamer中的第三iisre序列的iisre接触,从而产生第二裂解产物,其被释放到溶液中并且包含第二n-聚体序列、第四iisre序列、3’突出端、5’突出端或平端,并且其中所述第二裂解产物在一端被发夹结构封端;e)使用连接酶连接第一裂解产物和第二裂解产物以产生第一连接产物;f)用外切核酸酶处理步骤(e)的产物,从而去除未连接的第一裂解产物和/或第二裂解产物;和g)重复步骤(a)至(f)直到合成包含靶核酸序列的核酸分子。
27、在一些方面,连接酶可以是人dna连接酶iii(hlig3)。在一些方面,连接酶可以是t4 dna连接酶。
28、在一些方面,靶核酸序列的长度可以是至少约100个、或至少约500个、或至少约1000个、或至少约2000个、或至少约3000个、或至少约4000个、至少约5000个核苷酸。
29、在一些方面,包含通过本公开的方法合成的靶核酸序列的核酸分子可以具有至少80%或至少90%的纯度。
- 还没有人留言评论。精彩留言会获得点赞!