一种以葡萄种子为受体材料的农杆菌介导遗传转化方法
1.本发明涉及植物基因工程技术领域,特别是涉及一种以葡萄种子为受体材料的农杆菌介导遗传转化方法。
背景技术:
2.葡萄(vitis l.)是世界上种植最广泛、最具经济价值的水果作物之一。葡萄以其外形美观、味道鲜美、营养价值高、众多保健功能而深受消费者喜爱,被誉为“水果皇后”。例如,葡萄浆果富含多种生物活性物质,如多酚类、黄酮类、花青素、植物纤维以及多种维生素和矿物质,可以保护皮肤和心血管及神经系统,并提供抗菌、抗氧化作用与抗炎症作用。然而,由于广泛栽培的葡萄属植物多为欧亚种,其抗抗逆性普遍较差;同时作为多年生果树类作物童期长、基因组高度杂合,新品种的培育受到季节、地域等众多因素的限制,致使传统育种方式年限较长、选择过程繁琐费时。作为一种替代方法,遗传转化可以通过在不改变理想性状的情况下添加单一性状来改变葡萄品种的特性。一个快速、高效、可重复的遗传转化系统是实现葡萄品种改良的前提条件。
3.葡萄属植物高频的再生体系的建立是开展遗传转化的基础。尽管目前通过器官发生途径如欧洲葡萄叶片、茎节和花药为受体获取了葡萄体外再生植株,但仍然缺乏能够实现葡萄属植物高效遗传转化系统。因此,与花器、茎段、叶片和其他外植体材料相比,未成熟的合子胚可以被长期保存,且不易受季节性因素和处理技术的影响。目前,通过未成熟合子胚途径建立再生系统已在水稻、小麦、玉米等谷类作物中广泛实现,而在葡萄属植物中以种子作为受体材料进行农杆菌介导的遗传转化的报道较少。迄今为止,分子育种遗传转化工具不仅促进了非生物胁迫抗性品种的创制,而且为改善植物的品质、营养等农艺性状提供了技术支持。遗传转化可在不改变品种特性的情况下,借助dna转移技术对植物进行遗传改良以提高其农艺性状的可能性,如将抗病或抗除草剂基因转移到现有的无性系作物上,且能够极大缩短育种周期。因此,通过打破葡萄种子休眠诱导初生胚萌发为建立高效遗传转化奠定了强有力的技术支撑。
技术实现要素:
4.本发明的目的是提供一种以葡萄种子为受体材料的农杆菌介导遗传转化方法,以解决上述现有技术存在的问题,本发明通过农杆菌介导,以葡萄种子作为受体材料进行侵染,绕开了由外植体脱分化形成、愈伤组织再分化形成体胚的漫长步骤,相较于胚性愈伤组织为受体的遗传体系,转化周期缩短了2个月。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种以葡萄种子为受体材料的农杆菌介导遗传转化方法,包括以下步骤:
7.s1、葡萄种子经预处理后,培养至种皮开裂;
8.s2、采用农杆菌侵染法将种皮开裂的葡萄种子侵染,得到侵染后的葡萄种子;
9.s3、侵染后的葡萄种子培养后,筛选得到农杆菌转化植株。
10.进一步的,在步骤s1中,所述预处理包括:将葡萄种子置于赤霉素溶液浸泡后,再进行水浴处理;所述水浴处理的温度为55℃。
11.其中,种子最佳预处理方式,是将破除种子休眠方式高效应用于遗传转化体系中,又能使得农杆菌充分渗入种子内部,因此借助种子自身萌发力将种子预培养至种壳开裂≥1mm时为最佳侵染状态。
12.进一步的,所述预处理还包括消毒处理以及皮切处理。
13.进一步的,在步骤s2中,所述农杆菌侵染法的步骤包括:将农杆菌活化后培养,得到农杆菌侵染液,将步骤s1中得到的种皮开裂的葡萄种子放入容器中,随即倒入所述农杆菌侵染液封口,然后抽真空侵染。
14.进一步的,所述农杆菌侵染液的od值为0.6。
15.进一步的,所述农杆菌活化过程中,在农杆菌菌液中添加200mm的乙酰丁香酮。
16.进一步的,所述抽真空侵染的时间为3min。
17.进一步的,在步骤s3中,所述培养的步骤包括:将侵染后的葡萄种子培养至初生子叶萌发并于暗光下转色。
18.进一步的,所述培养采用的培养基的组分包括250mg
·
l-1
头孢霉素和250mg
·
l-1
羧苄青霉素。
19.进一步的,在步骤s3中,所述筛选包括采用培养基进行筛选培养,所述筛选采用的培养基组分包括250mg
·
l-1
头孢霉素、250mg
·
l-1
羧苄青霉素和30mg
·
l-1
卡那霉素。
20.对于卡那霉素浓度筛选,是将种子首选在mel3预培养基培养至其初生子叶完全萌发并转色后,依次接种至含有0、10、20、30、40和50mg
·
l-1
kan的生根培养基中,8/16h(光照/黑暗)条件,培养8周左右统计存活率及其生根情况。
21.本发明公开了以下技术效果:
22.本发明以葡萄种子为外植体,取材方便、不受季节限制也可长期保存。重要的是只需20d就可萌发形成完整初生胚,将初生胚置于生根培养基中生长至形成健全葡萄植株仅需40d,因此再生时间上占有较大优势。种子再生萌发整齐为农杆菌侵染提供了充分的受体材料,且葡萄种壳开裂时间相近为农杆菌菌液快速进入且充分侵染带来极大便利。因此,基于再生效率之上其转化效率高达12.8%。本发明方法中再生芽的发生途径绕开了由外植体脱分化形成、愈伤组织再分化形成体胚的漫长步骤,且受体统一、充足,只需4个月就可形成完整葡萄小苗,相较于胚性愈伤遗传转化周期缩短了2个月。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
24.图1为phzm03::egfp表达载体的t-dna示意图;
25.图2为
‘
霞多丽’叶片gfp荧光检测图,其中,a为不同处理方式的叶片;b为转化叶片和野生型叶片;
26.图3为遗传转化过程示意图;其中a.种子预培养至种皮开裂≥1mm,b.超声处理,c.抽真空处理,d.针刺造伤处理,e.常规处理,f.
‘
霞多丽’初生子叶胚,g.生根筛选培养基,h.筛选80d后的植株,i.再生植株,j.移栽至v
基质
:v
蛭石
:v
珍珠岩
=3:1:1,k.获取
‘
霞多丽’转基因植株;
27.图4为phzm03::egfp载体转化后western blot检测图;1-13为转基因植株,wt为未转化植株对照;
28.图5为phzm03::vamyb4a::egfp表达载体的t-dna示意图;
29.图6为phzm03::vamyb4a::egfp载体转化后western blot检测图;1-10为转基因植株,wt为未转化植株对照;
30.图7为不同赤霉素浓度处理及不同种子切法处理方法对种子萌发率的影响示意图;a为将
‘
霞多丽’种子置于不同浓度的ga3中,以更好地评价种子的再生能力,其中,所用标尺为1cm;b为采取不同切法诱导种子再生,其中a.不切,b.皮切,c.切半,所用标尺为1mm;c为不同浓度ga3(0、1、1.5、2、2.5和3.0g
·
l-1
)处理下采取不同切法处理后种子的再生效率;运用统计学分析软件spss 24.0对所有数据进行统计学分析,采用student-t检验样本见差异的显著性(*p《0.05,**p《0.01);
31.图8为卡那霉素对葡萄萌发影响示意图;a为
‘
霞多丽’野生型植株对含有300μ
·
l-1
iba的ms培养基中不同浓度卡那霉素影响下生根情况,其中a.含有0mg
·
l-1
卡那霉素培养基,b.含有10mg
·
l-1
卡那霉素,c.含有20mg
·
l-1
卡那霉素,d.含有30mg
·
l-1
卡那霉素,e.含有40mg
·
l-1
卡那霉素,f.含有50mg
·
l-1
卡那霉素;b为培养48天后,卡那霉素对
‘
霞多丽’植株根系生长的影响(值为3个重复的平均
±
标准差(sds)),在p=0.05的duncan多范围检验,相同字母后面的平均值没有显著差异;
32.图9为不同预处理方式对种子萌发率影响示意图;
33.图10为不同预处理方式对种子转化率影响示意图;
34.图11为不同乙酰丁香酮浓度对种子萌发率影响示意图;
35.图12为不同乙酰丁香酮浓度对种子转化率影响示意图;
36.图13为不同od值的农杆菌菌液对种子萌发率影响示意图;
37.图14为不同od值的农杆菌菌液对种子转化率影响示意图;
38.图15为农杆菌不同侵染时间对种子萌发率影响示意图;
39.图16为农杆菌不同侵染时间对种子转化率影响示意图;
40.图17为农杆菌不同侵染方式对种子萌发率影响示意图;
41.图18为农杆菌不同侵染方式对种子转化率影响示意图。
具体实施方式
42.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
43.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包
括或排除在范围内。
44.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
45.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
46.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
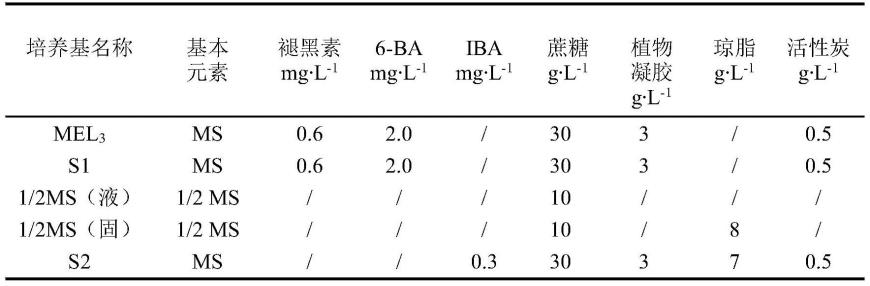
47.下述实施例中所采用的培养基成分见表1:
48.表1
[0049][0050]
注:s1培养基需加入250mg
·
l-1
头孢霉素、羧苄青霉素;
[0051]
s2培养基需加入250mg
·
l-1
头孢霉素、羧苄青霉素及30mg
·
l-1
卡那霉素;
[0052]
1/2ms(液)培养基需加入100mm乙酰丁香酮。
[0053]
实施例1
[0054]
植物材料:酿酒葡萄
‘
霞多丽’,于2021年8月23日采集于宁夏兰山娇子酒庄。
[0055]
菌种:农杆菌eha105购自于上海唯地生物技术有限公司;植物表达载体phzm03::egfp,由本实验室保存,该载体带有gfp标签及卡那霉素抗性基因。
[0056]
药品:lb培养基、ms基本培养基、褪黑素(melation)、3-吲哚丁酸(3-indolebutyric acid,iba)、6-苄基嘌呤(6-benzylaminopurine,6-ba)等,均购于北京索莱宝生物试剂公司;植物凝胶(phytagel)购于上海拜谱生物公司;琼脂粉(agar)购于上海生工生物有限公司;活性炭(activated charcoal)购于成都市科隆化学品有限公司。
[0057]
将phzm03::egfp植物表达载体转化到酿酒葡萄
‘
霞多丽’,步骤如下:
[0058]
1、种子预处理
[0059]
(1)打破休眠:取酿酒葡萄
‘
霞多丽’种子浸泡于含有2.5g
·
l-1
赤霉素溶液的三角瓶中,随后放入55℃水浴锅中恒温处理15min后拿出,后置于常温下25℃培养24h后进行下述操作。
[0060]
(2)消毒接种:超净工作台内将三角瓶中的赤霉素溶液倒弃,无菌水冲洗2遍后加入70%酒精轻晃30s,无菌水冲洗3次后加入15%次氯酸钠溶液(有效氯为1.5%)轻晃消毒
15min后继续无菌水冲洗3次完成种子消毒处理。随即将种子夹至装有无菌吸水纸的培养皿中,吸附种皮表面多余水分后进行皮切处理后,整齐摆放于预培养基mel3中,培养至其种皮开裂(具体培养至种皮开裂≥1mm)。
[0061]
2、农杆菌活化与悬浮:
[0062]
(1)农杆菌株保存:将含phzm03::egfp载体的eha105菌液于lb固体培养基上(氯化钠10g
·
l-1
+tryptone 10g
·
l-1
+yeast extract 5g
·
l-1
+琼脂16g
·
l-1
+卡那霉素50mg
·
l-1
+利福平10mg
·
l-1
)划线培养,phzm03::egfp表达载体的t-dna示意图如图1所示,并倒置于28℃恒温培养箱中避光培养3d,直至平板长出单菌落,挑取单菌落接种于含有50mg
·
l-1
卡那霉素与10mg
·
l-1
利福平的5ml lb液体摇菌管中,置于摇床150rpm,28℃恒温黑暗培养16h。吸取培养过夜的菌液800μl与等体积30%甘油于2.0离心管中混匀,置于-80℃冰箱保存。
[0063]
(2)农杆菌液二次活化:在超净工作台内将步骤(1)制备的菌株在冰上融化后摇匀,吸取500μl,接种至50ml lb液体培养基(氯化钠10g
·
l-1
+tryptone 10g
·
l-1
+yeast extract 5g
·
l-1
+卡那霉素50mg
·
l-1
+利福平10mg
·
l-1
)的150ml锥形瓶中,置于摇床150rpm,28℃恒温黑暗培养16h,拿出菌液,将菌液分装至已完成灭菌处理的50ml离心管中,4℃,5500r
·
min-1
,离心10min后弃上清液,加入5ml 1/2ms(液)将菌液冲起后摇匀,此操作重复3次,测od
600
=0.6,随即在农杆菌菌液中加入乙酰丁香酮(200mm),置于摇床150rpm,28℃恒温黑暗培养2h,获得农杆菌侵染液。
[0064]
3、农杆菌介导遗传转化:
[0065]
通过侵染时间(10,20和30min)、农杆菌细菌浓度od
600
(0.2、0.4、0.6、0.8和1.0)、乙酰丁香酮浓度(0、100、200和300mm)和侵染方法(造伤、真空及超声)的影响下对转化频率进行了评估,以获取最佳的农杆菌介导的
‘
霞多丽’种子转化系统。于超净工作台中将步骤1中完成预处理的
‘
霞多丽’种子夹至灭菌滤纸上,使用沾有农杆菌菌液的注射器(5ml)刺穿种子喙部(深度约1mm)并夹入灭菌锥形瓶中,随即倒入菌液封口,为使得种子得以充分侵染,使用超声波清洗机(上海昆山超声仪器,kq5200dv)在100w下对含有外植体和农杆菌悬菌液的锥形瓶进行超声处理20s。然后,继续将锥形瓶转移至无油真空泵(无油式真空泵410)中进行0.8mpa处理3min,剩余时间以手腕轻柔晃动锥形瓶补齐。农杆菌侵染结束后将种子从锥形瓶中夹至含有灭菌滤纸的玻璃皿中吸取种壳表面多余菌液,最后将种子整齐摆放于含有被1/2ms液体培养基润湿滤纸的1/2ms固体共培养基中,25℃暗培养,48h后将种子夹至含有无菌水的灭菌锥形中,依次加入500mg
·
l-1
头孢霉素、500mg
·
l-1
羧苄青霉素溶液轻晃15min后使用无菌水冲洗3次,接种至s1培养基中培养至初生子叶萌发并于暗光下转色后,接种至s2培养基,进行筛选培养。所有实验均重复五次。
[0066]
4、检测:当葡萄植株在组培瓶中生长出3~5叶期,剪取新叶采用蛋白检测,
‘
霞多丽’叶片gfp荧光检测图如图2所示;
[0067]
5、移栽:培养约2个月后挑选健壮植株移栽至装有基质v
基质
:v
蛭石
:v
珍珠岩
=3:1:1的营养钵中育苗,移栽初期需要加盖透明的塑料杯以保持湿度,待塑料杯中水汽消失一周后可去除塑料杯,进一步炼苗。该葡萄种子从预处理至移栽的遗传转化过程如图3所示。
[0068]
6、检测:新叶2叶期(大概需要45天时间),从成活231株被菌液侵染植株中提取蛋白,经蛋白检测有gfp阳性植株共有62株,转化率为27%,其中phzm03::egfp载体转化后
western blot检测图如图4所示。
[0069]
实施例2
[0070]
将phzm03::vamyb4a::egfp植物表达载体由本实验室构建,通过农杆菌介导转化到酿酒葡萄
‘
霞多丽’,phzm03::vamyb4a::egfp表达载体的t-dna示意图如图5所示,具体转化步骤同实施例1,在新叶2叶期进行检测,从98颗被菌液侵染种子萌发的葡萄植株中提取蛋白,经蛋白检测有gfp阳性植株共有10株,转化率为10%,其中phzm03::vamyb4a::egfp载体转化后western blot检测图如图6所示。
[0071]
实施例3
[0072]
将实施例1中利用赤霉素进行处理的赤霉素浓度分别设置为0、0.5、1.0、1.5、2.0、2.5和3.0g
·
l-1
,将消毒接种过程中对种子分别采用皮切、纵切和不切的处理方法,其余操作同实施例1。探究不同赤霉素浓度处理及不同种子切法处理方法对种子萌发率的影响,试验结果如图7。由图7可知,经2.5g
·
l-1
赤霉素浸泡后采用皮切切法进行处理的种子萌发率最高。
[0073]
实施例4
[0074]
将实施例1中s2培养基中卡那霉素的浓度分别设置为0、10、20、30、40和50mg
·
l-1
,其余操作同实施例1。探究不同卡那霉素浓度处理对种子萌发率的影响,试验结果如图8。由图8可知,30mg
·
l-1
卡那霉素为抑制
‘
霞多丽’遗传转化中非抗性细胞的最佳浓度。
[0075]
实施例5
[0076]
将实施例1中预处理方式根据是否含有超纯水(h2o)、是否含有赤霉素(ga3:0或2.5g
·
l-1
)、是否温汤浸种(hot:55℃水浴锅恒温加热15min)和不同切法处理四种因素分别设置h2o+皮切(沿种子喙部至种脐斜面划破种皮)、h2o+切半(沿种脐纵向切割)、h2o+hot+皮切、h2o+hot+切半、h2o+hot+ga3+皮切和h2o+hot+ga3+切半共六种处理,其余操作同实施例1。探究不同预处理方式对萌发率和转化率的影响。结果如图9和图10所示。根据图9、图10可知,采用h2o+hot+ga3+皮切的预处理方式,种子萌发率和转化率最高。
[0077]
实施例6
[0078]
将实施例1中乙酰丁香酮浓度分别设置为0、100、200和300mm,其余操作同实施例1。探究不同乙酰丁香酮浓度对种子萌发率和转化率的影响。结果如图11和图12所示。根据图11可知,乙酰丁香酮浓度为100mm时萌发率最高。根据图12可知,乙酰丁香酮浓度为200mm时转化率最高。
[0079]
实施例7
[0080]
将实施例1中农杆菌液od
600
值分别设置为0.2、0.4、0.6、0.8和1.0,其余操作同实施例1。探究不同农杆菌液od
600
值对种子萌发率和转化率的影响。结果如图13和图14所示。结果如图13和图14所示。根据图13、图14可知,当od
600
=0.6时,种子萌发率和转化率最高。
[0081]
实施例8
[0082]
将实施例1中农杆菌侵染时间分别设置为10、20和30min,其余操作同实施例1。探究不同农杆菌侵染时间对种子萌发率和转化率的影响。结果如图15和图16所示。根据图15可知,侵染时间为10min时萌发率最高。根据图16可知,侵染时间为20min时转化率最高。
[0083]
实施例9
[0084]
将实施例1中农杆菌侵染方式分别设置为抽真空(0.8mpa,3min)、真空(0.8mpa,
3min)+超声(100w,20s)、造伤(使用沾有农杆菌菌液的5ml注射器刺穿种子喙部约1mm)+真空(0.8mpa,3min)、造伤+真空(3min)+超声(20s)和常规(手腕轻柔晃动锥形瓶),其余操作同实施例1。探究不同农杆菌侵染方式对种子萌发率和转化率的影响,结果如图17和图18所示。根据图17、图18可知,采用抽真空(3min)的方式,种子萌发率和转化率最高。
[0085]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 5‑HT2B拮抗剂的制造方法与工艺
- 1‑(噻唑‑2‑基)哌啶‑4‑醇的合成方法与制造工艺
- 一种大麻酚类化合物的合成方法与制造工艺
- 一类对GPR84具有激动作用的化合物及其制备方法和用途与制造工艺
- eGFP标记GPR120阳性细胞的小鼠模型构建方法
- 靶向生长抑素受体的Al<sup>18</sup>F?NOTA?PEG<sub>6</sub>?TATE及其制备方法和应用
- 吡咯烷衍生物的口服制剂的制作方法
- 胰高血糖素样肽-1受体激动剂制备治疗肺动脉高压药物的应用
- 一种armc5基因检测试剂盒及突变位点的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法