一种分化造血干/祖细胞的方法、培养基及应用与流程
1.本技术涉及生物医药领域,具体的涉及一种分化造血干/祖细胞的方法。
背景技术:
2.造血干/祖细胞是血液中的成体干祖细胞,能够分化到血液系统中的各类细胞,包括髓系细胞(如红细胞和血小板)以及淋系的免疫细胞(如t细胞、b细胞和nk细胞)等。不仅是造血干/祖细胞,其分化的各类细胞都具有诸多用途。例如,造血干/祖细胞及其分化的细胞可用于细胞测试、药物筛选、毒性测试以及临床医学研究。因此,优化造血干/祖细胞的增殖和/或分化方法,构建稳定的造血干/祖细胞培养平台意义重大。
3.多能细胞可以在体外无限繁殖扩增,并具有向一个或多个血细胞系定向分化增殖的能力。因此,多能细胞体外高效增殖和/或分化造血干/祖细胞可作为缓解造血干/祖细胞供应不足的有效方法,同时也可以降低造血干/祖细胞的污染风险,利于临床医学的研究。
4.目前,还没有一个稳定的造血干/祖细胞培养平台,不能通过多能细胞快速增殖分化造血干/祖细胞,同时,现有的分化方法分化效率低,有很高的污染风险,不利于后续研究。因此,亟待研究一种分化造血干/祖细胞的方法,解决相关问题。
技术实现要素:
5.本技术提供了一种诱导多能细胞向造血干/祖细胞增殖和/或分化的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。本技术提供的方法同样适用于增殖和/或分化和/或维持造血干/祖细胞以及诱导多能细胞生成拟胚体(eb)。通过本技术提供的方法,能够提高多能细胞生成拟胚体(eb)的效率,提高多能细胞生成造血干/祖细胞的效率,提高拟胚体(eb)生成造血干/祖细胞的效率。
6.一方面,本技术提供了一种诱导多能细胞向造血干/祖细胞增殖和/或分化的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
7.另一方面,本技术提供了一种增殖和/或分化和/或维持造血干/祖细胞的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
8.另一方面,本技术提供了一种诱导多能细胞生成拟胚体(eb)的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
9.在某些实施方式中,所述方法中所述mtesr和apel分别存在于不同造血干/祖细胞分化培养基中,需要分步使用。
10.在某些实施方式中,所述方法中所述造血干/祖细胞分化培养基包含基础培养基。在某些实施方式中,所述基础培养基包含选自下组中的一种或者多种:dmem、mem、rpmi 1640、imdm、df(f-12)、mccoy5a、l-15、mtesr、apel、stemspan
™ꢀ
sfem ii。
11.在某些实施方式中,所述方法中所述基础培养基为mtesr。
12.在某些实施方式中,所述方法中所述基础培养基为apel。
13.在某些实施方式中,所述造血干/祖细胞分化培养基还包含选自下组的一种或多
种:营养物、提取物、生长因子、激素、细胞因子以及培养基添加剂。在某些实施方式中,所述方法中所述分化培养基中包含选自以下组中的一种或者多种:rock抑制剂、bmp4(骨形态发生蛋白)、vegf(血管内皮细胞生长因子)、scf(干细胞因子)、il-3、il-6、tpo(血小板生成素)、以及flt3(fms相关酪氨酸激酶3配体)。
14.在某些实施方式中,所述方法中所述rock抑制剂为y27634。
15.在某些实施方式中,所述方法中所述y27634浓度约为1-50μm。
16.在某些实施方式中,所述方法中所述bmp4浓度约为5-100ng/ml。
17.在某些实施方式中,所述方法中所述vegf浓度约为5-100ng/ml。
18.在某些实施方式中,所述方法中所述scf浓度约为5-100ng/ml。
19.在某些实施方式中,所述方法中所述il-3浓度约为5-100ng/ml。
20.在某些实施方式中,所述方法中所述il-6浓度约为5-100ng/ml。
21.在某些实施方式中,所述方法中所述tpo浓度约为5-100ng/ml。
22.在某些实施方式中,所述方法中所述flt3浓度约为5-100ng/ml。
23.在某些实施方式中,所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅰ,所述造血干/祖细胞分化培养基ⅰ包含mtesr以及rock抑制剂。
24.在某些实施方式中,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅱ,所述造血干/祖细胞分化培养基ⅱ包含apel、bmp4、vegf以及scf。
25.在某些实施方式中,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅲ,所述造血干/祖细胞分化培养基ⅲ包含stemspan
™ꢀ
sfem ii、il-3、il-6、scf、tpo以及flt3。
26.在某些实施方式中,所述方法在无血清条件下进行。
27.在某些实施方式中,所述方法在无滋养条件下进行。
28.在某些实施方式中,所述方法在约35-39℃条件下培养细胞。
29.在某些实施方式中,所述方法在约3-7%co2条件下培养细胞。
30.在某些实施方式中,所述方法中所述多能细胞是胚胎干细胞。
31.在某些实施方式中,所述方法中所述多能细胞是诱导多能干细胞。
32.在某些实施方式中,所述方法中所述造血干/祖细胞来源于胚胎干细胞。
33.在某些实施方式中,所述方法中所述造血干/祖细胞来源于诱导多能干细胞。
34.在某些实施方式中,所述方法中所述造血干/祖细胞来源于离体的人源血液。
35.在某些实施方式中,所述方法中所述造血干/祖细胞来源于脐带血。
36.在某些实施方式中,所述方法中所述造血干/祖细胞来源于骨髓。
37.在某些实施方式中,所述方法中所述造血干/祖细胞为cd34+造血干/祖细胞。
38.在某些实施方式中,所述方法包含将多能细胞接种于人工基底膜(matrigel)或玻连蛋白(vitronectin)预包被的培养皿或者细胞培养六孔板中。
39.在某些实施方式中,所述方法包含将增殖至一定数量的细胞用消化液处理。在某些实施方式中,所述方法中所述消化液为accutase消化液。在某些实施方式中,所述方法中所述消化液为0.05% 胰蛋白酶(trypsin)+edta。
40.在某些实施方式中,所述方法包含将多能细胞培养为拟胚体(eb)。
41.在某些实施方式中,所述方法包含将多能细胞收集培养,经过两次沉降获得拟胚
体(eb)。
42.在某些实施方式中,所述方法包含以下步骤:(1)将多能细胞接种于mtesr1培养基中进行增殖培养,约4-7天;(2)将多能细胞接种于造血干/祖细胞分化培养基ⅰ中,继续培养;(3)将细胞接种于造血干/祖细胞分化培养基ⅱ中继续培养约6天,每3天将细胞收集后进行一次沉降并更换一次新鲜的造血干/祖细胞分化培养基ⅱ中,沉降2次;(4)收集沉降后获得的拟胚体(eb),使用0.05% 胰蛋白酶(trypsin)+edta消化,10% fbs终止消化,获得造血干/祖细胞。
43.另一方面,本技术提供了一种培养基,其包含mtesr以及apel。
44.在某些实施方式中,所述mtesr和apel分别存在于不同造血干/祖细胞分化培养基中,需要分步使用。
45.在某些实施方式中,所述培养基包含基础培养基。在某些实施方式中,所述基础培养基包含选自下组中的一种或者多种:dmem、mem、rpmi 1640、imdm、df(f-12)、mccoy5a、l-15、mtesr、apel、stemspan
™ꢀ
sfem ii。
46.在某些实施方式中,所述培养基中所述基础培养基为mtesr。
47.在某些实施方式中,所述培养基中所述基础培养基为apel。
48.在某些实施方式中,所述培养基还包含选自下组的一种或多种:营养物、提取物、生长因子、激素、细胞因子以及培养基添加剂。
49.在某些实施方式中,所述培养基中包含选自以下组中的一种或者多种:rock抑制剂、bmp4(骨形态发生蛋白)、vegf(血管内皮细胞生长因子)、scf(干细胞因子)、il-3、il-6、tpo(血小板生成素)、以及flt3(fms相关酪氨酸激酶3配体)。
50.在某些实施方式中,所述培养基中包含rock抑制剂。
51.在某些实施方式中,所述培养基中所述rock抑制剂为y27634。
52.在某些实施方式中,所述培养基中所述y27634浓度约为1-50μm。
53.在某些实施方式中,所述培养基中所述bmp4浓度约为5-100ng/ml。
54.在某些实施方式中,所述培养基中所述vegf浓度约为5-100ng/ml。
55.在某些实施方式中,所述培养基中所述scf浓度约为5-100ng/ml。
56.在某些实施方式中,所述培养基中所述il-3浓度约为5-100ng/ml。
57.在某些实施方式中,所述培养基中所述il-6浓度约为5-100ng/ml。
58.在某些实施方式中,所述培养基中所述tpo浓度约为5-100ng/ml。
59.在某些实施方式中,所述培养基中所述flt3浓度约为5-100ng/ml。
60.在某些实施方式中,所述培养基中包含造血干/祖细胞分化培养基ⅰ,所述造血干/祖细胞分化培养基ⅰ包含mtesr以及rock抑制剂。
61.在某些实施方式中,所述培养基中包含造血干/祖细胞分化培养基ⅱ,所述造血干/祖细胞分化培养基ⅱ包含apel、bmp4、vegf以及scf。
62.在某些实施方式中,所述培养基中包含造血干/祖细胞分化培养基ⅲ,所述造血干/祖细胞分化培养基ⅲ包含stemspan
™ꢀ
sfem ii、il-3、il-6、scf、tpo以及flt3。
63.在某些实施方式中,所述培养基不含血清。
64.另一方面,本技术还提供一种组合物,其包含多能细胞,以及所述的培养基。
65.另一方面,本技术还提供一种组合物,其包含造血干/祖细胞,以及所述的培养基。
66.另一方面,本技术还提供一种组合物,其包含拟胚体(eb),以及所述的培养基。
67.另一方面,本技术还提供一种用于获得造血干/祖细胞的培养平台,其包含所述方法、培养基、组合物、培养平台。
68.另一方面,本技术还提供一种用于获得拟胚体(eb)的培养平台,其包含所述方法、培养基、组合物、培养平台。
69.另一方面,本技术还提供所述方法、培养基、组合物、培养平台的应用。
70.在某些实施方式中,所述方法、培养基、组合物、培养平台的应用为诱导多能细胞增殖和/或分化造血干/祖细胞。
71.在某些实施方式中,所述方法、培养基、组合物、培养平台的应用为增殖和/或分化和/或维持造血干/祖细胞。
72.在某些实施方式中,所述方法、培养基、组合物、培养平台的应用为诱导多能细胞生成拟胚体(eb)。
73.另一方面,本技术还提供一种预防和/或治疗疾病的方法,其包含向有需要的受试者施用造血干/祖细胞,所述造血干/祖细胞通过所述方法、所述培养基、所述组合物、所述培养平台获得。
74.本领域技术人员能够从下文的详细描述中容易地洞察到本技术的其它方面和优势。下文的详细描述中仅显示和描述了本技术的示例性实施方式。如本领域技术人员将认识到的,本技术的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本技术所涉及发明的精神和范围。相应地,本技术的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
75.本技术所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本技术所涉及发明的特点和优势。对附图简要说明如下:图1a-图1c显示的是本技术所述第一次eb沉降后流式细胞分析结果,图1a显示大小合适的活细胞比例,图1b显示活细胞比率,图1c显示活细胞中cd34+造血干/祖细胞比例。
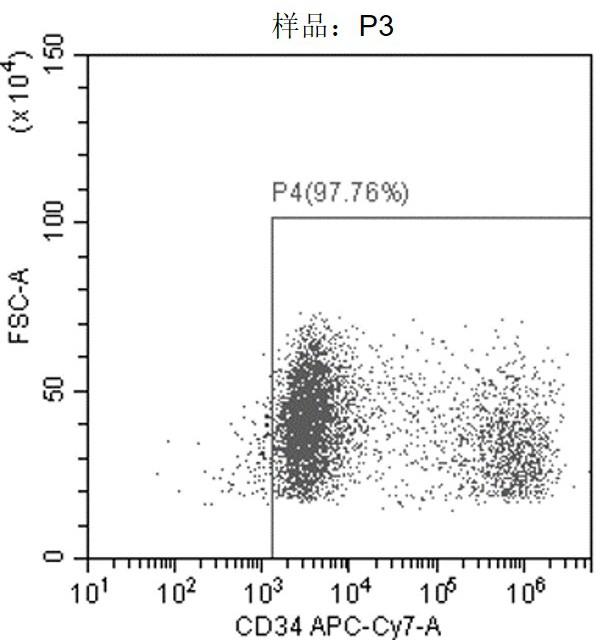
76.图2a-图2c显示的是本技术所述第二次eb沉降后流式细胞分析结果,图2a显示大小合适的活细胞比例,图2b显示活细胞比率,图2c显示活细胞中cd34+造血干/祖细胞比例。
77.图3a-图3c显示的是本技术所述使用imdm培养基代替mtesr培养基和apel培养基,第二次eb沉降后流式细胞分析结果,图3a显示大小合适的活细胞比例,图3b显示活细胞比率,图3c显示活细胞中cd34+造血干/祖细胞比例。
具体实施方式
78.以下由特定的具体实施例说明本技术发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本技术发明的其他优点及效果。
79.术语定义在本技术中,术语“多能细胞”通常是指能够自我复制和具有多潜能的细胞,其具有下述性质中的一种或多种:(1)能进行长期的自我更新,产生一个或多个与原始细胞类型
相同或不同的细胞;(2)在单细胞水平上分化为不同细胞,并在某些情况下,仅生成一种特化的细胞类型,以及(3)在体内功能性再生组织。干细胞根据其发育潜能被细分为全能性(totipotent)、多能性(pluripotent)、专能性(multipotent)和寡能性/单能性(oligo/unipotent)。多能细胞的来源和制备方法不受限制。例如,所述多能细胞可以是天然获得的也可以人工改造的。例如,所述多能细胞可以包括胚胎干细胞、诱导多能干细胞等。
80.在本技术中,术语“胚胎干细胞”也称“胚性干细胞”,可以简写为“esc”,通常是指具有无限增殖、自我更新和多向分化的特性的细胞。胚胎干细胞是从胚泡(早期胚胎阶段)未分化的内部细胞团中得到的干细胞,其来源和制备方法不受限制,无论在体外还是体内环境,胚胎干细胞都能被诱导分化为机体几乎所有的细胞类型,例如,所述细胞类型可以是造血干细胞,神经细胞、心肌细胞等。
81.在本技术中,术语“诱导多能干细胞”可以简写为“ips”细胞或“ipsc”,通常是指以人工方式从非多能细胞制备的一类多能干细胞。获得诱导多能干细胞的方式可以是导入特定的转录因子,使终末分化的体细胞重编程。例如,所述终末分化的体细胞可以是成纤维细胞、造血干细胞、肌细胞、神经元、表皮细胞等。
82.在本技术中,术语“造血干/祖细胞”通常是指具有长期自我更新能力和分化成各类成熟血细胞潜能的细胞。造血干细胞的来源和制备方法不受限制,例如,所述造血干细胞可由多能细胞分化而来,可由骨髓或者血液中分离。造血干细胞可分化为多种细胞,例如,骨髓谱系细胞(例如,单核细胞和巨噬细胞,嗜中性粒细胞,嗜碱性粒细胞,嗜酸性粒细胞,红细胞,巨核细胞/血小板,树突细胞),和淋巴谱系细胞(例如,t细胞,b细胞,nk细胞)。
83.在本技术中,术语“分化”通常是指非特异性的或较少特异性的细胞获得特定细胞的特征的过程。分化的或分化诱导性细胞是在细胞谱系中占据更特异位置的细胞。
84.在本技术中,术语“祖细胞”通常也具有自我更新和分化成更多成熟细胞的能力,但定向于某个谱系。例如,造血祖细胞定向于血液谱系;髓样祖细胞定向于骨髓谱系;淋巴样祖细胞定向于淋巴谱系),而干细胞不必有这样的限制。
85.在本技术中,术语“细胞因子”通常指由细胞产生并影响产生细胞因子的细胞(自身)或者其他细胞的生理状态的化合物或者成分(例如,自体免疫因子)。细胞因子还包括由重组或者合成加工产生的任何化合物或者成分,这些加工的产物与天然存在形式具有相似的结构和/或生物学活性。例如,所述细胞因子还涵盖其截短体、功能活性片段、同源物、类似物及变体。
86.在本技术中,术语“标志物表型”通常指鉴定细胞上的标志物或者抗原以确定它们的表型(例如,分化状态和/或细胞类型)。例如,可以用免疫表型分类法,该方法使用抗体来识别呈现在细胞上的抗原。抗体可以是单克隆的也可以是多克隆的,通常选择与其他细胞标志交叉反应较小的。在种属间确定相同细胞类型的这些标志物可以被基于相同标志物鉴定,在种属间,这些标志物的结构上可能有差异(例如氨基酸序列)。细胞标志物可包含细胞分化标志物,以及基因表达标志物。基因表达标志物可包含能指示细胞类型或者分化状态的表达基因。
87.本文使用的术语“组合物”通常指包括包含指定量的指定成分的产品,以及直接或间接由指定量的指定成分的组合所产生的任何产品。在本技术中,所述组合物还可包含其他非活性成分,例如,载剂、赋形剂、佐剂、稳定剂等。
88.在本技术中,术语“离体”通常是指涉及对已从生物体内移除的细胞、组织和/或器官进行操作。在某些实施方式中,该细胞、组织和/或器官可以通过某些方法返回到生物体内,或进入其他生物体中。
89.在本技术中,术语“体外”通常指将生物体的一部分从生物体取出来或者释放出来。
90.在本技术中,术语“和/或”应理解为意指替代方案中任意一、二、多者或其任何组合。
91.在本技术中,术语“包括”通常是指包含、总括、含有或包涵的含义。在某些情况下,也表示“为”、“由
……
组成”的含义。
92.在本技术中,术语“约”通常是指在指定数值以上或以下0.5%-10%的范围内变动,例如在指定数值以上或以下0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、或10%的范围内变动。
93.发明详述分化造血干/祖细胞的方法一方面,本技术提供一种诱导多能细胞向造血干/祖细胞增殖和/或分化的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
94.另一方面,本技术还提供一种增殖和/或分化和/或维持造血干/祖细胞的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
95.另一方面,本技术还提供一种诱导多能细胞生成拟胚体(eb)的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
96.在本技术中,所述培养方法可以包含在基质包被的表面上培养细胞。
97.例如,所述培养方法中所述基质可以是层粘连蛋白、玻连蛋白、明胶、聚赖氨酸、血小板反应素或人工基底膜(matrigel
™
)。例如,所述培养方法中所述基质可以是玻连蛋白或人工基底膜(matrigel
™
)。
98.在本技术中,所述培养方法可以包含定期或者不定期补充和/或更换所述培养基。
99.在本技术中,所述培养方法可以包含在细胞增殖至足够数量后将细胞消化为单细胞。
100.例如,所述培养方法中的消化使用accutase消化液。例如,所述培养方法中的消化使用胰蛋白酶(trypsin)和edta。
101.在本技术中,所述培养方法可以包含将培养的细胞收集后每3天进行一次沉降,沉降两次后,获得拟胚体(eb)。
102.在本技术中,所述培养方法可以包含收集拟胚体(eb),离心后使用胰蛋白酶(trypsin)+edta消化拟胚体(eb),获得造血干/祖细胞。
103.在本技术中,所述培养可以在条件为约35-39℃的条件中培养。例如,约34.5
°
c、约35
°
c、约35.5
°
c、约36.
°
c、约36.5
°
c、约37
°
c、约37.5
°
c、约38
°
c、约38.5
°
c、约39
°
c、约39.5
°
c。
104.在本技术中,所述培养方法可以包含在约3-7% co2的条件下培养细胞,例如,约3% co2、约3.5% co2、约4% co2、约4.5% co2、约5% co2、约5.5% co2、约6% co2、约6.5% co2、约7% co、约7.5% co2。
105.在本技术中,所述培养方法可以在有血清的培养条件下进行。
106.在本技术中,所述培养方法可以在无血清的培养条件下进行。
107.在本技术中,所述培养方法可以在无饲养的培养条件下进行。
108.在本技术中,所述培养方法可以在有饲养的培养条件下进行。
109.在本技术中,所述培养方法中的多能细胞来源不受限制,可以是哺乳动物来源的,也可以是非哺乳动物来源的。
110.例如,所述多能细胞来源于人胚胎干细胞。例如,所述多能细胞来源于人诱导多能干细胞。
111.在本技术中,所述培养方法中的造血干/祖细胞来源不受限制。
112.例如,所述造血干/祖细胞来源于人胚胎干细胞。例如,所述造血干/祖细胞来源于人诱导多能干细胞。例如,所述造血干/祖细胞来源于离体的人源血液。例如,所述造血干/祖细胞来源于脐带血。例如,所述造血干/祖细胞来源于骨髓。例如,所述造血干/祖细胞是cd34+造血干/祖细胞。
113.在本技术中,所述培养方法中所述mtesr和apel分别存在于不同造血干/祖细胞分化培养基中,需要分步使用。
114.在本技术中,所述方法中所述造血干/祖细胞分化培养基包含基础培养基,所述基础培养可以选自下组中的一种或者多种:dmem、mem、rpmi 1640、imdm、df(f-12)、mccoy5a、l-15、mtesr、apel、stemspan
™ꢀ
sfem ii。
115.例如,所述基础培养基可以是mtesr。例如,所述基础培养基可以是apel。例如,所述基础培养基可以是stemspan
™ꢀ
sfem ii。
116.在本技术中,所述培养方法中分化培养基可以添加一种或多种物质,包括但不限于:营养物/提取物、生长因子、激素、细胞因子和培养基添加剂。
117.例如,所述培养方法中培养基可以包括基础培养,所述基础培养基可以是单一成分,也可以多种培养基的组合,基础培养基包括但不限于dmem、mem、rpmi 1640、imdm、df(f-12)、mccoy5a、l-15、mtesr、apel、stemspan
™ꢀ
sfem ii。
118.例如,所述培养方法中培养基可以添加一种或多种以下物质,包括但不限于血清替代物、谷氨酰胺、neaa(非必需氨基酸)、抗坏血酸(ascorbic acid)、表皮生长因子(egf)、酸性成纤维细胞生长因子(afgf)、碱性成纤维细胞生长因子(bfgf)、白血病抑制因子(lif)、肝细胞生长因子(hgf)、胰岛素样生长因子1(igf-1)、胰岛素样生长因子2(igf-2)、角化细胞生长因子(kgf)、神经生长因子(ngf)、血小板源生长因子(pdgf)、转化生长因子β(tgf-β)、骨形态发生蛋白(bmp4)、血管内皮细胞生长因子(vegf)、转铁蛋白(transferrin)、胰岛素(insulin)、硒(selenium)、各种白细胞介素(例如,il-1至il-18)、各种集落刺激因子(例如,粒细胞/巨噬细胞集落刺激因子(gm-csf))、各种干扰素(例如,ifn-γ)、干细胞因子(scf)、血小板生成素(tpo)、促红细胞生成素(epo)、n2添加物、b27添加物、、fms相关酪氨酸激酶3配体(flt3)。所述添加物质不限来源,可以从商购获得,也可以是天然的或者重组的。
119.例如,所述培养方法中培养基可以添加抑制剂,所述抑制剂可以包括但是不限于gsk-3抑制剂、mek抑制剂、rock抑制剂、金属蛋白酶抑制剂等。
120.例如,所述rock抑制剂包括但不限于多核苷酸、多肽和小分子,可减少rock表达
和/或rock活性。例如,所述rock抑制剂可以是y27632。
121.在本技术中,所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅰ,所述造血干/祖细胞分化培养基ⅰ包含mtesr以及rock抑制剂。
122.在本技术中,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅱ,所述造血干/祖细胞分化培养基ⅱ包含apel、bmp4、vegf以及scf。
123.在本技术中,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅲ,所述造血干/祖细胞分化培养基ⅲ包含stemspan
™ꢀ
sfem ii、il-3、il-6、scf、tpo以及flt3。
124.在本技术中,所述方法可以包含以下步骤:(1)将多能细胞接种于mtesr1培养基中进行增殖培养,约4-7天;(2)将多能细胞接种于造血干/祖细胞分化培养基ⅰ中,继续培养;(3)将细胞接种于造血干/祖细胞分化培养基ⅱ中继续培养约6天,每3天将细胞收集后进行一次沉降并更换一次新鲜的造血干/祖细胞分化培养基ⅱ中,沉降2次;(4)收集沉降后获得的拟胚体(eb),使用0.05% 胰蛋白酶(trypsin)+edta消化,10% fbs终止消化,获得造血干/祖细胞。
125.在本技术中,所述方法可以为体外方法。
126.在本技术中,所述方法可以为离体方法。
127.在本技术中,所述方法可以为非疾病的诊断和治疗为目的的方法。
128.培养基另一方面,本技术提供一种培养基,其包含mtesr以及apel,可以用于诱导多能细胞向造血干/祖细胞增殖和/或分化、增殖和/或分化和/或维持造血干/祖细胞、以及诱导多能细胞生成拟胚体(eb)。
129.例如,所述培养基可以是单一成分的,其包含基础培养基、rock抑制剂、bmp4、vegf、scf、il-3、il-6、tpo、以及flt3。
130.例如,所述培养基可以是组合培养基,可以使用其中的一个或多个进行相关操作,组合培养基中的一个或多个培养基可以包含基础培养基、rock抑制剂、bmp4、vegf、scf、il-3、il-6、tpo、以及flt3。
131.在本技术中,所述培养基可以添加一种或多种物质,包括但不限于:营养物/提取物、生长因子、激素、细胞因子和培养基添加剂。
132.例如,所述培养基可以包括基础培养,所述基础培养基可以是单一成分,也可以多种培养基的组合,基础培养基包括但不限于dmem、mem、rpmi 1640、imdm、df(f-12)、mccoy5a、l-15、mtesr、apel、stemspan
™ꢀ
sfem ii。
133.例如,所述培养基可以添加一种或多种以下物质,包括但不限于血清替代物、谷氨酰胺、neaa(非必需氨基酸)、抗坏血酸(ascorbic acid)、表皮生长因子(egf)、酸性成纤维细胞生长因子(afgf)、碱性成纤维细胞生长因子(bfgf)、白血病抑制因子(lif)、肝细胞生长因子(hgf)、胰岛素样生长因子1(igf-1)、胰岛素样生长因子2(igf-2)、角化细胞生长因子(kgf)、神经生长因子(ngf)、血小板源生长因子(pdgf)、转化生长因子β(tgf-β)、骨形态发生蛋白(bmp4)、血管内皮细胞生长因子(vegf)、转铁蛋白(transferrin)、胰岛素(insulin)、硒(selenium)、各种白细胞介素(例如,il-1至il-18)、各种集落刺激因子(例如,粒细胞/巨噬细胞集落刺激因子(gm-csf))、各种干扰素(例如,ifn-γ)、干细胞因子
(scf)、血小板生成素(tpo)、促红细胞生成素(epo)、n2添加物、b27添加物、、fms相关酪氨酸激酶3配体(flt3)。所述添加物质不限来源,可以从商购获得,也可以是天然的或者重组的。
134.例如,所述培养基可以添加抑制剂,所述抑制剂可以包括但是不限于gsk-3抑制剂、mek抑制剂、rock抑制剂、金属蛋白酶抑制剂等。
135.例如,所述rock抑制剂包括但不限于多核苷酸、多肽和小分子,可减少rock表达和/或rock活性。例如,所述rock抑制剂可以是y27632,thiazovivin,fasudil (ha-1077),gsk429286a,rki-1447,way-624704,h-1152,azaindole 1 (tc-s 7001),hydroxyfasudil (ha-1100),y-39983,netarsudil (ar-13324) ,gsk269962a,ripasudil (k-115) hydrochloride dihydrate,belumosudil (kd025),at13148,emetine hydrochloride,zinc00881524 或rock通路针对性抗体。例如,所述rock抑制剂可以是y27632。
136.在本技术中,所述培养基中包含造血干/祖细胞分化培养基ⅰ,所述造血干/祖细胞分化培养基ⅰ包含mtesr以及rock抑制剂。
137.在本技术中,所述培养基中包含造血干/祖细胞分化培养基ⅱ,所述造血干/祖细胞分化培养基ⅱ包含apel、bmp4、vegf以及scf。
138.在本技术中,所述培养基中包含造血干/祖细胞分化培养基ⅲ,所述造血干/祖细胞分化培养基ⅲ包含stemspan
™ꢀ
sfem ii、il-3、il-6、scf、tpo以及flt3。
139.在本技术中,所述方法中使用的培养基和所述培养基中,所述y27634浓度约为1-50μm。例如,所述y27632浓度约1μm、约3μm、约5μm、约8μm、约10μm、约15μm、约20μm、约25μm、约30μm、约35μm、约40μm、约45μm、约50μm。
140.在本技术中,所述方法中使用的培养基和所述培养基中,所述bmp4浓度约为5-100ng/ml。例如,所述bmp4浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
141.在本技术中,所述方法中使用的培养基和所述培养基中,所述vegf浓度约为5-100ng/ml。例如,所述vegf浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
142.在本技术中,所述方法中使用的培养基和所述培养基中,所述scf浓度约为5-100ng/ml。例如,所述scf浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
143.在本技术中,所述方法中使用的培养基和所述培养基中,所述il-3浓度约为5-100ng/ml。例如,所述il-3浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
144.在本技术中,所述方法中使用的培养基和所述培养基中,所述il-6浓度约为5-100ng/ml。例如,所述il-6浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
145.在本技术中,所述方法中使用的培养基和所述培养基中,所述tpo浓度约为5-100ng/ml。例如,所述tpo浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
146.在本技术中,所述方法中使用的培养基和所述培养基中,所述flt3浓度约为5-100ng/ml。例如,所述flt3浓度约5ng/ml、约10ng/ml、约15ng/ml、约20ng/ml、约25ng/ml、约30ng/ml、约35ng/ml、约40ng/ml、约45ng/ml、约50ng/ml、约55ng/ml、约60ng/ml、约65ng/ml、约70ng/ml、约75ng/ml、约80ng/ml、约85ng/ml、约90ng/ml、约95ng/ml、约100ng/ml。
147.在本技术中,其他分化培养基可以和本技术所述的培养基搭配使用,组成本技术所述的组合培养基。例如,不同的分化培养基可以用于不同的分化步骤。
148.组合物、用途另一方面,本技术提供一种组合物,其包含多能细胞,以及所述的培养基。
149.另一方面,本技术提供一种组合物,其包含造血干/祖细胞,以及所述的培养基。
150.另一方面,本技术提供一种组合物,其包含拟胚体(eb),以及所述的培养基。
151.另一方面,本技术还提供一种用于获得造血干/祖细胞的培养平台,其包含所述方法、培养基、组合物、培养平台。
152.另一方面,本技术还提供一种用于获得拟胚体(eb)的培养平台,其包含权所述方法、培养基、组合物、培养平台。
153.另一方面,本技术还提供所述方法、培养基、组合物、培养平台的应用。
154.例如,所述方法、培养基、组合物、培养平台的应用为诱导多能细胞增殖和/或分化造血干/祖细胞。例如,所述方法、培养基、组合物、培养平台的应用为增殖和/或分化和/或维持造血干/祖细胞。例如,所述方法、培养基、组合物、培养平台的应用为诱导多能细胞生成拟胚体(eb)。
155.另一方面,本技术还提供一种预防和/或治疗疾病的方法,其包含向有需要的受试者施用造血干/祖细胞,所述造血干/祖细胞通过所述方法、所述培养基、所述组合物、所述培养平台获得。
156.本技术还提供以下的实施方案:1. 一种诱导多能细胞向造血干/祖细胞增殖和/或分化的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
157.2. 一种增殖和/或分化和/或维持造血干/祖细胞的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
158.3. 一种诱导多能细胞生成拟胚体(eb)的方法,其包含使用含有mtesr和apel的造血干/祖细胞分化培养基。
159.4. 根据实施方案1-3中任一项所述的方法,所述mtesr和apel分别存在于不同造血干/祖细胞分化培养基中,需要分步使用。
160.5. 根据实施方案1-4中任一项所述的方法,所述造血干/祖细胞分化培养基还包含基础培养基,所述基础培养基包括imdm、mem、ham’s f12、、stemspan
™ꢀ
sfem ii、dmem以及rpmi1640中的一种或者多种。
161.6. 根据实施方案1-5中任一项所述的方法,所述造血干/祖细胞分化培养基还包
含选自下组的一种或多种:营养物、提取物、生长因子、激素、细胞因子以及培养基添加剂。
162.7. 根据实施方案1-6任一项所述的方法,所述方法中所述造血干/祖细胞分化培养基中包含选自以下组中的一种或者多种:rock抑制剂、bmp4(骨形态发生蛋白)、vegf(血管内皮细胞生长因子)、scf(干细胞因子)、il-3、il-6、tpo(血小板生成素)、以及flt3(fms相关酪氨酸激酶3配体)。
163.8. 根据实施方案7所述的方法,所述方法中所述rock抑制剂为y27634。
164.9. 根据实施方案8所述的方法,所述方法中所述y27634浓度约为1-50μm。
165.10. 根据实施方案7-9任一项所述的方法,所述方法中所述bmp4浓度约为5-100ng/ml。
166.11. 根据实施方案7-10任一项所述的方法,所述方法中所述vegf浓度约为5-100ng/ml。
167.12. 根据实施方案7-11任一项所述的方法,所述方法中所述scf浓度约为5-100ng/ml。
168.13. 根据实施方案7-12任一项所述的方法,所述方法中所述il-3浓度约为5-100ng/ml。
169.14. 根据实施方案7-13任一项所述的方法,所述方法中所述il-6浓度约为5-100ng/ml。
170.15. 根据实施方案7-14任一项所述的方法,所述方法中所述tpo浓度约为5-100ng/ml。
171.16. 根据实施方案7-15任一项所述的方法,所述方法中所述flt3浓度约为5-100ng/ml。
172.17. 根据实施方案1-16任一项所述的方法,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅰ,所述造血干/祖细胞分化培养基ⅰ包含mtesr以及rock抑制剂。
173.18. 根据实施方案1-17任一项所述的方法,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅱ,所述造血干/祖细胞分化培养基ⅱ包含apel、bmp4、vegf以及scf。
174.19. 根据实施方案1-18任一项所述的方法,所述方法中所述造血干/祖细胞分化培养基包含造血干/祖细胞分化培养基ⅲ,所述造血干/祖细胞分化培养基ⅲ包含stemspan
™ꢀ
sfem ii、il-3、il-6、scf、tpo以及flt3。
175.20. 根据实施方案1-19任一项所述的方法,所述方法在无血清条件下进行。
176.21. 根据实施方案1-20任一项所述的方法,所述方法在无滋养条件下进行。
177.22. 根据实施方案1-21任一项所述的方法,所述方法在约35-39℃条件下培养细胞。
178.23. 根据实施方案1-22任一项所述的方法,所述方法在约3-7%co2条件下培养细胞。
179.24. 根据实施方案1和实施方案4-23中任一项所述的方法,其中所述多能细胞是胚胎干细胞。
180.25. 根据实施方案1和实施方案4-23中任一项所述的方法,其中所述多能细胞是
诱导多能干细胞。
181.26. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞来源于多能细胞。
182.27. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞来源于胚胎干细胞。
183.28. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞来源于诱导多能干细胞。
184.29. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞来源于离体的人源血液。
185.30. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞来源于脐带血。
186.31. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞来源于骨髓。
187.32. 根据实施方案2和实施方案4-23中任一项所述的方法,其中所述造血干/祖细胞为cd34+造血干/祖细胞。
188.33. 根据实施方案1-32任一项所述的方法,所述方法包含将多能细胞接种于人工基底膜(matrigel)或玻连蛋白(vitronectin)预包被的培养皿或者细胞培养六孔板中。
189.34. 根据实施方案1-33任一项所述的方法,所述方法包含将增殖至一定数量的细胞用消化液处理。
190.35. 根据实施方案34所述的方法,所述方法中所述消化液为accutase。
191.36. 根据实施方案34所述的方法,所述方法中所述消化液为0.05% 胰蛋白酶(trypsin)+edta。
192.37. 根据实施方案1-36任一项所述的方法,所述方法包含将多能细胞培养为拟胚体(eb)。
193.38. 根据实施方案1-37任一项所述的方法,所述方法包含将多能细胞收集培养,经过两次沉降获得拟胚体(eb)。
194.39. 根据实施方案1-38任一项所述的方法,所述方法包含将拟胚体(eb)收集并消化,获得造血干/祖细胞。
195.40. 根据实施方案39所述的方法,所述方法中所述消化通过在拟胚体(eb)悬液中加入0.05% 胰蛋白酶(trypsin)+edta实现。
196.41. 根据实施方案1-40任一项所述的方法,所述方法包含以下步骤:(1) 将细胞接种于mtesr培养基中进行增殖培养,约4-7天;(2) 将细胞接种于造血干/祖细胞分化培养基ⅰ中,继续培养;(3) 将细胞接种于造血干/祖细胞分化培养基ⅱ中继续培养约6天,每3天将细胞收集后进行一次沉降并更换一次新鲜造血干/祖细胞分化培养基ii,沉降2次;(4) 收集沉降后获得的拟胚体(eb),使用0.05% 胰蛋白酶(trypsin)+edta消化,10% fbs终止消化,400g离心5min;(5) 去除上清悬液,使用造血干/祖细胞分化培养基ⅲ重悬细胞,获得造血干/祖细胞。
197.42. 培养基,其包含mtesr以及apel。
198.43. 根据实施方案42所述的培养基,所述mtesr和apel分别存在于不同造血干/祖细胞分化培养基中,需要分步使用。
199.44. 根据实施方案42-43任一项所述的培养基,所述培养基还包含基础培养基,所述基础培养基包括imdm、mem、ham’s f12、、stemspan
™ꢀ
sfem ii、dmem以及rpmi1640中的一种或者多种。
200.45. 根据实施方案42-44任一项所述的培养基,所述培养基还包含选自下组的一种或多种:营养物、提取物、生长因子、激素、细胞因子以及培养基添加剂。
201.46. 根据实施方案42-45任一项所述的培养基,所述培养基还包含选自下组中的一种或者多种:rock抑制剂、bmp4(骨形态发生蛋白)、vegf(血管内皮细胞生长因子)、scf(干细胞因子)、il-3、il-6、tpo(血小板生成素)、以及flt3(fms相关酪氨酸激酶3配体)。
202.47. 根据实施方案42-46任一项所述的培养基,所述培养基中包含rock抑制剂。
203.48. 根据实施方案46-47任一项所述的培养基,所述培养基中所述rock抑制剂为y27634。
204.49. 根据实施方案48所述的培养基,所述培养基中所述y27634浓度约为1-50μm。
205.50. 根据实施方案46-49任一项所述的培养基,所述培养基中所述bmp4浓度约为5-100ng/ml。
206.51. 根据实施方案46-50任一项所述的培养基,所述培养基中所述vegf浓度约为5-100ng/ml。
207.52. 根据实施方案46-51任一项所述的培养基,所述培养基中所述scf浓度约为5-100ng/ml。
208.53. 根据实施方案46-52任一项所述的培养基,所述培养基中所述il-3浓度约为5-100ng/ml。
209.54. 根据实施方案46-53任一项所述的培养基,所述培养基中所述il-6浓度约为5-100ng/ml。
210.55. 根据实施方案46-54任一项所述的培养基,所述培养基中所述tpo浓度约为5-100ng/ml。
211.56. 根据实施方案46-55任一项所述的培养基,所述培养基中所述flt3浓度约为5-100ng/ml。
212.57. 根据实施方案42-56任一项所述的培养基,所述培养基中包含造血干/祖细胞分化培养基ⅰ,所述造血干/祖细胞分化培养基ⅰ包含mtesr以及rock抑制剂。
213.58. 根据实施方案42-57任一项所述的培养基,所述培养基中包含造血干/祖细胞分化培养基ⅱ,所述造血干/祖细胞分化培养基ⅱ包含apel、bmp4、vegf以及scf。
214.59. 根据实施方案42-58任一项所述的培养基,所述培养基中包含造血干/祖细胞分化培养基ⅲ,所述造血干/祖细胞分化培养基ⅲ包含stemspan
™ꢀ
sfem ii、il-3、il-6、scf、tpo以及flt3。
215.60. 根据实施方案42-59任一项所述的培养基,所述培养基不含血清。
216.61. 组合物,其包含多能细胞,以及实施方案42-60任一项所述的培养基。
217.62. 组合物,其包含造血干/祖细胞,以及实施方案42-60任一项所述的培养基。
218.63. 组合物,其包含拟胚体(eb),以及实施方案42-60任一项所述的培养基。
219.64. 一种用于获得造血干/祖细胞的培养平台,其包含实施方案1-41中任一项所述的方法、实施方案42-60中任一项所述的培养基、实施方案61-63中任一项所述的组合物。
220.65. 一种用于获得拟胚体(eb)的培养平台,其包含实施方案1-41中任一项所述的方法、实施方案42-60中任一项所述的培养基、实施方案61-63中任一项所述的组合物。
221.66. 实施方案1-41任一项所述的方法、实施方案42-60任一项所述的培养基、实施方案61-63任一项所述的组合物、实施方案64-65任一项所述的培养平台,在诱导多能细胞增殖和/或分化造血干/祖细胞中的应用。
222.67. 实施方案1-41任一项所述的方法、实施方案42-60任一项所述的培养基、实施方案61-63任一项所述的组合物、实施方案64-65任一项所述的培养平台,在增殖和/或分化和/或维持造血干/祖细胞中的应用。
223.68. 实施方案1-41任一项所述的方法、实施方案42-60任一项所述的培养基、实施方案61-63任一项所述的组合物、实施方案64-65任一项所述的培养平台,在诱导多能细胞生成拟胚体(eb)中的应用。
224.69. 实施方案1-41任一项所述的方法、实施方案42-60任一项所述的培养基、实施方案61-63任一项所述的组合物、实施方案64-65任一项所述的培养平台,其用于预防和/或治疗疾病。
225.70. 一种预防和/或治疗疾病的方法,其包含向有需要的受试者施用造血干/祖细胞,所述造血干/祖细胞通过使用实施方案1-41任一项所述的方法、实施方案42-60任一项所述的培养基、实施方案61-63任一项所述的组合物、实施方案64-65任一项所述的培养平台获得。
226.不欲被任何理论所限,下文中的实施例仅仅是为了阐释本技术发明的各个技术方案,而不用于限制本技术发明的范围。
实施例
227.实施例1 造血干/祖细胞的分化培养使用如下方法和培养基对细胞进行培养:(1) esc/ipsc接种于人工基底膜(matrigel)或玻连蛋白(vitronectin)预包被的培养皿或者细胞培养六孔板中(每10cm培养皿接种1
×
106个细胞或6孔板每孔2
×
105个细胞),用mtesr培养基在37℃,5% co2条件培养至细胞饱和度约70-80%,通常需要约4-7天;(2) 吸去培养上清,加入预热至37℃的dpbs缓冲液洗一次;(3) 用accutase消化液37℃消化细胞,约5min,用预热的dpbs将细胞重悬收集;(4) 将细胞重悬液300g离心5min,弃上清,用造血干/祖细胞分化培养基i重悬后,接种至悬浮培养6孔板中培养(6孔板每孔3
×
105个细胞),在37℃,5% co2条件培养,记为day0;(5) 在第一天,收集细胞悬液,300g离心5min,除去上清后,用造血干/祖细胞分化培养基ii,在37℃,5% co2条件培养细胞;(6) 在第一天-第六天,持续培养细胞,每3天将细胞收集后进行一次沉降,并更换一次新鲜的造血干/祖细胞分化培养基ii,共计沉降2次,获得eb,每次沉降后,通过流式细
胞分析细胞标志物表型;(7) 在第七天,将获得的eb悬液收集,400g离心5min,去掉上清,用1ml提前预热好的0.05% 胰蛋白酶(trypsin)+edta,置于37℃水浴锅消化5min,后加入1ml 10%fbs终止消化,400g离心5min;(8) 将细胞悬液上清去除,用造血干/祖细胞分化培养基ⅲ重悬细胞,即获得造血干/祖细胞,通过流式细胞分析细胞表面标志物,检测细胞纯度;(9) 造血干/祖细胞分化培养基i:包含mtesr培养基,以及rock抑制剂(y27632);(10) 造血干/祖细胞分化培养基ii:包含apel培养基,还包含浓度约为5-100ng/ml的bmp4,浓度约为5-100ng/ml的vegf,浓度约为5-100ng/ml的scf;(11) 造血干/祖细胞分化培养基ⅲ:包含stemspan
™ꢀ
sfem ii,还包含浓度约为5-100ng/ml的il-3、浓度约为5-100ng/ml的il-6、浓度约为5-100ng/ml的scf、浓度约为5-100ng/ml的tpo和浓度约为5-100ng/ml的flt。
228.使用流式细胞检测造血干/祖细胞的生成,ssc和fsc是流式细胞检测中的常用参数,ssc表示侧向散射光,反应细胞复杂程度,fsc表示前向散射光,反应细胞大小,横纵坐标数值表示光的强度,用二者结合得到细胞状态。
229.实验过程中,首先通过流式分选所有样品,得到大小合适的活细胞,标注为p1(图1a、图2a、图3a),然后将p1中分选得到的细胞作为样品p2进一步分析(图1b、图2b、图3b),在p2中分析时,使用细胞染料bv421区分活细胞,活细胞标注为p3,最后,将p3中的活细胞样品用标记荧光染料的抗体cd34 apc-cy7进行标记和分析,得到cd34+的造血干/祖细胞,标注为p4(图1c、图2c、图3c)。
230.第一次拟胚体沉降后,流式细胞结果如图1a-图1c所示,图1a表示圈选的大小合适的活细胞占19.64%,图1b表示活细胞比率为97.02%,图1c表示活细胞中cd34+的造血干/祖细胞占35.29%。
231.第二次拟胚体沉降后,流式细胞结果如图2a-图2c所示,图2a表示圈选的大小合适的活细胞占57.21%,图2b表示活细胞比率为97.77%,图2c表示活细胞中cd34+的造血干/祖细胞占97.76%。
232.使用imdm培养基代替mtesr培养基和apel培养基,第二次拟胚体沉降后,流式细胞结果如图3a-图3c所示,图3a表示圈选的大小合适的活细胞占46.10%,图3b表示活细胞比率为98.98%,图3c表示活细胞中cd34+的造血干/祖细胞占34.04%。
233.以上结果说明使用含有mtesr和apel的造血干/祖细胞分化培养基,结合拟胚体二次沉降的方法,可以促进造血干/祖细胞的增殖和/或分化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1