一种布瑞诺龙的制备方法与流程
1.本发明属于药物领域,具体涉及一种布瑞诺龙的制备方法。
背景技术:
2.布瑞诺龙(brexanolone,商品名为zulresso),分子式为c
21h34
o2,分子量为318.5,化学名为3α-羟基-5α-孕甾烷-20-酮,化学式如式i所示,是一种天然的内源性孕烷神经类固醇,为一种突触和外突触γ-氨基丁酸a型(gamma-aminobutyricacid type a, gabaa)受体阳性变构调节剂,并于2019年3月19日获准上市,为第一款获得fda批准用于治疗产后抑郁症(postpartumdepression, ppd)的药物。
3.相关现有技术中,利用单烯醇酮酸酯为起始物料利用发酵法制备布瑞诺龙,该法发酵后提取困难,操作复杂,不利于工业化操作。采用孕烯醇酮为起始物料,经过还原,反转构型,上保护基,两次脱保护基制得布瑞诺龙,该法步骤长,需要五步反应,且脱保护基时使用强碱高温条件,易产生手性杂质,操作复杂,不利于工业化生产。
4.可见,现有技术中关于布瑞诺龙的制备方法操作复杂,不利于工业化生产。因此,迫切需要提供一种操作简单、能够适应工业化生产的布瑞诺龙的制备方法。
技术实现要素:
5.针对现有技术中存在的上述不足,本发明的目的在于提供一种布瑞诺龙的制备方法,该方法操作简单,反应条件温和,制备得到的布瑞诺龙纯度高、收率高,能够更适应工业化生产。
6.为实现上述发明目的,本发明采用的技术方案如下:本发明提供了一种布瑞诺龙的制备方法,包括如下步骤:中间体ⅲ的合成:
化合物ⅱ与还原剂在催化剂作用下于第一反应溶剂中进行还原反应,得到中间体ⅲ;中间体ⅳ的合成:中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反应,得到中间体ⅳ;化合物ⅰ的合成:中间体ⅳ与酸于第三反应溶剂中进行反应,得到化合物ⅰ。
7.优选的是,在中间体ⅲ的合成的步骤中,还原剂为氢气;催化剂包括钯碳、雷尼镍中的至少一种;第一反应溶剂包括甲醇、乙醇、四氢呋喃、二氧六环中的至少一种;反应温度为25℃~35℃。
8.上述任一方案中优选的是,在中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反应,得到中间体ⅳ的步骤中,偶氮类化合物包括偶氮二甲酸二异丙酯、偶氮二羧酸二乙酯中的至少一种;第二反应溶剂包括四氢呋喃、二氯甲烷、乙腈、二氧六环、甲苯、二甲基亚砜中的至少一种;反应温度为30℃~50℃。
9.上述任一方案中优选的是,在中间体ⅳ与酸于第三反应溶剂中进行反应,得到化合物ⅰ的步骤中,酸包括盐酸、氢溴酸、乙酸中的至少一种;第三反应溶剂包括甲醇、乙醇、n,n-二甲基甲酰胺中的至少一种;反应温度为25℃~40℃。
10.上述任一方案中优选的是,在中间体ⅲ的合成的步骤中,反应结束后,对反应液进行第一后处理,得到中间体ⅲ,其中,第一后处理为过滤,对滤液减压浓缩,加入析晶溶剂进行析晶,干燥;析晶溶剂为水。
11.上述任一方案中优选的是,在中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反应,得到中间体ⅳ的步骤中,反应结束后,对反应液进行第二后处理,得到中间体ⅳ,其中,第二后处理为向反应液中加入氯化钠溶液,分液,水相用第一有机溶剂萃取,合并有机相,然后再用饱和食盐水洗涤,减压浓缩,打浆,过滤,干燥;第一有机溶剂为四氢呋喃;打浆采用的溶剂为正庚烷。
12.上述任一方案中优选的是,在中间体ⅳ与酸于第三反应溶剂中进行反应,得到化合物ⅰ的步骤中,反应结束后,对反应液进行第三后处理,得到化合物ⅰ,其中,第三后处理为减压浓缩,加入水,用第二有机溶剂萃取两次,合并有机相,水洗,再减压浓缩,打浆,过滤,干燥;第二有机溶剂为二氯甲烷;打浆采用的溶剂为正庚烷。
13.上述任一方案中优选的是,盐酸的浓度为1~3mol/l。
14.上述任一方案中优选的是,在中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反应,得到中间体ⅳ的步骤中,氯甲酸苄酯与中间体ⅲ的摩尔比为(1~2):1。
15.上述任一方案中优选的是,在中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反应,得到中间体ⅳ的步骤中,三苯基膦与中间体ⅲ的摩尔比为(1~2):1。
16.本发明提供的布瑞诺龙的制备方法中,首先,以化合物ⅱ与还原剂在催化剂作用下于第一反应溶剂中进行还原反应,得到中间体ⅲ,然后,中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反转构型反应,得到中间体ⅳ,最后,中间
体ⅳ与酸于第三反应溶剂中进行脱保护反应,得到化合物ⅰ。该制备方法操作简单,反应条件温和,制备得到的布瑞诺龙纯度高、收率高,能够适应工业化生产。
附图说明
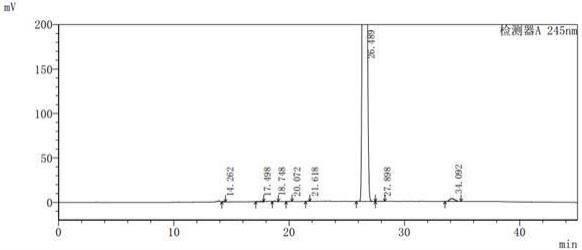
17.图1为本发明实施例1制得的布瑞诺龙的高效液相色谱谱图;图2为本发明实施例1制得的布瑞诺龙的高效液相色谱谱图的峰表。
具体实施方式
18.为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
19.除另有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的实验试剂,如无特殊说明,均为常规生化试剂;所述实验试剂用量,如无特殊说明,均为常规实验操作中试剂用量;所述实验方法,如无特殊说明,均为常规方法。
20.本发明实施例提供了一种布瑞诺龙的制备方法,包括如下步骤:s1、中间体ⅲ的合成:化合物ⅱ(孕烯醇酮)与还原剂在催化剂作用下于第一反应溶剂中进行还原反应,得到中间体ⅲ;s2、中间体ⅳ的合成:中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反应,得到中间体ⅳ;s3、化合物ⅰ的合成:中间体ⅳ与酸于第三反应溶剂中进行反应,得到化合物ⅰ。
21.氯甲酸苄酯的结构为:
。
22.cbz的结构为:。
23.本发明实施例提供的布瑞诺龙的制备方法中,首先,以化合物ⅱ与还原剂在催化剂作用下于第一反应溶剂中进行还原反应,得到中间体ⅲ,然后,中间体ⅲ与氯甲酸苄酯在三苯基膦和偶氮类化合物作用下于第二反应溶剂中进行反转构型反应,得到中间体ⅳ,最后,中间体ⅳ与酸于第三反应溶剂中进行脱保护反应,得到化合物ⅰ。该制备方法路线短,操作简单,反应条件温和,易控制,制备得到的布瑞诺龙纯度高、收率高,产生的三废少,能够适应工业化生产。
24.进一步地,在步骤s1中,还原剂为氢气。
25.进一步地,在步骤s1中,催化剂包括钯碳、雷尼镍中的至少一种。
26.进一步地,在步骤s1中,第一反应溶剂包括甲醇、乙醇、四氢呋喃、二氧六环中的至少一种。
27.进一步地,在步骤s1中,反应温度为25℃~35℃,例如反应温度可以为25℃、27℃、29℃、31℃、33℃或35℃等。
28.进一步地,在步骤s2中,偶氮类化合物包括偶氮二甲酸二异丙酯(diad)、偶氮二羧酸二乙酯(dead)中的至少一种。
29.进一步地,在步骤s2中,第二反应溶剂包括四氢呋喃、二氯甲烷、乙腈、二氧六环、甲苯、二甲基亚砜中的至少一种,优选地,第二反应溶剂为四氢呋喃。
30.进一步地,在步骤s2中,反应温度为30℃~50℃,例如,反应温度可以为30℃、32℃、34℃、36℃、38℃、40℃、42℃、45℃或50℃等。
31.进一步地,在步骤s3中,酸包括盐酸、氢溴酸、乙酸中的至少一种。
32.进一步地,在步骤s3中,第三反应溶剂包括甲醇、乙醇、n,n-二甲基甲酰胺中的至少一种。
33.进一步地,在步骤s3中,反应温度为25℃~40℃,例如反应温度可以为25℃、27℃、29℃、31℃、33℃、35℃、37℃或40℃等,反应温度过高,容易导致副反应发生,反应体系中杂质增多,导致后处理困难,降低产物的收率和纯度。
34.进一步地,在步骤s1中,反应结束后,对反应液进行第一后处理,得到中间体ⅲ,其中,第一后处理为过滤,对滤液减压浓缩,加入析晶溶剂进行析晶,干燥;析晶溶剂为水。
35.进一步地,在步骤s2中,反应结束后,对反应液进行第二后处理,得到中间体ⅳ,其中,第二后处理为向反应液中加入氯化钠溶液,分液,水相用第一有机溶剂萃取,合并有机相,然后再用饱和食盐水洗涤,减压浓缩,打浆,过滤,干燥;第一有机溶剂为四氢呋喃;打浆
采用的溶剂为正庚烷。
36.进一步地,在步骤s3中,反应结束后,对反应液进行第三后处理,得到化合物ⅰ,其中,第三后处理为减压浓缩,加入水,用第二有机溶剂萃取两次,合并有机相,水洗,再减压浓缩,打浆,过滤,干燥;第二有机溶剂为二氯甲烷;打浆采用的溶剂为正庚烷。
37.进一步地,盐酸的浓度为1~3mol/l,例如盐酸的浓度可以为1mol/l、1.5mol/l、2mol/l、2.5mol/l或3mol/l等,如果盐酸浓度过大,酸性过强,容易使反应体系中杂质增多,导致后处理困难,降低产物的纯度。
38.进一步地,在步骤s2中,氯甲酸苄酯与中间体ⅲ的摩尔比为(1~2):1,例如,氯甲酸苄酯与中间体ⅲ的摩尔比可以为1:1、1.2:1、1.4:1、1.6:1、1.8:1或2:1等。
39.进一步地,在步骤s2中,三苯基膦与中间体ⅲ的摩尔比为(1~2):1,例如,三苯基膦与中间体ⅲ的摩尔比可以为1:1、1.2:1、1.4:1、1.6:1、1.8:1或2:1等。
40.本发明先后进行过多次试验,现举一部分试验结果作为参考,对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
41.本发明实施例所述“室温”具有本领域公知的含义,一般是指25~28℃。
42.化合物ⅰ(布瑞诺龙)的合成路线如下:实施例1s1、中间体ⅲ的合成:将化合物ⅱ(孕烯醇酮,100g)加入到甲醇(500ml)中,加入10%钯碳(1g),用氢气置换空气两次,之后通入氢气加压至6bar,升温至30℃反应,tlc监测反应,反应完毕后降至室温,过滤,收集滤液,减压浓缩除去1/2甲醇(被除去的甲醇的体积是甲醇原体积的二分之一),之后加入水(1l),搅拌析晶3h,过滤,干燥,得到91.2g中间体ⅲ,收率为90.6%,中间体ⅲ为白色固体,hplc纯度为97.84%。
43.s2、中间体ⅳ的合成:将中间体ⅲ(91.2g)加入到四氢呋喃(900ml)中搅拌溶解,之后加入氯甲酸苄酯(54.3g)和三苯基膦(100.9g),滴加偶氮二甲酸二异丙酯(15.3ml),控制反应温度为40℃,反应2小时,tlc监测反应,反应完毕后,加入10%氯化钠溶液500ml搅拌30min,分液,水相用
300ml四氢呋喃萃取一次,合并有机相,有机相用饱和食盐水(400ml)洗涤一次,之后减压浓缩除去四氢呋喃,加入正庚烷(1000ml)打浆,过滤,干燥,得到114.0g中间体ⅳ,收率为88.1%,中间体ⅳ为白色固体,hplc纯度为98.45%。
44.s3、化合物ⅰ的合成:将中间体ⅳ(110g)加入反应瓶中,加入甲醇(1500ml),搅拌,之后加入盐酸(2mol/l,225ml),室温下反应,tlc监测反应,反应完毕后,减压浓缩除去2/3甲醇,之后加入水(2000ml),用二氯甲烷萃取两次,每次萃取所用的二氯甲烷的体积为800ml,合并有机相,之后有机相水洗(500ml*1),减压浓缩,加入正庚烷(1500ml)打浆,过滤,干燥,得到69.7g类白色化合物ⅰ(布瑞诺龙),收率为90.0%,hplc纯度为99.41%。
45.对化合物ⅰ结构进行鉴定:质谱数据:esi-ms(m/z)=319.5[m+h]
+
,本品分子量为318.5,与本化合物分子量相符。
[0046]
化合物ⅰ的纯度检测:色谱条件:色谱柱:十八烷基硅烷键合硅胶为填充剂的色谱柱(glsciences inertsil ods-3,4.6mm
×
250mm,5
µ
m或效能相当的色谱柱);以0.01mol/l磷酸盐缓冲液(取磷酸二氢钾1.36g,加水1000ml使溶解,用磷酸调节ph值至2.8)为流动相a,乙腈为流动相b,甲醇为流动相c,按下表1进行梯度洗脱;流速为每分钟1.0ml;柱温为35℃;检测波长为245nm;进样体积10
µ
l。
[0047]
表1将化合物ⅰ溶解于乙腈中,配制成供试品溶液,按照上述色谱条件对供试品溶液进行测定,化合物ⅰ的高效液相色谱图及峰表如图1和图2所示,由检测结果可知化合物ⅰ的纯度为99.41% (2020版中国药典方法,按hplc峰面积归一法计)。
[0048]
实施例2s1、中间体ⅲ的合成:将化合物ⅱ(孕烯醇酮,100g)加入到乙醇(500ml)中,加入10%钯碳(1g),用氢气置换空气两次,之后通入氢气加压至6bar,升温至30℃反应,tlc监测反应,反应完毕后降至室温,过滤,收集滤液,减压浓缩除去1/2乙醇(被除去的乙醇的体积是乙醇原体积的二分之一),之后加入水(1l),搅拌析晶3h,过滤,干燥,得到88.9g中间体ⅲ,收率为88.3%,中间体ⅲ为白色固体,hplc纯度为97.93%。
[0049]
s2、中间体ⅳ的合成:
将中间体ⅲ(88.9g)加入到四氢呋喃(900ml)中搅拌溶解,之后加入氯甲酸苄酯(54.3g)和三苯基膦(100.9g),滴加偶氮二甲酸二异丙酯(15.3ml),控制反应温度为30℃,反应2小时,tlc监测反应,反应完毕后,加入10%氯化钠溶液500ml搅拌30min,分液,水相用300ml四氢呋喃萃取一次,合并有机相,有机相用饱和食盐水(400ml)洗涤一次,之后减压浓缩除去四氢呋喃,加入正庚烷(1000ml)打浆,过滤,干燥,得到108.7g中间体ⅳ,收率为86.1%,中间体ⅳ为白色固体,hplc纯度为98.12%。
[0050]
s3、化合物ⅰ的合成:将中间体ⅳ(108g)加入反应瓶中,加入乙醇(1500ml),搅拌,之后加入盐酸(2mol/l,220ml),室温下反应,tlc监测反应,反应完毕后,减压浓缩除去2/3乙醇,之后加入水(2000ml),用二氯甲烷萃取两次,每次萃取所用的二氯甲烷的体积为800ml,合并有机相,之后有机相水洗(500ml*1),减压浓缩,加入正庚烷(1500ml)打浆,过滤,干燥,得到67.6g化合物ⅰ(布瑞诺龙),收率为89.0%,hplc纯度为99.81%。
[0051]
实施例3s1、中间体ⅲ的合成:将化合物ⅱ(孕烯醇酮,100g)加入到甲醇(500ml)中,加入10%钯碳(1g),用氢气置换空气两次,之后通入氢气加压至6bar,升温至35℃反应,tlc监测反应,反应完毕后降至室温,过滤,收集滤液,减压浓缩除去1/2甲醇(被除去的甲醇的体积是甲醇原体积的二分之一),之后加入水(1l),搅拌析晶3h,过滤,干燥,得到87.7g中间体ⅲ,收率为87.1%,中间体ⅲ为白色固体,hplc纯度为97.81%。
[0052]
s2、中间体ⅳ的合成:将中间体ⅲ(87.7g)加入到四氢呋喃(900ml)中搅拌溶解,之后加入氯甲酸苄酯(54.3g)和三苯基膦(100.9g),滴加偶氮二甲酸二异丙酯(15.3ml),控制反应温度为50℃,反应2小时,tlc监测反应,反应完毕后,加入10%氯化钠溶液500ml搅拌30min,分液,水相用300ml四氢呋喃萃取一次,合并有机相,有机相用饱和食盐水(400ml)洗涤一次,之后减压浓缩除去四氢呋喃,加入正庚烷(1000ml)打浆,过滤,干燥,得到106.2g中间体ⅳ,收率为85.2%,中间体ⅳ为白色固体,hplc纯度为98.19%。
[0053]
s3、化合物ⅰ的合成:将中间体ⅳ(106.2g)加入反应瓶中,加入甲醇(1500ml),搅拌,之后加入盐酸(2mol/l,220ml),在40℃下反应,tlc监测反应,反应完毕后,减压浓缩除去2/3甲醇,之后加入水(2000ml),用二氯甲烷萃取两次,每次萃取所用的二氯甲烷的体积为800ml,合并有机相,之后有机相水洗(500ml*1),减压浓缩,加入正庚烷(1500ml)打浆,过滤,干燥,得到64.6g化合物ⅰ(布瑞诺龙),收率为86.5%,hplc纯度为99.67%。
[0054]
对比例1步骤s1与实施例1中的步骤s1完全相同。
[0055]
步骤s2与实施例1中的步骤s2完全相同。
[0056]
s3、化合物ⅰ的合成:将中间体ⅳ(110g)加入反应瓶中,加入甲醇(1500ml),搅拌,之后加入盐酸(2mol/l,225ml),在60℃下反应,tlc监测反应,反应完毕后,减压浓缩除去2/3甲醇,之后加入水(2000ml),用二氯甲烷萃取两次,每次萃取所用的二氯甲烷的体积为800ml,合并有机相,之
后有机相水洗(500ml*1),减压浓缩,加入正庚烷(1500ml)打浆,过滤,干燥,得到56.0g化合物ⅰ(布瑞诺龙),收率为72.4%,hplc纯度为97.91%。
[0057]
对比例2化合物ⅰ(布瑞诺龙)的合成路线如下:s1、中间体
ⅴ
的合成:将中间体ⅲ(91.2g)、三苯基膦(100.9g)和邻甲氧基苯甲酸(85.2g)加入四氢呋喃(900ml)中,缓慢滴加偶氮二甲酸二异丙酯(15.3ml),控制反应温度为40℃,反应2小时,tlc监测反应,反应完毕后,加入10%氯化钠溶液500ml搅拌30min,分液,水相用300ml四氢呋喃萃取一次,合并有机相,有机相用饱和食盐水(400ml)洗涤一次,之后减压浓缩除去四氢呋喃,加入正庚烷(1000ml)打浆,过滤,干燥,得到中间体
ⅴ
。
[0058]
s2、化合物ⅰ的合成:将步骤s1得到的中间体
ⅴ
全部加入反应瓶中,加入甲醇(1500ml),搅拌,之后加入氢氧化钠(22.4g),在60℃下反应,tlc监测反应,反应完毕后,减压浓缩除去2/3甲醇,之后加入水(2000ml),用二氯甲烷萃取两次,每次萃取所用的二氯甲烷的体积为800ml,合并有机相,之后有机相水洗(500ml*1),减压浓缩,加入正庚烷(1500ml)打浆,过滤,干燥,得到41.2g化合物ⅰ,两步反应总收率为45.2%,hplc纯度为97.23%。
[0059]
对比例3步骤s1与实施例1中的步骤s1完全相同。
[0060]
s2、中间体ⅳ的合成:将中间体ⅲ(91.2g)加入到甲苯(900ml)中搅拌溶解,之后加入氯甲酸苄酯(54.3g)和三苯基膦(100.9g),滴加偶氮二甲酸二异丙酯(15.3ml),控制反应温度为40℃,反应2小时,tlc监测反应,反应完毕后,加入10%氯化钠溶液500ml搅拌30min,分液,水相用300ml四氢呋喃萃取一次,合并有机相,有机相用饱和食盐水(400ml)洗涤一次,之后减压浓缩除去有机溶剂,加入正庚烷(1000ml)打浆,过滤,干燥,得到81.7g中间体ⅳ,收率为63.0%,中间体ⅳ为白色固体,hplc纯度为98.29%。
[0061]
步骤s3与实施例1中的步骤s3完全相同。
[0062]
对比例4步骤s1与实施例1中的步骤s1完全相同。
[0063]
步骤s2与实施例1中的步骤s2完全相同。
[0064]
s3、化合物ⅰ的合成:与实施例1中的步骤s3基本相同,不同的是,将2mol/l的盐酸替换为浓盐酸,盐酸的总物质的量不变,产物化合物ⅰ的收率为85%,hplc纯度为97.84%。
[0065]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1