一种右美沙芬的制备方法与流程
本发明涉及吗啡喃环合成,尤其涉及一种右美沙芬的制备方法。
背景技术:
1、右美沙芬(3-甲氧基-n-甲基吗啡喃)简称dxm,是一种镇咳药物,为吗啡类左吗喃甲基醚的右旋体。可在140多种非处方咳嗽和冷制剂中获得。由于其定向剂量的可用性,功效和安全性,已经超越可待因成为最广泛使用的镇咳剂。
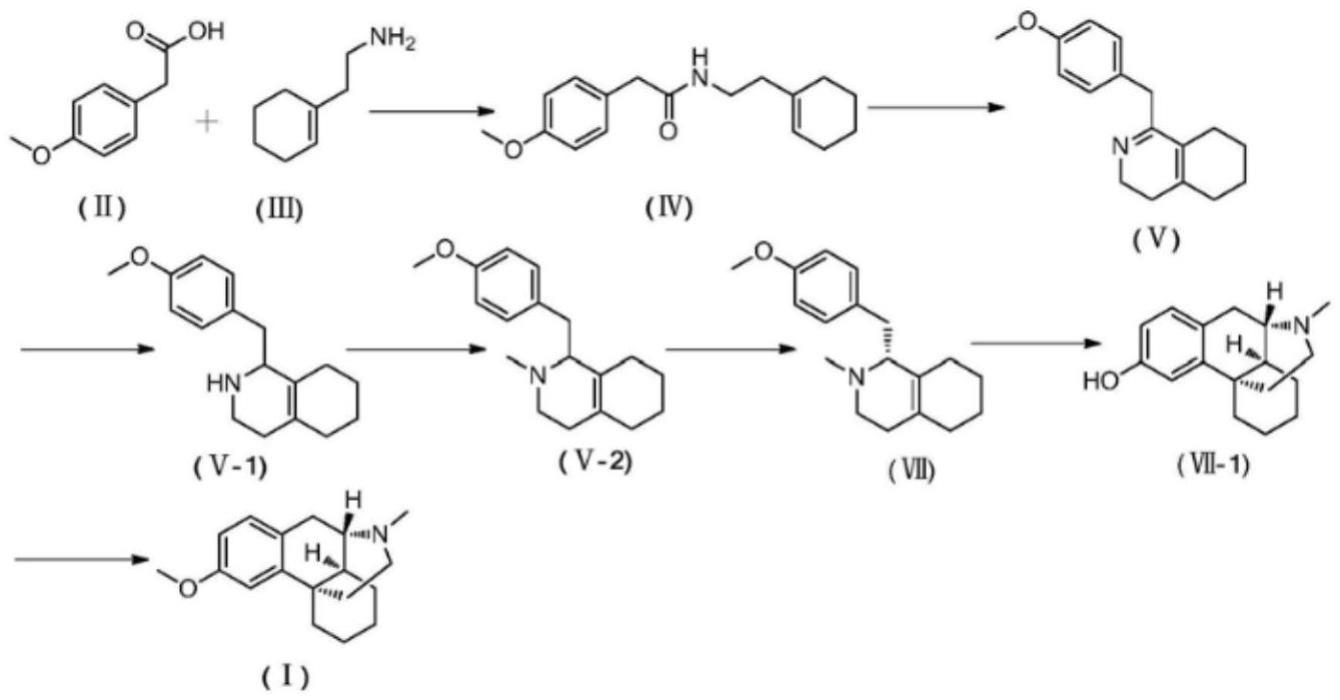
2、目前,右美沙芬的合成方法多采用拆分和grewe环化的方法进行。比如:以2-(1-环己烯基)乙胺ⅲ与对甲氧基苯乙酸ⅱ为原料,先脱水缩合形成酰胺中间体ⅳ,在pocl3作用下经过bishler-napierdsky环合后生成六氢异喹啉中间体ⅴ,该化合物不稳定,直接用raney-ni催化氢化得到1-对甲氧基苄基-1,2,3,4,5,6,7,8-八氢异喹啉ⅴ-1,甲基化后得到n-甲基化合物ⅴ-2,该产物有一个手性中心,经过拆分得到(s)-1-(对甲氧基苄基)-1,2,3,4,5,6,7,8-八氢异喹啉ⅶ,然后在h3po4催化下经过grewe环化得到中间体ⅶ-1,经进一步甲基化得到产物右美沙芬。该方法的合成路线如下:
3、
4、该方法具有以下缺点:
5、(1)在grewe环化反应过程中,中间体ⅶ受空间位阻影响,会伴有副产物3-甲氧基-17乙酰基-(9α,13α,14β)-吗啡喃的生成;并且grewe环化反应产率较低;该反应在130-140℃下反应,环化后苯环上甲氧基会转变为相应的羟基,还需进一步甲基化处理,且高温下其他副反应较多。
6、(2)拆分中间体ⅴ-2不仅大大降低收率,并且操作复杂繁琐,产生大量废渣废液。
7、(3)该工艺路线中使用了三氯氧磷、浓磷酸等试剂,三废较多,对环境不友好。
技术实现思路
1、针对现有技术中所存在的不足,本发明提供了一种右美沙芬的制备方法,其解决了现有技术中存在的中间体拆分导致收率低问题。
2、本发明目的是提供一种右美沙芬的制备方法,包括以环己二酮1为原料,经过乙腈基取代反应,得到化合物2;将化合物2进行维兰德-米歇尔酮合成反应,得到化合物4;将化合物4进行缩酮保护,得到化合物5;将化合物5进行robinson增环反应,得到化合物6;将化合物6进行芳构化反应和甲基化反应,得到化合物7;将化合物7进行酮基脱保护,得到化合物8;将化合物8进行双键异构化反应,得到化合物9;将化合物9进行乙腈基还原反应,得到化合物10;将化合物10进行内酰胺环化反应,得到化合物11;将化合物11进行不对称性氢化反应得到化合物12;将化合物12进行n-甲基化反应,得到右美沙芬,其反应过程如下所示:
3、
4、进一步地,包括以下步骤:
5、s1:在第一碱存在下,将环己二酮与溴乙腈在第一溶剂中发生亲核取代反应,生成化合物2;
6、s2:化合物2与丁烯酮在第一催化剂作用下发生michael加成反应,生成化合物3;
7、s3:化合物3在第二催化剂和第一添加剂作用下进行不对称robinson环化反应,生成化合物4;
8、s4:在第二溶剂中,化合物4和乙二醇在第三催化剂和第二添加剂作用下进行缩酮化反应,生成化合物5;
9、s5:在第三溶剂中,化合物5依次与四氢吡咯、丁烯酮进行反应,之后在酸性条件下进行回流环化反应,生成化合物6;
10、s6:在第四溶剂中,化合物6在第四催化剂作用下发生芳构化反应,之后在第二碱存在下发生甲基化反应,生成化合物7;
11、s7:在第五溶剂中,化合物7在酸作用下发生水解反应,生成化合物8;
12、s8:在第六溶剂中,化合物8与叔丁醇碱金属盐进行异构化反应,生成化合物9;
13、s9:化合物9在第五催化剂、酰化剂、还原剂作用下,发生氰基还原、伯胺乙酰化、羰基还原和乙酰基脱除,得到化合物10;
14、s10:在第七溶剂中,化合物10在溴作用下发生环化反应,之后在第三碱存在下,发生脱卤化氢反应,得到化合物11;
15、s11:在第八溶剂中,化合物11在第六催化剂下与供氢体发生立体选择性氢化反应,得到化合物12;
16、s12:化合物12在在甲酸和甲醛作用下,发生eschweiler-clarke甲基化反应,得到右美沙芬。
17、进一步地,所述第一碱为季铵碱,优选地,所述第一碱为苄基三甲基氢氧化铵,所述第二碱为碳酸钾,所述第三碱为碳酸钠。
18、进一步地,所述第一溶剂为甲醇和水,所述第二溶剂为二氯甲烷,所述第三溶剂为甲苯,所述第四溶剂为乙腈,所述第五溶剂为二氯甲烷和水的混合溶液,所述第六溶剂为叔丁醇,第七溶剂为二氯甲烷,第八溶剂为甲醇。
19、进一步地,所述第一催化剂为三乙胺;所述第二催化剂为(s)-n1,n1-二乙基-3,3-二甲基-1,2-丁二胺和三氟甲磺酸;所述第三催化剂为三氟甲磺酸三甲基硅酯,所述第四催化剂为溴化酮,所述第五催化剂为raney ni,第六催化剂为氢氧化钯。
20、进一步地,所述第一添加剂为间硝基苯甲酸;所述第二添加剂为原甲酸三乙酯。
21、进一步地,所述酸为乙二酸。
22、进一步地,所述叔丁醇碱金属为叔丁醇钾,所述酰化剂为乙酸酐,所述供氢体为甲酸铵。
23、进一步地,所述还原剂为水合肼。
24、进一步地,环己二酮:溴乙腈:第一碱的摩尔比为1:1:0.4;化合物2:丁烯酮:第一催化剂的摩尔比为1:1:0.01;步骤s3中,化合物3:第二催化剂:第一添加剂的摩尔比为1:0.1:0.05;化合物4:乙二醇:第三催化剂:第二添加剂的摩尔比为1:5.5:0.02:1.1;化合物5:丁烯酮:四氢吡咯的摩尔比为1:1.05:1.2;化合物6:第四催化剂的摩尔比为1:0.05;化合物7:酸的摩尔比为1:3.2;化合物8:叔丁醇碱金属盐的摩尔比为1:1;化合物9:第五催化剂:酰化剂:还原剂的摩尔比为1:0.1:1.05:1.1;化合物10:溴:第三碱的摩尔比为1:1:2;化合物11:第六催化剂:供氢体的摩尔比为1:0.1:5;化合物12:甲醛的摩尔比为1:2;按g/ml计,化合物12:甲酸的用量比为0.3:4。
25、在本发明一实施例中,步骤s1中,反应温度为室温,反应时间为20-24h。
26、在本发明一实施例中,步骤s2中,反应温度为室温,反应时间为2-3h。
27、在本发明一实施例中,步骤s3中,反应温度为室温,反应时间为2-3h。
28、在本发明一实施例中,步骤s4中,反应温度为-15~-10℃,反应时间为5-7h。
29、在本发明一实施例中,步骤s5中,反应温度为110-115℃,反应时间为16-20h。
30、在本发明一实施例中,步骤s6中,反应温度为室温,反应时间为16-20h。
31、在本发明一实施例中,步骤s7中,反应温度为室温,反应时间为2-5h。
32、在本发明一实施例中,步骤s8中,反应温度为20-25℃,反应时间为2-4h。
33、在本发明一实施例中,步骤s9中,氰基还原和伯胺乙酰化温度为室温,反应时间为6-8h;羰基还原温度为160-180℃,反应时间为6-8h。
34、在本发明一实施例中,步骤s10中,环化反应温度为0-5℃,环化反应时间为0.5-1h;脱卤化氢反应温度为135-150℃,反应时间为1-1.5h。
35、在本发明一实施例中,步骤s11中,反应温度为135-145℃,反应时间为5-7h。
36、在本发明一实施例中,步骤s12中,反应温度为70-100℃,反应时间为2-4h。
37、相比于现有技术,本发明具有如下有益效果:
38、(1)本发明开发了新的不对称合成路线制备右美沙芬,避免中间体拆分,提高了收率,提高了原子经济性,减少浪费。
39、(2)本发明的合成新路线不使用昂贵的起始物料,且反应条件较为温和,有利于工业化生产。
40、(3)本发明避免严苛的工艺条件,三废大大减少,环境友好。
- 还没有人留言评论。精彩留言会获得点赞!