一种细胞多突变位点基因成像方法
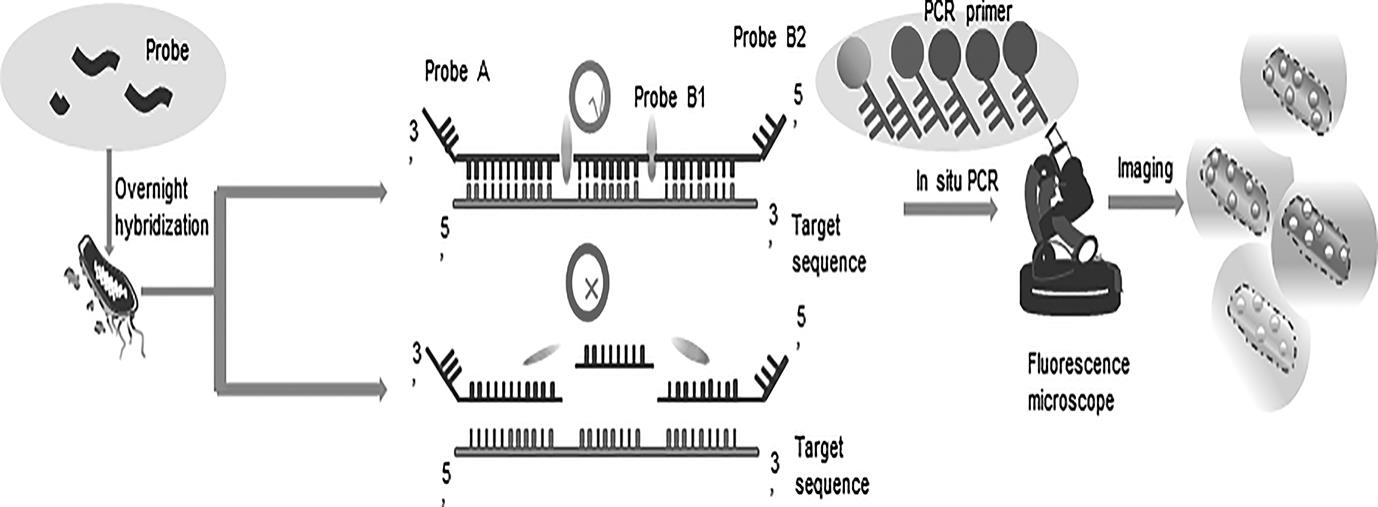
本发明属于单细胞分析领域,涉及一种基于原位pcr的多突变位点检测方法,并利用在不同引物上标记不同荧光基团成像突变位点,实现了对于拥有不同突变位点菌种的单细胞可视化检测的方法。
背景技术:
1、单细胞原位分析有利于了解细胞行为和功能,单细胞可视化技术能够实现基因检测在时间和空间上的分辨率,沙门氏菌是世界各国食源性疾病的主要原因之一。随着多重耐药 (mdr)沙门氏菌菌株的出现,动物和人类沙门氏菌感染的治疗变得更加困难。食源性感染和耐多药沙门氏菌爆发的报道也越来越多。
2、单核苷酸多态性(snv)的检测方法已经得到很好的发展,包括基于杂交探针的测试、原位滚环扩增(rca)等。新一代测序(ngs) 是广泛用于发现新突变的方法之一,然而,ngs不能直接用于原位单突变成像。与ngs相比,单碱基突变的原位成像可以获得细胞的空间和异质性信息,可以提前检测出群体中少量细胞的突变。传统的方法只能实现单个碱基的成像,目前利用原位成像检测碱基突变的难点是对突变碱基位置的识别,使用连接酶可以很好地完成在连接位点区分单突变位点。fish是一种允许在单细胞水平和单分子分辨率下使用荧光染料标记的多个单链、多个化学合成的寡核苷酸对细胞质和核rna进行量化和定位的技术。fish与核酸扩增结合,例如pcr,可以提高灵敏度,从而提高单个碱基分辨率,然而,fish需要设计多个与扩增产物杂交的探针,步骤繁琐、费时费力,且核酸扩增和fish通常只能识别单个突变并产生信号。pcr能够使用荧光团修饰的探针与靶rna互补配对和pcr扩增在细胞成像中产生高增益,但是传统的pcr不允许直接观察细胞中的放大信号,也不允许特定基因片段的放大信号,原位pcr的发展使得在固定细胞中扩增和检测单核苷酸多态性成为可能。
3、故本发明是一种基于原位pcr的对病原菌内突变位点进行原位成像的技术,不仅可以检测目标基因内的单突变位置,同时能够检测邻近的双个突变的位置,通过在pcr引物上标记上不同的荧光基团进行扩增,实现信号的放大与突变位点测试结果可视化。本专利所提供的方法具有构建研究细胞内多个突变位点和促进单细胞行为可视化的成像工具的潜力。
技术实现思路
1、本发明的目的在于实现病原菌内突变位点在细胞内的原位可视化技术,探索一种基于连接和原位pcr的病原菌突变位点可视化原位检测方法,通过与目的基因反向互补的探针与连接酶的连接特异性,对于目的基因进行精确检测,并且通过在原位pcr过程中加入不同荧光基团修饰的引物,实现检测病原菌突变位点的结果可视化。该方法可以简化检测分析步骤,提高检测效率。通过该检测方法还可以实现对于有不同突变位点的菌种进行选择性多色成像,并研究在野生型菌种和突变菌种同时存在的情况下,该方法对于突变菌种的识别与成像效果。
2、本发明所述的单细胞原位检测方法的具体步骤如下:
3、细菌的原位成像。在6000-8000 rpm转速下离心3-5 min,去上清,在1 × pbs缓冲液中重悬,在6000-8000 rpm转速下离心3-5 min,去上清。加入一定体积的4 %多聚甲醛固定30-60 min。然后,加入一定体积的50 µg/ml的蛋白酶k,在37 °c孵育5-10 min,在1 ×pbs缓冲液中重悬,加入5‰ triton x – 100, 37 ℃静置5-10 min。接下来,将2 μl probea (10 μm)、2 μl probe b1 (10 μm)、2μl probe b2 (10 μm)与4 μl 20×ssc 缓冲液、2 μl dtt (100 mm)、1 μl ribolock rnase 抑制剂 (40 u/μl)、4 μl酵母trna (10 mg/ml)在3 μl rnase-free h2o中混匀,37℃过夜孵育,在室温下用1×pbs缓冲液洗涤2次,然后加入0.5 μl t4 dna连接酶、2 μl 10×t4 dna连接酶缓冲液至17.5μl rnase-free h2o中,37℃连接1h,使用1×pbs 缓冲液洗涤两次,然后进行原位pcr,pcr 反应总体积为20 μl,其中含有1 μl dna模板、2 μl primer a(0.5 μm)、10 μl 2×easytaq pcr supermix 和7 μlrnase-free h2o。循环程序包括在95 ℃下预变性5 min;95 ℃变性15 s,然后60 ℃ 15 s,72 ℃ 45 s,72 ℃ 5 min,30个循环。扩增过程在 proflex 3×32 孔 pcr 系统(thermofisher scientific)中进行。利用荧光显微镜(尼康ts2r-fl)进行原位成像,image j用于荧光图像的荧光强度统计。
4、区分野生型菌种与突变型菌种。用野生型和突变型沙门氏菌制备了三种比例(30%、50% 和 70%)混合物样品,在6000-8000 rpm转速下离心3-5 min,去上清,在1 × pbs缓冲液中重悬,在6000-8000 rpm转速下离心3-5 min,去上清。加入一定体积的4%多聚甲醛固定30-60 min。然后,加入一定体积的50 µg/ml的蛋白酶k,在37 °c孵育5-10 min,在1 ×pbs缓冲液中重悬,加入5‰ triton x – 100, 37 ℃静置5-10 min。接下来,将2 μl probea (10 μm)、2 μl probe b1 (10 μm)、2μl probe b2 (10 μm)与4 μl 20×ssc 缓冲液、2 μl dtt (100 mm)、1 μl ribolock rnase 抑制剂 (40 u/μl)、4 μl酵母trna (10 mg/ml)在3 μl rnase-free h2o中混匀,37℃过夜孵育,在室温下用1×pbs缓冲液洗涤2次,然后加入0.5 μl t4 dna连接酶、2 μl 10×t4 dna连接酶缓冲液至17.5μl rnase-free h2o中,37℃连接1h,使用1×pbs 缓冲液洗涤两次,然后进行原位pcr,pcr 反应总体积为20 μl,其中含有1 μl dna模板、2 μl primer a(0.5 μm)、10 μl 2×easytaq pcr supermix 和7 μlrnase-free h2o。循环程序包括在95 ℃下预变性5 min;95 ℃变性15 s,然后60 ℃ 15 s,72 ℃ 45 s,72 ℃ 5 min,30个循环。扩增过程在 proflex 3×32 孔 pcr 系统(thermofisher scientific)中进行。利用荧光显微镜(尼康ts2r-fl)进行原位成像,image j用于荧光图像的荧光强度统计。
5、本发明所述的基于连接和原位pcr技术病原菌多突变位点可视化原位检测方法原理如图1所示。连接酶是一种可以催化dna相邻3'-oh和5'-p末端之间磷酸二酯键的形成的一种酶,dna探针通过与目的基因的准确杂交激活dna连接酶的连接活性,形成pcr模板链,通过被荧光修饰了的pcr引物进行原位pcr扩增,能够产生扩大的荧光信号。
6、本发明与现有技术相比,具有以下有益效果:
7、本方法提供了一种基于连接与原位pcr的病原菌多突变位点可视化原位检测方法,允许成像单细胞基因并可以提供有关细胞群体异质性的关键信息。
8、灵敏度高,本发明的检测病原菌及变体方法的检测能够实现对于菌种的单个突变或邻近的双突变的检测。
9、特异性高,本发明的检测细菌多突变位点的方法几乎不会对野生型菌体产生假阳性信号。
10、可检测具有单突变位点和邻近双突变位点的沙门氏菌病原菌,针对不同突变位点的探针,可分别检测出不同突变位点的病原菌,然后通过加入修饰了不同的荧光基团的引物,实现对于不同突变的多色荧光检测。
11、以下通过实施形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!