一种慢病毒的包装方法与流程
本发明涉及生物,特别是涉及一种慢病毒的包装方法。
背景技术:
1、慢病毒(lentivirus)是一类改造自人免疫缺陷病毒(hiv)的病毒,是逆转录病毒的一种,基因组是rna,原发感染的细胞以淋巴细胞和巨噬细胞为主,慢病毒感染患者早期很难观察,大多经历长达数年的潜伏期,之后缓慢发病,因此称为慢病毒。
2、在慢病毒的生产过程中,上游工艺包括包装慢病毒,又分为悬浮培养和贴壁培养。上游工艺往往决定了产品的质量,在保证病毒产量的前提下需要尽可能的减少工艺和产品相关杂质的产生,上游工艺杂质过多会增加下游纯化工艺的压力,而培养条件和慢病毒包装培养基对工艺和产品相关杂质有直接影响。
3、现有的慢病毒包装工艺包括:
4、贴壁工艺:
5、(1)复苏细胞;(2)细胞传代扩增;(3)细胞铺板;(4)细胞转染;(5)慢病毒包装:转染4-6h后,弃掉培养上清,加入包装培养基(dmem、或dmem+2% fbs、或dmem+10%fbs),37℃,5%co2培养至转染后24-72h收获慢病毒上清。
6、悬浮工艺:
7、(1)复苏细胞;(2)细胞传代扩增;(3)准备细胞;(4)细胞转染;(5)慢病毒包装:转染4-6h,用无血清培养基将细胞密度稀释至包装时所需密度(1-3e+06cells/ml),37℃,5%co2,125rpm,继续培养至转染后24-72h收获慢病毒上清。
8、然而,按照上述慢病毒包装方法进行慢病毒制备时发现,上游工艺杂质过多,不满足工艺要求,显著降低了下游层析过程的载量和收率,增加了最终的产品质量不合格的风险。
技术实现思路
1、基于此,本发明的目的是提供一种杂质含量少、同时产量高的慢病毒的包装方法。
2、第一方面
3、本发明提供一种慢病毒的包装方法,采用贴壁工艺生产慢病毒,包括以下步骤:
4、(1)复苏细胞;
5、(2)细胞传代扩增;
6、(3)细胞铺板;
7、(4)细胞转染;
8、(5)包装慢病毒:转染后,弃掉培养上清,加入稀释后的dmem培养基进行培养。
9、在一些实施方案中,步骤(1)细胞选自293t细胞,例如hek 293t细胞。
10、在一些实施方案中,步骤(2)中,细胞汇合度≥70%时进行传代扩增。
11、在一些实施方案中,步骤(1)、步骤(2)、步骤(3)中,
12、培养基为dmem+(10±2)%fbs;
13、和/或,培养条件包括:36-38℃的培养温度、3-7%的co2浓度,例如37℃、5%co2。
14、在一些实施方案中,步骤(4)具体包括以下步骤:
15、a1)弃掉培养基,加入转染培养基,继续培养;
16、a2)配制转染复合物,所述转染复合物包括慢病毒包装质粒、目的基因表达质粒和转染试剂;
17、a3)将转染复合物加入步骤a1)中进行细胞转染。
18、在一些实施方案中,步骤a1)中,
19、转染培养基为dmem,优选为dmem+(2±0.5)%fbs,即添加(2±0.5)%fbs的dmem;
20、和/或,培养条件36-38℃、3-7%co2,例如37℃、5%co2。
21、在一些实施方案中,步骤a2)中,转染试剂为pei。
22、在一些实施方案中,步骤(5)中,使用纯化水稀释dmem培养基。
23、在一些实施方案中,步骤(5)中,所述稀释后的dmem培养基为0.2-0.8×dmem培养基,优选0.4-0.8×dmem培养基,更优选0.4-0.6×dmem培养基。
24、在一些实施方案中,所述稀释后的dmem培养基为(0.6±0.1)×dmem培养基。
25、在一些实施方案中,所述dmem培养基中葡萄糖的浓度为4000-5000mg/l,优选为4500mg/l。
26、在一些实施方案中,步骤(5)所述培养的温度为30-37℃,优选30-35℃,更优选为32-34℃。
27、在一些实施方案中,所述稀释后的dmem培养基中任选的可加入加料培养基,所述加料培养基优选为cell boost7a或balancd hek293 feed。
28、在一些实施方案中,cell boost7a的加入体积为稀释后的dmem培养基与加料培养基体积之和的1-5%,例如2%;
29、和/或,balancd hek293 feed的加入体积为稀释后的dmem培养基与加料培养基体积之和的1-10%,例如5%。
30、在一些实施方案中,步骤(5)中,培养时间为转染后45-50小时,例如48小时。
31、在一些实施方案中,所述方法还任选的包括慢病毒的纯化和/或浓缩步骤。
32、第二方面
33、本发明提供一种慢病毒的包装方法,采用悬浮工艺生产慢病毒,包括以下步骤:
34、(1)复苏已驯化完成的悬浮细胞,用无血清培养基进行培养;
35、(2)细胞传代扩增;
36、(3)准备细胞;
37、(4)细胞转染;
38、(5)包装慢病毒:转染后,将培养液用纯化水稀释,进行培养。
39、在一些实施方案中,步骤(1)悬浮细胞选自293t悬浮细胞,例如hek 293t悬浮细胞。
40、在一些实施方案中,步骤(1)、步骤(2)、步骤(3)中,
41、培养条件包括:36-38℃、3-7%co2,例如37℃、5%co2。
42、在一些实施方案中,步骤(4)具体包括以下步骤:
43、b1)用无血清培养基稀释、培养;
44、b2)配制转染复合物,所述转染复合物包括慢病毒包装质粒、目的基因表达质粒和转染试剂;
45、b3)将转染复合物加入步骤b1)所得包含悬浮细胞的培养基中进行细胞转染。
46、在一些实施方案中,步骤b1)中,
47、培养条件36-38℃、3-7%co2,例如37℃、5%co2。
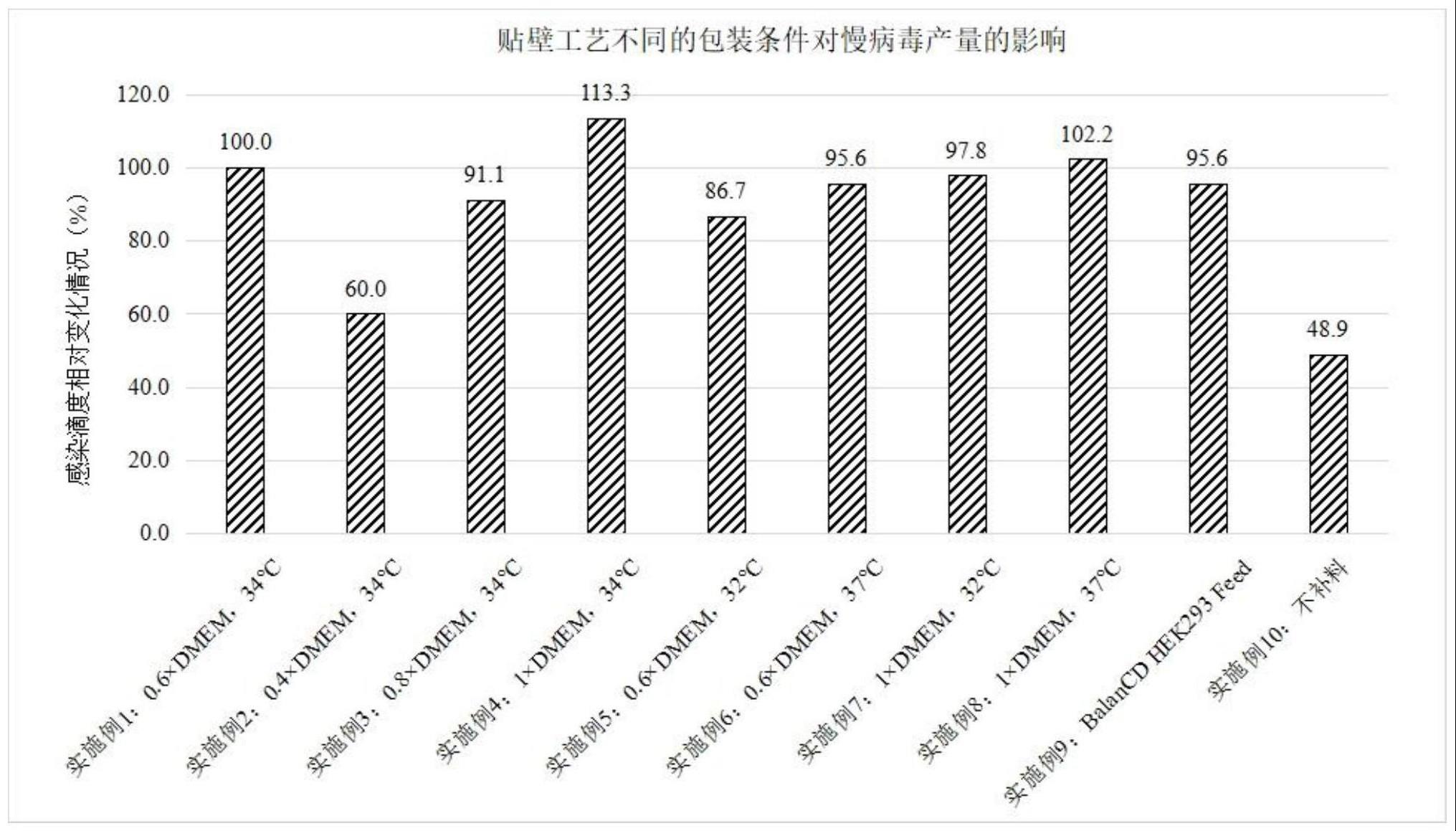
48、在一些实施方案中,步骤b2)中,转染试剂为pei。
49、在一些实施方案中,步骤(5)所述培养的温度为30-37℃,优选为32-37℃,更优选为32-34℃。
50、在一些实施方案中,步骤(5)所述培养的温度为30-35℃,优选为(34±1)℃。
51、在一些实施方案中,步骤(5)转染后,任选的可加入加料培养基后,再将培养液用纯化水稀释。
52、在一些实施方案中,所述加料培养基优选为cell boost7a或balancd hek293feed。
53、在一些实施方案中,cell boost7a的加入体积为培养液体积的1-5%,例如2%;
54、和/或,balancd hek293 feed的加入体积为培养液体积的1-10%,例如5%。
55、在一些实施方案中,步骤(5)中所用的纯化水的体积为培养液体积或加入加料培养基后的培养液体积的1/9-1/4,优选为1/7。即稀释系数为0.8-0.9,优选为0.8-0.875。在一些实施方案中,步骤(5)的培养时间为转染后45-50小时,例如48小时。
56、在一些实施方案中,步骤(5)中所述稀释的稀释系数为0.875±0.05。
57、在一些实施方案中,所述方法还任选的包括慢病毒的纯化和/或浓缩步骤。
58、与现有技术相比,本发明具有以下有益效果:
59、本领域中,包装细胞时,一般直接使用dmem培养基或无血清培养基进行培养,而不会进行稀释,因为一般认为稀释后会使得培养基渗透压降低,不利于细胞的生存和繁殖。然而,在慢病毒的包装中,本发明的发明人在一次偶然的实验中,用稀释后的dmem培养基或无血清培养基对转染后的细胞进行培养,意外发现,当严格控制dmem培养基或无血清培养基的稀释倍数时,能有效降低慢病毒包装过程中的杂质,提高上游产品的质量。
60、进一步的,如果将上述稀释后的培养基与特定的培养温度配合,能进一步降低杂质,提高产品质量。
61、进一步的,本发明中,在培养基中加入特定的补料cell boost7a或balancdhek293 feed,还能有效提高产量。
- 还没有人留言评论。精彩留言会获得点赞!