单细胞捕获装置和方法
本发明属于细胞分子生物学领域,具体涉及一种单细胞捕获装置和方法。
背景技术:
1、近年来随着单细胞组学技术的快速兴起,极大地促进了生命科学和医学各个领域的研究进展。单细胞组学技术的首个关键步骤即为获取单个细胞。目前已有多种成熟的技术,包括:流式分选、手动挑选、激光显微切割和基于膜片钳系统的patch-seq等。其中,流式分选依赖于制备单细胞悬液后,进一步对带有特殊标记的细胞进行批量检测和分选,该方法具有通量高、可重复性高等优点,其缺点为仅适合目标细胞含量高的细胞样本;手动挑选同样也需要制备单细胞悬液,然后在显微镜下借助毛细玻璃管对目标细胞进行逐个吸取,相比流式分选,其通量降低,但准确性提高,可人为对目标进行判断,但同样,该方法仅适合目标细胞含量高的细胞样本;激光显微切割技术适用于组织切片,通过在二维组织切片上用激光沿着目标细胞周围切割,进而捕获单个细胞,该技术同样具有准确性高的特点,但需要目标细胞数量足够多才能降低切片难度,而且通量也较低。基于膜片钳系统的patch-seq方案为,在对目标细胞进行高阻封接后和电信号记录后,吸取细胞内含物,进而获得细胞,该方法可以将电信号、神经元形态和测序信息关联起来,但同样面临通量低的缺点,并且膜片钳技术门槛高,整个系统复杂,对于非神经元细胞或者不需要记录电信号和形态的细胞显得有些冗余。此外,对于单个细胞的在体捕获,仅基于膜片钳系统的patch-seq方案有极少的实现案例,而且该方法的一大问题在于容易将引入靶细胞以外的组织细胞成分,对本身含量极少的单细胞样本产生严重污染,干扰后续实验。虽然单细胞测序成本在逐渐降低,但对于样本量需求较大的单细胞测序实验,如果低质量细胞比例较高,成本依然很高。
2、具体地,目前已报道的patch-seq单细胞捕获方法,是基于膜片钳系统对神经元进行电信号记录后,通过施加负压吸取单个细胞内容物的方法。已发表的工作中大多数patch-seq对神经元进行电信号记录后捕获单个神经元进行高通量测序,但经测序分析发现许多细胞样本均混入了非靶细胞成分,通常的做法是经过测序分析后去除污染较高的样本。虽然高通量测序成本得到了极大地降低,但单细胞测序样本基数大,低比例的污染细胞仍然会加重研究成本。另外基于膜片钳系统的单细胞捕获系统结构组成复杂,不利于缺少膜片钳系统的实验室进行单细胞捕获实验,普适性较低。
3、除此之外,部分课题组的研究对象为含量十分稀少的细胞,尤其是混杂在组织内部的个别细胞,如何捕获高质量的单个稀有类型细胞仍然是一大难题。
4、因此,本发明提供一种简便的单细胞捕获装置以及获得高质量单个稀有细胞的方法,同时提供一种污染去除和测序前质控方案,可极大地降低单细胞测序实验成本。
技术实现思路
1、本发明的目的在于提供一种适用性更强的单细胞捕获装置和方法,尤其是基于玻璃微电极在体捕获单个稀有类型的细胞。该在体捕获单个稀有细胞的方法提高捕获的单细胞质量,降低单细胞测序的成本。
2、为实现上述目的,一方面,本发明提供了一种单细胞捕获装置。
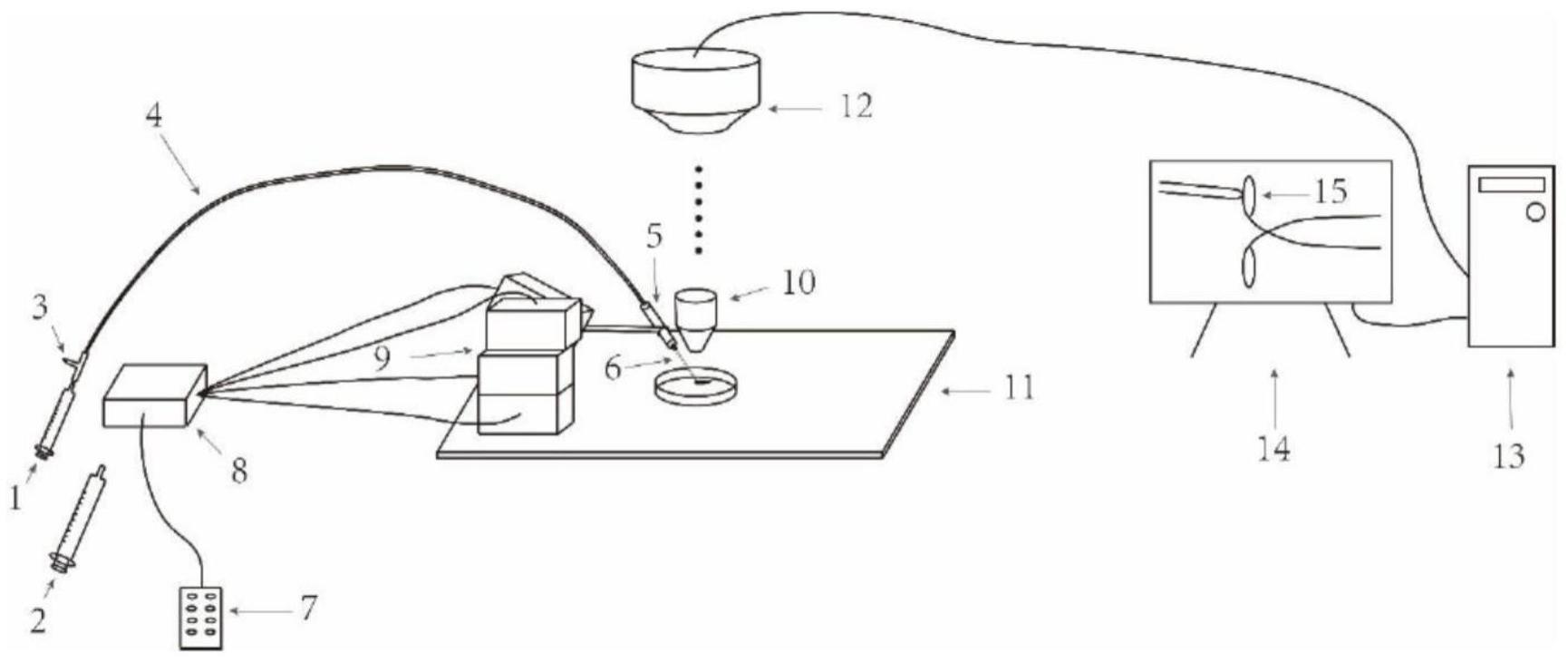
3、在一个实施方案中,单细胞捕获装置包括动力系统、微操系统和显微系统。动力系统包括:第一和第二医用注射器、三通阀门、橡胶软管、电极夹持器和玻璃微电极;微操系统包括:微操控制器、微操控制中心和微操机械臂;显微系统包括:荧光显微镜、ccd相机和电子计算机。
4、所述动力系统的1ml医用注射器或10ml医用注射器与三通阀门第一接口相连,用于为吸取细胞提供动力,第一医用注射器和第二医用注射器可以均为1ml医用注射器,或者第一医用注射器为1ml医用注射器,第二医用注射器为10ml医用注射器。
5、所述动力系统的三通阀门第二接口封闭,第三接口与橡胶软管一端连接,用于控制动力系统内部的气压。
6、所述动力系统的橡胶软管另一端与电极夹持器相连,起到连接作用。
7、所述动力系统的电极夹持器与玻璃微电极相连,用于固定玻璃微电极。
8、所述动力系统的玻璃微电极用于吸取细胞内容物,所述玻璃微电极为通过三步法拉制的电极,电极成品尖端为2-3μm的开口。
9、所述微操系统的微操控制器与微操控制中心相连,用于将位置移动命令传输到微操控制中心。
10、所述微操系统的微操控制中心与微操机械臂相连,用于处理位置移动信号并将其输出至微操机械臂。
11、所述微操系统的微操机械臂与电极夹持器相连,用于提供移动动力,并携带玻璃微电极实现微米层面的位移。
12、所述显微系统的荧光显微镜与ccd相机相连,用于放大组织细胞,还可通过不同波长的滤光片激发细胞或电极尖端的荧光物质,并将信息传递给ccd相机;
13、所述显微系统的ccd相机与电子计算机相连,用于将荧光显微镜的光信号转化为电信号传递至电子计算机。
14、所述显微系统的电子计算机用于处理ccd相机传输的电信号,经过处理可转化为图像信息展示在电子计算机的显示器上。
15、另一方面,本发明提供了一种获得高质量单细胞的方法。
16、该方案包括单细胞捕获方案、污染去除方案和转录组测序前质控方案。
17、单细胞捕获方案提供了采用本技术中的在体捕获单个稀有细胞的装置捕获单个稀有细胞。
18、污染去除方案提供了一种独有的去除玻璃微电极外壁黏附组织细胞的方法,具体为,在含有裂解细胞的试剂,如碱性溶液,优选50mm氢氧化钠溶液的无菌、无酶的容器内(例如pcr管,商用的rnase-free产品等),反复浸润在体捕获单个稀有细胞的装置中的玻璃微电极的尖端,例如约10次左右,以有效去除玻璃微电极外壁黏附组织细胞。
19、转录组测序前质控方案提供了一种检测所捕获细胞混入非靶细胞比例的方法,该方法包含cdna完整性检测和特异性基因表达水平检测。
20、所述转录组测序前质控方案的cdna完整性检测是对cdna长度和含量分布的检测,可以不仅限于使用生物分析仪2100结合高灵敏dna检测试剂盒对mrna经smart-seq方案得到的cdna文库进行检测。
21、所述转录组测序前质控方案的特异性基因表达水平检测是利用实时荧光定量pcr对cdna文库中靶细胞和非靶细胞特异性基因表达水平的检测,若细胞没有或混入极少非靶细胞成分,则检测到的非靶细胞特异性基因表达水平占比应极低。
22、所述转录组测序前质控方案的特异性基因表达水平检测中非靶细胞的确定可通过分析电极接触到靶细胞所经过路径中可能遇到的组织细胞进行确定。
23、所述转录组测序前质控方案的特异性基因表达水平检测中特异性基因可根据文献和数据库调研确定。
24、所述转录组测序前质控方案的特异性基因表达水平检测中靶细胞和非靶细胞特异性基因表达比例可通过以下公式转化:
25、
26、其中,n1、n2、n3分别代表靶细胞与非靶细胞特异性基因的表达水平,cq1、cq2、cq3分别代表对应基因的荧光强度达到阈值时pcr的循环次数。所述转录组测序前质控方案的特异性基因表达水平检测中建议去除非靶细胞特异性基因占比超过5%的细胞。
27、具体地,本技术采用以下技术方案:
28、1.一种单细胞捕获装置,其特征在于,包括动力系统、微操系统和显微系统,
29、其中,所述动力系统包括:第一医用注射器和第二医用注射器;三通阀门,其第二接口封闭,第一接口根据需求连接第一或第二医用注射器;橡胶软管,与所述三通阀门的第三接口连接;电极夹持器,与所述橡胶软管另一端密闭连接;玻璃微电极,与所述电极夹持器的另一端密闭连接,
30、所述微操系统包括:微操控制器,其与微操控制中心相连,用于将位置移动命令传输到微操控制中心;微操控制中心,其与微操机械臂相连,用于处理位置移动信号并将其输出至微操机械臂;微操机械臂,其一端与电极夹持器相连,另一端与微操控制中心相连以执行移动命令,携带玻璃微电极实现微米层面的位移。
31、所述显微系统包括荧光显微镜、ccd相机和电子计算机,ccd相机固定在荧光显微镜指定接口,并且通过数据传输线与电子计算机连接,电子计算机处理ccd相机传输的电信号,经过处理可将荧光显微镜下观察到的画面转化为图像信息展示在电子计算机的显示器上。
32、2.一种采用项1中的单细胞捕获装置捕获单细胞的方法,其特征在于,包括以下步骤:
33、将第一医用注射器连通至三通阀门的第一接口,
34、使玻璃微电极进入含有单细胞的溶液的液面,
35、通过观察荧光显微镜的目镜调整第一医用注射器,使电极内溶液流出,并在显微系统的监控下通过微操控制器控制玻璃微电极贴紧目标单细胞的细胞膜,
36、通过拉动第一医用注射器推进器使动力系统内部形成负压,将细胞内容物吸入玻璃微电极内部,
37、将第一医用注射器与三通阀门断开连接,并关闭三通阀门的第一接口,
38、移动玻璃微电极使其移出液面,
39、其中,所述玻璃微电极的尖端充灌有包含重组rnase抑制剂和荧光染料,例如alexa fluor 594的溶液。
40、3.根据项2所述的方法,其特征在于,还包括将第二医用注射器连接至三通阀门的第一接口,并调整三通阀门为连通第一、三接口,推动第二医用注射器的推进器将玻璃微电极内吸入的细胞内容物进行转移。
41、4.根据项2所述的方法,其特征在于,还包括用含有裂解细胞的试剂,例如碱性溶液,优选50mm氢氧化钠溶液,反复浸润项2中移出液面的玻璃微电极尖端,以去除黏附组织。
42、5.一种获得高质量靶细胞的方法,其特征在于,包括以下步骤:
43、(1)使用项1所述的单细胞捕获装置捕获细胞,其中所述单细胞捕获装置中的玻璃微电极内含有单细胞内容物;
44、(2)采用含有裂解细胞的试剂,例如碱性溶液,优选50mm氢氧化钠溶液反复浸润步骤(1)中的玻璃微电极尖端;
45、(3)检测步骤(2)中的玻璃微电极内吸入的单细胞内容物逆转录得到的cdna完整性;
46、(4)检测靶细胞与非靶细胞的特异性基因的表达水平;
47、(5)通过如下公式计算靶细胞与非靶细胞特异性基因表达比例;
48、
49、其中,n1、n2、n3分别代表靶细胞与非靶细胞特异性基因的表达水平,cq1、cq2、cq3分别代表对应基因的荧光强度达到阈值时pcr的循环次数,
50、(6)根据计算结果去除非靶细胞特异性基因占比超过设定比例的细胞。
51、6.根据项5所述的方法,其特征在于,cdna完整性的检测是对cdna长度和含量分布的检测。
52、7.根据项5所述的方法,其特征在于,cdna完整性的检测使用生物分析仪2100和高灵敏dna芯片检测试剂盒进行。
53、8.根据项5所述的方法,其特征在于,靶细胞与非靶细胞特异性基因表达水平是通过实时荧光定量pcr检测的。
54、9.根据项5所述的方法,其特征在于,靶细胞与非靶细胞特异性基因表达比例阈值设定的依据为,靶细胞特异性基因表达比例超过95%。
55、定义:
56、fpkm:其是fragments per kilobase of exon model per million mappedfragments缩写,即每千个碱基的转录每百万映射读取的fragments。是二代测序中衡量基因表达水平的一个归一化后的指标。
57、有益的技术效果
58、本发明提供一种在体捕获单个稀有细胞的技术,极大地简化了基于膜片钳系统的单细胞捕获系统,同时增加了污染去除步骤并提供了一种成本更低的转录组测序前质控方案,不仅提高了普适性,同时也降低了研究成本,使得不具备膜片钳系统的实验室也可以轻易搭建捕获细胞的平台。
- 还没有人留言评论。精彩留言会获得点赞!