大肠杆菌O157:H7和鼠伤寒沙门氏菌同步检测试剂盒及检测方法
本发明属于采用生物技术进行病原菌检测,尤其涉及基于食品及食品相关基质的病原菌检测,具体为大肠杆菌o157:h7和鼠伤寒沙门氏菌的同步检测试剂盒及检测方法。
背景技术:
1、随着食品安全的要求的提高,近年来,在提高检测灵敏度的同时,尽可能缩短反应时间,提高反应效率,是食源性致病菌快速检测领域重要的研究方向之一。大肠杆菌o157:h7(e.coli o157:h7)和鼠伤寒沙门氏菌(salmonella typhimurium)是两种重要的检测项目,对其检测方法的研究改进一直是相关研究的热点之一。
2、环介导等温扩增技术(loop-mediated isothermal amplification,lamp)是一种利用bst dna聚合酶在恒温条件下进行扩增的反应,反应通过4-6个独立的引物识别目标序列,扩增产物存在多个下一个扩增反应起始位点,在很大程度上提高了反应效率,缩短了反应时间。lamp最大的特点是可以在60-65℃恒温下进行反应,无需升温降温程序,避免了昂贵的热循环仪,降低了实验成本。相比于普通pcr,lamp具有更高的灵敏度和特异性,且抗干扰能力强,非常适合应对复杂体系中致病菌的检测。
3、杂交链式反应(hybridization chain reaction,hcr)作为近年来新增的一种恒温扩增方法,不仅可以在37℃下进行反应,还无需酶的介导,仅需要一条引发链和两个发夹结构便可在缓冲液内自发进行反应。hcr的反应成本低,反应速度快,因此在食源性致病菌快速检测领域有着很大的应用前景。
4、然而现有技术中lamp和hcr在食源性病菌检测中的应用并不广泛,二者单独应用于食品检测中的技术并不成熟,存在很大改进空间,联合应用的技术更少。如现有技术中的一种:可视化lamp检测肉类中的沙门氏菌(https://doi.org/10.1016/j.lwt.2020.109262),该技术样品需要在37℃孵育,孵育时间为6-12小时,该步骤会消耗大量时间;样品灵敏度的提高依靠预增菌步骤,无法同时兼顾反应灵敏度和反应效率;依赖染料变色判断是否有致病菌存在,该方法仅能检测一类致病菌,不适用于多重检测。
技术实现思路
1、本发明的目的在于基于以上技术缺陷,提供一种大肠杆菌o157:h7和鼠伤寒沙门氏菌的同步检测试剂盒及检测方法,实现两种食源性病菌同步检测,缩短检测时间,提高检测灵敏度。本发明的目的是通过以下技术方案实现的:
2、本发明的目的实现方案之一是提供:一种大肠杆菌o157:h7和鼠伤寒沙门氏菌的同步检测试剂盒,包括:针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的lamp引物、lamp扩增产物捕获探针、hcr引物、hcr荧光基团修饰引物、hcr生物素修饰引物及链霉亲和素磁珠;用于磁珠清洗的缓冲液;用于磁珠与探针偶联的缓冲液;hcr反应缓冲液;及lampmaster mix。
3、进一步的优化,所述大肠杆菌标志性基因为基因z3276,所述伤寒沙门氏菌标志性基因为基因inva。
4、进一步的,针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的lamp引物为:z3276-f3、z3276-b3、z3276-fip、z3276-bip、inva-f3、inva-b3、inva-fip和inva-bip;针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的lamp扩增产物捕获探针为:z-lfmb、z-lbcmb、a-lfmb和a-lbcmb;针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr引物为z3276-h1和inva-h1;针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr荧光基团修饰引物为z3276-fam-h2和inva-vic-h2;针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr生物素修饰引物为z3276-bio-h1和inva-bio-h1;z3276-f3的核苷酸序列如seq id no.1所示;z3276-b3的核苷酸序列如seq id no.2所示;z3276-fip的核苷酸序列如seq id no.3所示;z3276-bip的核苷酸序列如seq id no.4所示;inva-f3的核苷酸序列如seq id no.5所示;inva-b3的核苷酸序列如seq id no.6所示;inva-fip的核苷酸序列如seq id no.7所示;inva-bip的核苷酸序列如seq id no.8所示;z3276-h1的核苷酸序列如seq id no.9所示;z3276-bio-h1的核苷酸序列如seq id no.10所示;z3276-fam-h2的核苷酸序列如seq id no.11所示;inva-h1的核苷酸序列如seq id no.12所示;inva-bio-h1的核苷酸序列如seq id no.13所示;inva-vic-h2的核苷酸序列如seq id no.14所示;z-lfmb的核苷酸序列如seq id no.15所示;z-lbcmb的核苷酸序列如seq id no.16所示;a-lfmb的核苷酸序列如seq id no.17所示;a-lbcmb的核苷酸序列如seq id no.18所示。
5、进一步的,用于磁珠清洗的缓冲液的成分及含量为:10mm tris-hcl,1mm edta,0.01%tween-20,ph 7.4;用于磁珠与探针偶联的缓冲液的成分及含量为:10mm tris-hcl,1mm edta,1m nacl,0.05% tween-20,ph 7.4;hcr反应缓冲液为pbst缓冲液,ph 7.4。
6、进一步的,还包括有细菌基因组dna提取试剂。
7、本方明的另一个目的是:提供一种大肠杆菌o157:h7和鼠伤寒沙门氏菌的同步检测试方法,包括以下步骤:
8、s1:对待测基质中的细菌dna进行提取;
9、s2:制备hcr发夹结构及反应缓冲液:
10、将针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr引物、hcr荧光基团修饰引物及hcr生物素修饰引物于95℃加热5分钟后冷却至室温,以形成发夹结构的hcr引物、hcr荧光基团修饰引物和hcr生物素修饰引物;配制pbst缓冲液作为hcr反应缓冲液,ph7.4;
11、s3:制备捕获磁珠:
12、配制用于磁珠清洗的缓冲液washing buffer;
13、配制用于磁珠与探针偶联的缓冲液binging buffer;
14、采用washing buffer清洗链霉亲和素磁珠sa-mb,并加入binding buffer混匀;
15、将步骤s2中制备的发夹结构的hcr生物素修饰引物加入到上述处理后的sa-mb中,37℃孵育1h,使引物上的生物素与sa-mb定向结合;
16、反应结束后对磁珠采用washing buffer进行清洗,并采用binging buffer重悬;分别制成可以捕获大肠杆菌标志性基因lamp扩增产物的磁珠和可以捕获伤寒沙门氏菌标志性基因lamp扩增产物的磁珠;
17、s4:lamp扩增,第一次信号放大:
18、lamp的反应体系包括:lamp master mix、针对大肠杆菌标志性基因和伤寒沙门氏菌标志基因的lamp引物、提取的细菌dna模板和无菌去离子水,65℃反应60min;获得反应好的lamp扩增产物;
19、同时制备lamp的空白对照:将所述lamp的反应体系中的细菌dna模板替换为等体积的无菌去离子水;65℃反应60min;
20、s5:lamp-hcr反应:
21、向s4中制备的反应好的lamp扩增产物及空白对照中加入针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的lamp扩增产物捕获探针,混合均匀后于95℃加热5min,冷却到室温后,依次加入s3中制备好的可以捕获大肠杆菌标志性基因lamp扩增产物的磁珠和可以捕获伤寒沙门氏菌标志性基因lamp扩增产物的磁珠、s2中制备的发夹结构的hcr引物和hcr荧光基团修饰引物及hcr反应缓冲液,37℃反应30min,然后冷却到室温;通过磁性分离对磁珠进行清洗,用hcr反应缓冲液将磁珠重悬,加入到孔板中,利用酶标仪读取荧光信号并去除孔板自带的荧光;
22、s6:通过读取的荧光信号对待测基质中大肠杆菌和伤寒沙门氏菌进行定性或定量检测。
23、作为优选:所述大肠杆菌标志性基因为基因z3276,所述伤寒沙门氏菌标志性基因为基因inva;
24、s2中:针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr引物为z3276-h1和inva-h1;针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr荧光基团修饰引物为z3276-fam-h2和inva-vic-h2;针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的hcr生物素修饰引物为z3276-bio-h1和inva-bio-h1;
25、s4中:针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的lamp引物为:z3276-f3、z3276-b3、z3276-fip、z3276-bip、inva-f3、inva-b3、inva-fip和inva-bip;
26、s5中:针对大肠杆菌标志性基因和伤寒沙门氏菌标志性基因的lamp扩增产物捕获探针为:z-lfmb、z-lbcmb、a-lfmb和a-lbcmb;
27、z3276-f3的核苷酸序列如seq id no.1所示;z3276-b3的核苷酸序列如seq idno.2所示;z3276-fip的核苷酸序列如seq id no.3所示;z3276-bip的核苷酸序列如seq idno.4所示;inva-f3的核苷酸序列如seq id no.5所示;inva-b3的核苷酸序列如seq idno.6所示;inva-fip的核苷酸序列如seq id no.7所示;inva-bip的核苷酸序列如seq idno.8所示;z3276-h1的核苷酸序列如seq id no.9所示;z3276-bio-h1的核苷酸序列如seqid no.10所示;z3276-fam-h2的核苷酸序列如seq id no.11所示;inva-h1的核苷酸序列如seq id no.12所示;inva-bio-h1的核苷酸序列如seq id no.13所示;inva-vic-h2的核苷酸序列如seq id no.14所示;z-lfmb的核苷酸序列如seq id no.15所示;z-lbcmb的核苷酸序列如seq id no.16所示;a-lfmb的核苷酸序列如seq id no.17所示;a-lbcmb的核苷酸序列如seq id no.18所示。
28、作为优选:s3的具体操作为:
29、s31:配制washing buffer:10mm tris-hcl,1mm edta,0.01% tween-20,ph 7.4;
30、s32:配制binging buffer:10mm tris-hcl,1mm edta,1m nacl,0.05% tween-20,ph 7.4,用于磁珠分别与z3276-bio-h1和inva-bio-h1偶联;
31、s33:链霉亲和素磁珠sa-mb进行清洗:取一定体积的sa-mb于离心管中,待磁珠完全被吸附后,吸去上清液并吸取等体积washing buffer加入到离心管中,对磁珠进行涡旋震荡,然后磁性分离1-2min,待磁珠完全被吸附后再次吸去上清液,重复2次清洗步骤,最后加入等体积的binding buffer,涡旋混匀;
32、s34:分别吸取等浓度等体积的z3276-bio-h1和inva-bio-h1,然后分别加入到9倍体积的s33处理后的磁珠中,37℃孵育1h,使bio-h1探针上的生物素与sa-mb定向结合,反应结束后对磁珠进行2次清洗,最后用10倍体积的binding buffer将制备好的捕获磁珠重悬,分别制成可以捕获z3276基因lamp扩增产物和inva基因lamp扩增产物的磁珠。
33、进一步的优选:s4的具体反应体系:实验组:2×lamp master mix 10μl,z3276-fip1.6μm,z3276-bip 1.6μm,z3276-f3 0.2μm,z3276-b3 0.2μm,inva-fip 1.6μm,inva-bip 1.6μm,inva-f3 0.2μm,inva-b3 0.2μm,dna模板4μl,无菌去离子水补足体系至20μl;空白对照组:2×lamp master mix 10μl,z3276-fip 1.6μm,z3276-bip 1.6μm,z3276-f30.2μm,z3276-b3 0.2μm,inva-fip 1.6μm,inva-bip 1.6μm,inva-f3 0.2μm,inva-b3 0.2μm,不包含目标细菌的无菌去离子水代替dna模板4μl,无菌去离子水补足体系至20μl。
34、进一步的:s5中lamp-hcr反应具体操作为:向s4中制备的反应好的lamp扩增产物及空白对照中分别加入z-lfmb、z-lbcmb、a-lfmb、a-lbcmb 4种捕获探针10μm各1μl,混合均匀后于95℃加热5min,冷却到室温后,依次加入s3制备好的可以捕获z3276基因lamp扩增产物和inva基因lamp扩增产物的磁珠各10μl,s2中制备的发夹结构的z3276-fam-h2和inva-vic-h2以及z3276-h1和inva-h1各2μl,hcr反应缓冲液补足反应体系至100μl,37℃反应30min,然后冷却到室温,通过磁性分离对磁珠进行两次清洗,最后用50μl hcr反应缓冲液将磁珠重悬,加入到黑色96孔板中,利用酶标仪读取荧光信号并去除96孔板自带的荧光。
35、本发明将lamp反应与hcr反应结合,设计出一种双重信号放大以同时检测e.colio157:h7和salmonella typhimurium的方法。
36、本发明为了实现lamp产物基础上的二次信号放大,设计了lamp产物的特异性捕获探针mb和对应的hcr引物,以提高反应的灵敏度和特异性。
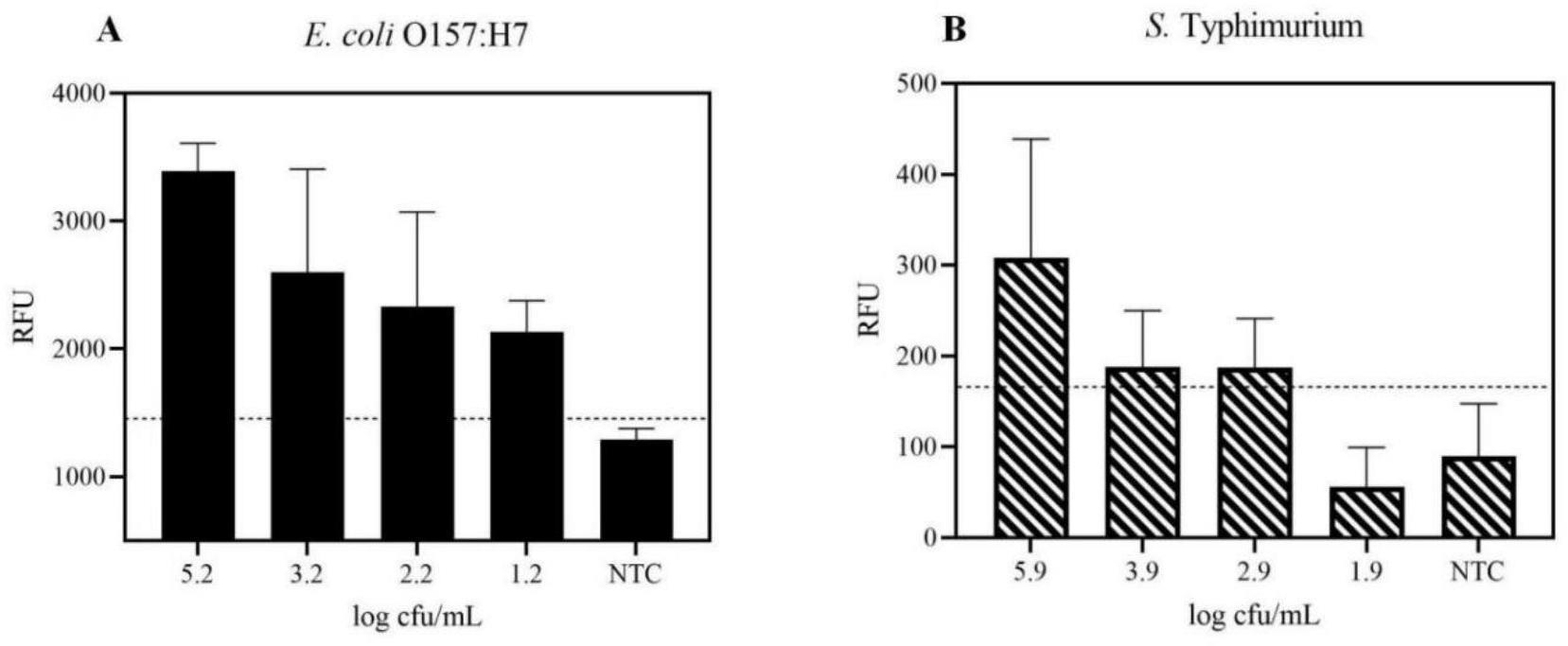
37、本发明针对e.coli o157:h7和salmonella typhimurium所对应的h2发夹引物,分别进行fam和vic的荧光基团修饰,以实现同一反应体系中的双重信号检测,有效节省成本和操作流程。
38、本发明将hcr反应固定在链霉亲和素磁珠表面反应,最终的检测信号通过采集磁珠表面的荧光强度实现,从而实现了信号的富集,提高灵敏度
39、本发明可以直接对污染食品进行检测而无需预增菌步骤,有效缩短反应时间,从dna提取到信号采集整个反应时间控制在3小时。
40、本发明的优点和有益效果是:
41、本发明的试剂盒基于lamp和hcr两种检测方法联用而设计,采用该检测试剂盒能避免食品预增菌步骤带来的时间消耗,直接对污染的食品样品进行dna提取后可进行快速检测,且保证检测的灵敏度。
42、本发明的检测方法选择了lamp和hcr两种恒温扩增方式,以缩短反应时间,并将两种扩增方式结合,在lamp扩增的基础上,利用hcr反应对lamp产物进一步扩增,从而实现了信号二次放大,提高检测灵敏度,具体有如下几点:
43、①无需对样品进行预增菌处理,可以对人工污染食品进行dna提取后直接进行lamp-hcr反应。
44、②可以同时实现e.coli o157:h7和salmonella typhimurium的检测,pbs纯菌液中二者的检出限分别为1-2log cfu/ml及2-3log cfu/ml。
45、③hcr反应是基于lamp扩增基础上进行的,通过mb特异性捕获lamp产物片段来引发磁珠表面产生hcr反应,因此能够进一步提高反应的特异性。
46、④食品基质并不会对方法的检出限造成影响,lamp-hcr方法在检测苹果汁中的e.coli o157:h7和salmonella typhimurium时,其检测限仍然保持在1-2log cfu/ml及2-3log cfu/ml。
47、⑤整体反应时间能够控制在3小时内,在保证高灵敏度检出的同时,有效提高了反应速率。
- 还没有人留言评论。精彩留言会获得点赞!