一种亚硫酸氢根和极性荧光探针及其制备方法和应用
本发明属于分析化学,涉及一个能够同时检测亚硫酸氢根和极性的荧光探针的制备方法以及在炎症和铁死亡生物体内成像的应用。
背景技术:
1、二氧化硫及其衍生物可作为食品抗氧化剂和防腐剂,广泛应用于蔬菜、水果、食品、酿酒、制药等领域。然而,二氧化硫及其衍生物的异常水平与癌症、呼吸系统疾病、神经系统疾病、心血管疾病和炎症有关。常用的so2检测方法成本高,耗时长。荧光探针由于其高时空分辨率和无创监测能力,是生物系统实时检测的有力工具。
2、除此之外,在生物系统中,极性除了发展和维持细胞平衡外,还是细胞微环境的一个组成部分。当细胞进行空间组织和蛋白质组成活动,包括分化、迁移和增殖时,它们的极性将发生改变。细胞内极性的异常改变会引起许多疾病,如糖尿病、阿尔茨海默病、糖尿病、肝硬化、炎症、癌症等。所以,监测生物体内极性的变化是十分重要的。
3、目前多数探针只能单一检测细胞中的某一微环境变化,不利于疾病模型的多因素分析。现有技术中常规的检测亚硫酸氢根荧光探针普遍存在细胞毒性大,不能用于实际医疗中。综上所述,我们希望设计出能够准确捕捉细胞及生物体内亚硫酸氢根和极性变化的双功能荧光探针,能在体内发生异常状况时给出信号,更敏感、准确的感知疾病的发生,在预防、诊断和治疗疾病等方面提供帮助。
技术实现思路
1、鉴于此,本发明的目的在于提供一个能够同时检测亚硫酸氢根和极性的荧光探针的制备方法及其在生物成像方面的应用,具有合成路线简单、选择性好、灵敏度高等特点,能够在生理水平下对亚硫酸氢根和极性进行有效检测。
2、本发明提供了一种荧光探针,该荧光探针的结构如下:
3、
4、本发明中的荧光探针合成如下所示:
5、
6、a1:2-(苯并[d]噻唑-2-基)-4-甲基苯酚
7、a2:3-(苯并[d]噻唑-2-基-2-羟基-5-甲基苯甲醛
8、a3:3-乙酰基-8-(苯并[d]噻唑-2-基)-6-甲基-2h-苯并吡喃-2-one酮
9、bdmob:8′-(苯并[d]噻唑-2-基)-7-(二乙基氨基)-6′-甲基-2′-氧代-2′h-[2,3′-苯并吡喃]-1-氧鎓高氯酸盐
10、所述荧光探针bdmob的制备步骤如下:
11、步骤1:中间产物a1的制备
12、用电子天平准确称量5-甲基水杨醛,并移取2-氨基苯硫醇放入50ml圆底烧瓶中,加入n,n-二甲基甲酰胺,超声使固体溶解,在氩气保护下,逐步升温至180℃反应2小时。反应结束后,冷却到室温,倒入30ml冰水中,立即有大量沉淀析出,抽滤并用蒸馏水洗涤。收集沉淀,放入真空干燥箱干燥12小时后得米白色固体a1(93.2%);
13、步骤2:中间产物a2的制备
14、用电子天平准确称量a1和六次甲基四胺放入50ml圆底烧瓶中,加入三氟乙酸,超声使固体溶解,在氩气保护下,将反应混合物在80℃下回流,反应过夜。反应混合物冷却后,在搅拌下缓慢加入氢氧化钠溶液,直到无沉淀析出为止。抽滤收集沉淀,通过硅胶柱层析分离提纯,展开剂为二氯甲烷,得黄色固体a2(45.0%);
15、步骤3:中间产物a3的制备
16、称取a2溶于20ml无水乙醇中,并在反应液中加入乙酰乙酸乙酯和哌啶。将反应液在氩气保护下加热回流,反应过夜。反应完成后冷却至室温,抽滤反应物,并用少量乙醇洗涤得到黄色固体a3(60.3%);
17、步骤4:荧光探针bdmob的制备
18、将50ml圆底烧瓶中加入浓h2so4,在冰水浴下将化合物a3滴加到浓h2so4中。在剧烈搅拌下分批将4-二乙氨基水杨醛加入上述混合溶液中,将混合溶液加热,在90℃条件下回流2小时。上述反应混合溶液冷却至室温,边搅拌边将混合溶液滴加进冰水中,加入hclo4产生大量沉淀。过滤得到沉淀物,冷水洗去溶剂,真空干燥24小时,得到紫黑色固体荧光探针bdmob(85.3%)。
19、本发明的荧光探针对亚硫酸氢根的响应机理如下:
20、
21、荧光探针bdmob对亚硫酸氢根的响应机理为迈克尔加成反应,机理方程式如上所示。利用光致电子转移机理,使得未结合亚硫酸氢根的荧光探针在特定波长激发下几乎没有荧光发射。当在溶液中加入亚硫酸氢根后,其加成到探针吡喃结构的碳碳双键上,破坏了探针的共轭,电子转移过程被抑制并产生相应的亚硫酸氢盐加合物,从而实现对亚硫酸氢根的响应。
22、本发明的荧光探针对极性的检测机制如下:
23、
24、bdmob以苯并吡喃和苯并噻唑为荧光团,引入强给电子基二乙氨基和吸电子苯并噻唑,形成d-π-a结构,使得荧光探针bdmob表现出溶剂化变色,同时对极性的变化具有高度敏感性。
25、图5为探针bdmob在不同比例二甲基甲酰胺和氯仿的混合溶液中的紫外可见吸收光谱,随着混合溶液的比例变化,吸收光谱呈现规律性的变化。
26、图6为探针bdmob在不同比例二甲基甲酰胺和氯仿的混合溶液中450nm及550nm处吸光度的比值,其值会随着二甲基甲酰胺的占比增加而增加。插图为365nm手提紫外灯照射下的溶液颜色照片,可见明显的溶致变色现象。
27、图7为探针bdmob在不同比例二甲基甲酰胺和氯仿的混合溶液中的荧光发射光谱(λex=450nm),随着溶液极性的增加,绿色通道的荧光强度逐渐增加。
28、图8为探针bdmob在不同比例二甲基甲酰胺和氯仿的混合溶液中的荧光发射光谱(λex=550nm),随着溶液极性的增加,红色通道的荧光强度逐渐减弱。
29、图9为探针bdmob在不同比例二甲基甲酰胺和氯仿的混合溶液中的530nm及660nm处荧光强度的比值(λex=450nm、550nm),其值会随着二甲基甲酰胺的占比增加而增加。
30、图10为探针bdmob在不同极性下的色坐标,直观展现了溶液中发光颜色的变化。
31、图11为探针bdmob在加入五当量亚硫酸氢根后的荧光发射光谱(λex=480nm)。
32、图12为探针bdmob加入亚硫酸氢根后560nm处的荧光强度(λex=480nm),有良好的线性关系。
33、图13为探针bdmob本身的光稳定性及其加入不同当量亚硫酸氢根后的响应时间(λex=480nm),在加入亚硫酸氢根之后,荧光强度逐渐升高,30分钟趋于稳定。
34、图14为探针bdmob自身在不同ph值下560nm处的荧光强度及其加入十当量亚硫酸氢根后的荧光强度(λex=480nm),探针bdmob可以在ph值为5-11的范围内有效监测亚硫酸氢根的存在。
35、图15为探针bdmob的细胞毒性,细胞毒性低,具有良好的生物相容性。
36、图16为探针bdmob与不同浓度的亚硫酸氢根共孵育后hela细胞中的共聚焦成像,随着亚硫酸氢根浓度的增加,橙色通道的荧光强度逐渐增强。
37、图17为探针bdmob与不同浓度的亚硫酸氢根共孵育后的细胞相对荧光强度柱状图,能够直观的表明荧光强度与加入亚硫酸氢根的浓度的关系。
38、图18为探针bdmob与不同浓度的亚硫酸氢根共孵育后单个细胞断面荧光强度分析,直观的表明细胞内的荧光分布情况。
39、图19为探针bdmob孵育后的细胞内源性亚硫酸氢根共聚焦成像,其中,a组为空白对照组,b组和c组条件下不能内源性产生亚硫酸氢根,故不发光。d组条件下能够内源性产生亚硫酸氢根,橙色通道的荧光强度大大提高,而在加入了抑制剂后,抑制了细胞内源性产生亚硫酸氢根,荧光又消失。可见,探针bdmob能够灵敏、快速的直观检测内源性亚硫酸氢根的产生。
40、图20为探针bdmob与铁死亡细胞共孵育的共聚焦成像,谷胱甘肽过氧化酶抑制剂能够导致细胞铁死亡,其含量升高,绿色通道和橙色通道的荧光强度逐渐增强,而铁死亡抑制剂存在下,绿色通道和橙色通道的荧光强度会减弱。
41、图21为探针bdmob与铁死亡细胞共孵育的各个通道的荧光强度,直观表明了绿色通道、橙色通道、红色通道的荧光强度的变化。
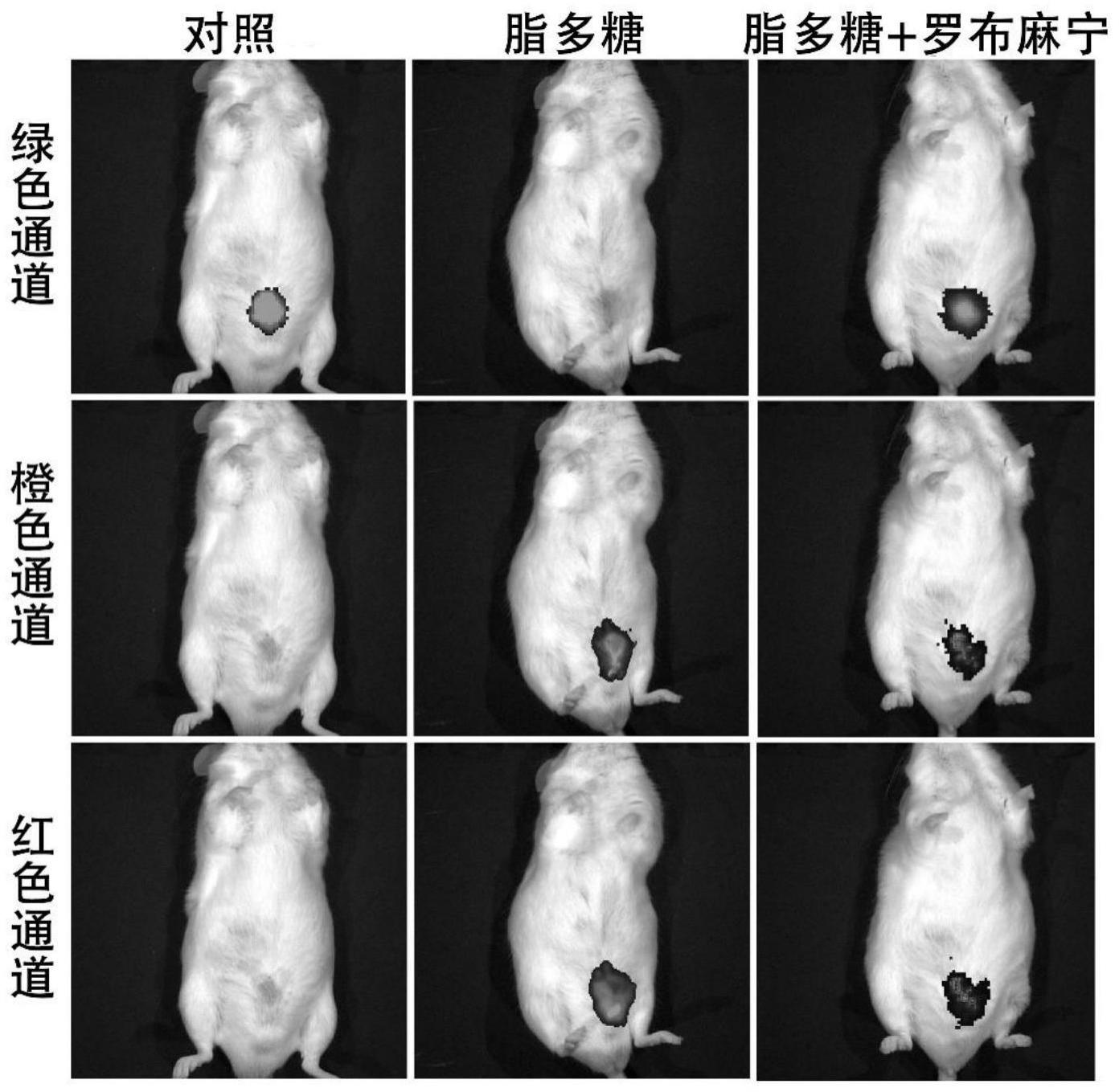
42、图22为探针bdmob与炎症细胞共孵育的共聚焦成像,脂多糖导致细胞炎症,其含量升高,绿色通道的荧光强度减弱,橙色通道和红色通道的荧光强度逐渐增强,而罗布麻宁的加入会使得绿色通道的荧光强度恢复,橙色通道和红色通道的荧光强度减弱。
43、图23为探针bdmob与炎症细胞共孵育的各个通道的荧光强度,直观表明了绿色通道、橙色通道、红色通道的荧光强度的变化。
44、图24为探针bdmob在人正常宫颈上皮细胞和宫颈癌细胞中的共聚焦成像,在人正常宫颈上皮细胞中,绿色通道的荧光强度强、红色通道的荧光强度弱;在宫颈癌细胞中,绿色通道的荧光强度弱、红色通道的荧光强度强。
45、图25为探针bdmob在人正常宫颈上皮细胞和宫颈癌细胞共同孵育后各个通道的荧光强度,直观表明了绿色通道和红色通道的荧光强度的变化。
46、图26为探针bdmob在诱导铁死亡的裸鼠体内的共聚焦成像,铁死亡裸鼠中绿光和橙光通道荧光增强,而药物介入缓解铁死亡后,绿光和橙光通道荧光发生不同程度的减弱,红色通道增强。
47、图27为探针bdmob在诱导铁死亡的裸鼠体内各个通道的荧光强度,直观表明了绿色通道、橙色通道、红色通道的荧光强度的变化。
48、图28为探针bdmob在诱导炎症的裸鼠体内的共聚焦成像,脂多糖诱导裸鼠体内发生炎症后,绿色通道减弱,橙色和红色通道的荧光强度增强,加入罗布麻宁(一种抗炎药物)后,绿色通道的荧光强度恢复,橙色和红色通道的荧光强度减弱。
49、图29为探针bdmob在诱导炎症的裸鼠体内各个通道的荧光强度,直观表明了绿色通道、橙色通道、红色通道的荧光强度的变化。
- 还没有人留言评论。精彩留言会获得点赞!