一种体外合成加帽mRNA的方法与流程
本发明属于生物,具体涉及一种mrna酶法合成的加帽缓冲体系。
背景技术:
1、mrna疫苗行业迅速发展。目前mrna生产企业的生产工艺线主要利用酶法加帽进行mrna生产,即使用rna加帽酶将合成的rna(例如,体外转录(ivt)的rna)转变为加帽的rna。
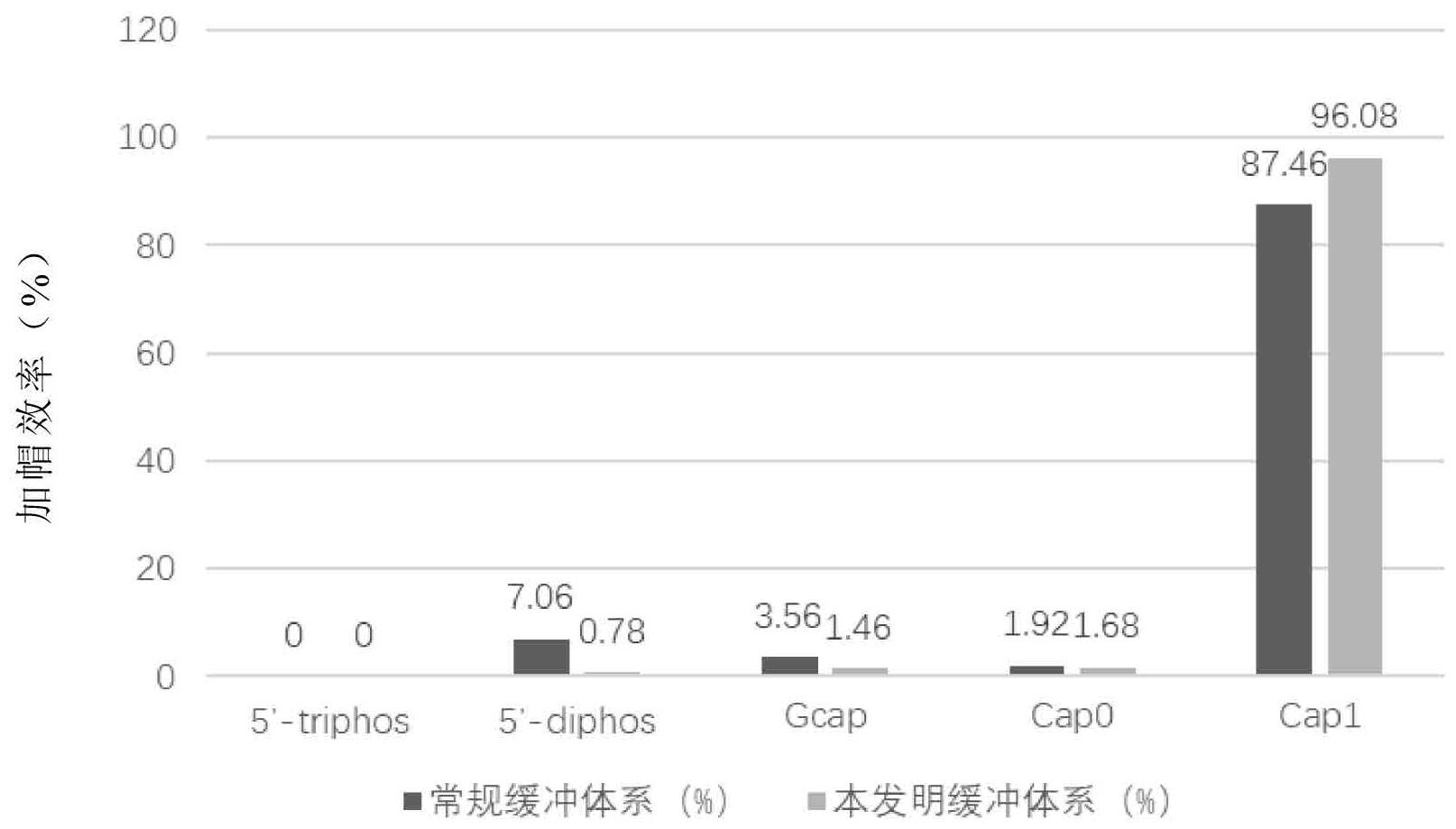
2、酶法加帽的加帽率高,但酶法合成过程中加帽酶受离子浓度的影响比较大,因此对反应底物的纯度要求较高。通常需要在rna体外转录后去除蛋白和盐分后,在常规加帽缓冲体系中进行加帽反应。生产工艺中,酶法加帽的上游产物纯化环节是一大痛点,其步骤繁琐,通常会造成部分模板的损耗,增加工艺流程和成本。
3、体外转录的产物不经纯化直接进行加帽反应的难点在于:上游反应中的杂质会带来影响;此外加帽反应所使用的酶需要在缓冲反应体系内保持较高的生物学活性。因此,对反应体系的成分比例要求较高。
4、综上所述,本领域需要开发一种缓冲体系来提高mrna酶对杂质的容忍度,进而降低上游反应中的杂质对酶法加帽反应的影响。
技术实现思路
1、本发明的目的在于提供一种mrna酶法合成的加帽缓冲体系。
2、在本发明的第一方面,提供了一种用于体外合成加帽mrna的加帽缓冲液,所述加帽缓冲液包含选自下组的组分:
3、20-80 mm 螯合剂,
4、0.2-1.0 m tris-hcl,
5、20-100 mm kcl,
6、5-50 mm mgcl2,和
7、5-50 mm dtt,所述浓度为加帽缓冲液中的浓度。
8、在另一优选例中, 包含选自下组的组分:
9、25-60 mm 螯合剂;
10、0.3-0.8 m tris-hcl,
11、40-60 mm kcl,
12、10-20 mm mgcl2,和
13、10-20 mm dtt。
14、在另一优选例中,所述加帽缓冲液的ph为7.2-8.7;较佳地为8.0±0.5。
15、在另一优选例中, 所述螯合剂选自下组:edta(乙二胺四乙酸)、nta(氨基三乙酸)、dtpa(二亚乙基三胺五乙酸)、cdta(1.2-环己二胺四乙酸)、eddha(乙二胺二邻苯基乙酸)和heedta(氨乙基乙醇胺三乙酸)以及酒石酸钠、柠檬酸钠、葡萄糖酸钠。
16、在本发明的第二方面,提供了一种用于体外合成加帽mrna的加帽缓冲体系,包含本发明第一方面所述的加帽缓冲液。
17、在另一优选例中, 所述加帽缓冲体系还包括如下浓度的组分:
18、牛痘病毒加帽酶,终浓度为1.0-2.0 u/ul;较佳地1.2-1.6 u/ul;
19、cap2’-o甲基转移酶,终浓度为10.0-20.0 u/ul;较佳地12.0-16.0 u/ul。
20、在另一优选例中, 所述加帽缓冲体系还包括如下浓度的组分:
21、0.5-3.0 mm sam;较佳地 1.5-2.0 mm sam;
22、0.5-3.0 mm gtp;较佳地1.0-2.0 mm gtp。
23、在另一优选例中, 所述加帽缓冲体系还包括如下浓度的组分:
24、0.5 mg/ml-10 mg/ml mrna;较佳地1 mg/ml-5 mg/ml mrna。
25、在另一优选例中,所述加帽缓冲体系还包括如下浓度的组分:
26、rna酶抑制剂,终浓度为1.0-2.0 u/ul。
27、在另一优选例中,所述加帽缓冲体系中,螯合剂的终浓度为2.0-8.0 mm;较佳地2.5-6.0 mm。
28、在另一优选例中,所述加帽缓冲体系包含选自下组的组分:
29、(1)加帽缓冲液,包括tris-hcl、k离子、mg离子、dtt、和螯合剂;
30、(2)牛痘病毒加帽酶,终浓度为1.2-1.6 u/ul;
31、(3)mrna cap2’-o甲基转移酶,终浓度为12.0-16.0 u/ul;
32、(4)sam,终浓度为1.5-2.0 mm;和
33、(5)gtp,终浓度为1.0-2.0 mm;
34、其中,加帽缓冲体系中,
35、螯合剂的终浓度为2.5-6.0 mm;
36、tris-hcl的终浓度为0.03-0.08 m;
37、kcl的终浓度为4.0-6.0 mm;
38、mgcl2的终浓度为1.0-2.0 mm,和
39、dtt的终浓度为1.0-2.0 mm。
40、在另一优选例中,所述螯合剂选自下组:edta(乙二胺四乙酸)、nta(氨基三乙酸)、dtpa(二亚乙基三胺五乙酸)、cdta(1.2-环己二胺四乙酸)、eddha(乙二胺二邻苯基乙酸)和heedta(氨乙基乙醇胺三乙酸)以及酒石酸钠、柠檬酸钠、葡萄糖酸钠。
41、在本发明的第三方面,提供了一种体外合成加帽mrna的方法,包括步骤:
42、(s1) 提供一体外转录的mrna产物;所述mrna产物是体外转录获得的mrna反应混合液;和
43、(s2) 将上述的体外转录的mrna产物与加帽缓冲液按照1:1~3:1的体积比混合,形成加帽缓冲体系,进行mrna体外加帽反应,从而获得加帽产物;
44、所述(s1)和(s2)之间不包括纯化步骤;
45、所述加帽产物的产率≥90%;
46、其中,所述加帽缓冲体系包含以下浓度的组分:
47、2.5-6.0 mm 螯合剂;
48、0.03-0.08 m tris-hcl;
49、4.0-6.0 mm kcl;
50、1.0-2.0 mm mgcl2,
51、1.0-2.0 mm dtt,
52、1.0-2.0 u/ul 牛痘病毒加帽酶;
53、10.0-20.0 u/ul cap 2’-o甲基转移酶;
54、0.5-3.0 mm sam;
55、0.5-3.0 mm gtp。
56、在另一优选例中,将所述(s1)中的体外转录的mrna反应混合液直接用于步骤(s2)。
57、在另一优选例中, 所述混合的温度为36-45℃,反应时间为0.5-5小时(较佳地1-4小时)。
58、在另一优选例中, 所述目标mrna的长度为500bp-3000bp;较佳地为700 bp-2500bp。
59、在另一优选例中,所述(s1)不经过纯化,直接进行步骤(s2)。
60、在另一优选例中,所述(s1)中,体外转录的mrna的终浓度为6 mg/ml-10 mg/ml。
61、在另一优选例中,所述(s2)中,所述加帽产物的产率≥90%;较佳地≥95%;更佳地≥98%。
62、在另一优选例中, 将上述的体外转录的mrna产物与加帽缓冲液按照1.2:1~2.5:1的体积比混合。
63、在另一优选例中,所述加帽缓冲体系包括如下浓度的组分:
64、1.2-1.6 u/ul 牛痘病毒加帽酶;
65、12.0-16.0 u/ul cap2’-o甲基转移酶。
66、在另一优选例中,所述加帽缓冲体系包括如下浓度的组分:
67、1.5-2.0 mm sam;
68、1.0-2.0 mm gtp。
69、在另一优选例中,所述加帽缓冲体系包括如下浓度的组分:0.5 mg/ml-10 mg/mlmrna。
70、在另一优选例中,所述浓度为加帽缓冲体系中,mrna体外加帽反应前的各组分浓度。
71、在本发明的第四方面,提供了一种体外合成加帽mrna的试剂盒,包括如本发明第一方面所述的加帽缓冲液或如本发明第二方面所述的加帽缓冲体系。
72、在另一优选例中,所述试剂盒还包括说明书,其中记载了体外合成加帽mrna的方法。
73、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!