亲和肽介导的自组装酶系统供给α-酮戊二酸及其在催化合成4-羟基异亮氨酸中的应用
本发明涉及一种亲和肽介导的自组装酶及其在生物催化合成4-羟基异亮氨酸的应用,属于生物催化。
背景技术:
1、(2s,3r,4s)-4-羟基异亮氨酸(4-hydroxyisoleucine,4-hil)是一种非蛋白的天然氨基酸,最初是在草本植物葫芦巴的种子中发现的,具有潜在的促胰岛素生物活性,是一种非常有前景的抗糖尿病药物,目前生产4-hil有多种方法,包括化学提取法、化学-酶法与生物催化合成法等。与传统化学法选择性差、污染严重相比,生物催化在c-h键的激活反应具有前所未有的选择性,具有高催化效率、低能耗和环境友好等特点,符合绿色化学的要求并适用于工业应用。由于其显著的生物催化潜力,fe(ii)/α-酮戊二酸依赖性双加氧酶(fe(ii)/α-kg dos)是未来化学酶合成和酶工程进行惰性c-h键激活和重要手性医药化合物合成的理想选择。由于显著的生物催化潜力,fe(ii)/α-kg dos是未来化学酶合成和酶工程进行惰性c-h键激活和重要手性医药化合物合成的理想选择。l-异亮氨酸双加氧酶(ec1.14.11.45,ido)能够立体/区域选择性地羟基化多种疏水性脂肪族l-氨基酸,当底物是l-异亮氨酸(l-ile)时,在c4-位立体选择性羟基化生成4-hil。
2、以fe(ii)/α-kg dos为催化剂催化c-h键活化的反应体系中,需要提供大量的α-kg作为共底物。α-kg的供应不足将导致fe(ii)/α-kg dos的催化效率低。考虑到过程经济性和工业可行性,耦联高效、低成本的α-kg再生系统很有必要。因此,研究人员将重点放在生物转化方法上,将α-kg转化为fe(ii)/α-kg dos。利用代谢工程重组或优化宿主细胞的tca循环可以在体内积累α-kg,在体内为fe(ii)/α-kg dos提供辅因子。然而,tca代谢通路的改造往往伴随着对宿主细胞生长的不良影响,同时,体内环境的复杂性将导致α-kg的积累有限,难以满足fe(ii)/α-kg dos的催化需求。
3、目前,生物酶法催化廉价易得的底物l-谷氨酸生成α-kg具有工业可行性,谷氨酸氧化酶(lgox)因为具有底物特异性高和不需要辅助因子的优点,现在被认为是生产α-kg的一个关键酶。lgox催化l-谷氨酸转化为α-kg,同时产生nh3和h2o2。h2o2的强氧化性会迅速氧化fe(ii)/α-kg dos反应中所需要的fe2+,对整个耦合反应是不利的。过氧化氢酶可以催化h2o2的降解,从而提出了多酶级联反应系统来清除lgox产生的h2o2。例如,在lgox反应体系中直接添加/固定化外源过氧化氢酶,在体外进行一锅/两步级联反应,体内共表达或融合表达lgox与过氧化氢酶全细胞催化等。然而,游离的多酶反应体系仍然无法避免h2o2的积累,抑制了随后还原环境依赖性fe(ii)/α-kg dos酶活性与反应,表明了反应在级联过程中的不相容性,反应的复杂性大大增加,导致其工业应用面临挑战。
技术实现思路
1、本发明要解决的技术问题是,fe(ii)/α-kg依赖型双加氧酶家族催化需要大量的α-kg作为共底物,目前为双加氧酶提供共底物的策略是l-谷氨酸氧化酶与过氧化氢酶(katg)级联以催化生产α-kg并消除催化过程产生的h2o2,但该级联系统不可避免地导致了h2o2的积累,严重抑制了ido的活性。
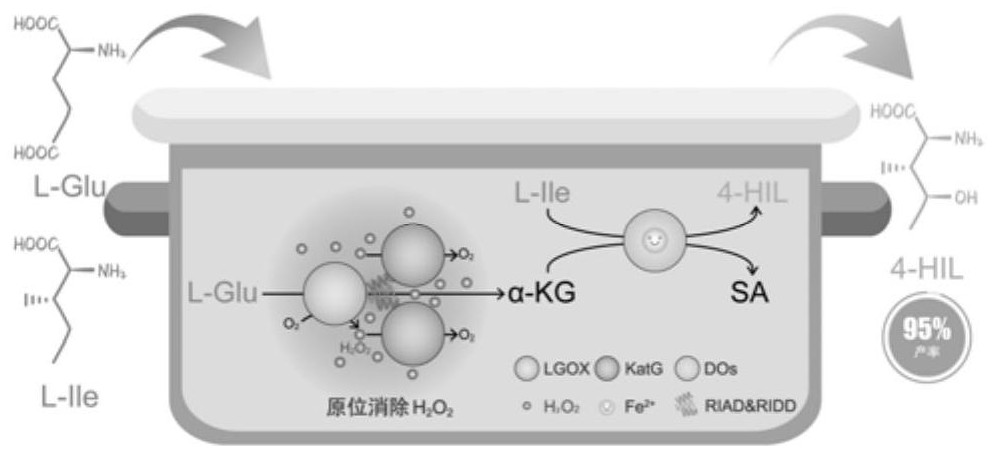
2、本发明目的是基于fe(ii)/α-kg依赖型双加氧酶家族催化需要α-kg作为共底物(fe(ii)/α-kg依赖型双加氧酶家族催化需要依赖fe2+、α-kg和氧气共同参与,α-kg作为共底物提供所需的两个电子用于激活双氧,促进底物的化学反应)的特性,提供一种基于自组装酶参与的多酶级联体系为双加氧酶供给共底物α-kg的方法。在多酶级联反应体系生产4-hil,以l-异亮氨酸及l-谷氨酸为出发底物,利用l-异亮氨酸双加氧酶、l-谷氨酸氧化酶和过氧化氢酶级联催化生成4-hil,同时利用riad-ridd短肽之间具有特异性强亲和力作用,实现l-谷氨酸氧化酶和过氧化氢酶的自组装,形成酶自组装复合物,从而原位消除l-谷氨酸氧化酶催化过程中产生的副产物过氧化氢,避免过氧化氢对双加氧酶的活性抑制,促进其生产4-hil,最终建立利用双加氧酶转化羟基氨基酸的共性级联反应体系。
3、本发明提供的第一个技术方案为一种酶自组装复合物,所述酶自组装复合物包括重组蛋白lgox-riad和重组蛋白katg-ridd,所述重组蛋白lgox-riad为c端添加了riad短肽的l-谷氨酸氧化酶lgox,所述重组蛋白katg-ridd为c端添加了ridd短肽的过氧化氢酶katg,所述重组蛋白lgox-riad和重组蛋白katg-ridd通过riad短肽和ridd短肽进行自组装。
4、在某些实施方式中,所述重组蛋白lgox-riad和重组蛋白katg-ridd的化学计量比为1:2。
5、在某些实施方式中,所述l-谷氨酸氧化酶利用连接肽(ggggs)n连接riad短肽,n为4、5或6。
6、在某些实施方式中,所述过氧化氢酶利用连接肽(ggggs)n连接ridd短肽,n为4、5或6。
7、在某些实施方式中,l-谷氨酸氧化酶的来源包括但不限于加纳链霉菌(streptomyces ghanaensis)。
8、进一步,所述l-谷氨酸氧化酶的氨基酸序列如seq id no:3所示,编码所述l-谷氨酸氧化酶的基因的核苷酸序列如seq id no:4所示。
9、在某些实施方式中,过氧化氢酶来源包括但不限于大肠杆菌(escherichiacoli)。
10、进一步地,所述过氧化氢酶的氨基酸序列如seq id no:6所示,编码所述l-谷氨酸氧化酶的基因的核苷酸序列如seq id no:5所示。
11、在某些实施方式中,所述riad的氨基酸序列如seq id no:8所示,编码所述riad的基因的核苷酸序列如seq id no:7所示。
12、在某些实施方式中,所述ridd的氨基酸序列如seq id no:10所示,编码所述ridd的基因的核苷酸序列如seq id no:9所示。
13、在某些实施方式中,所述连接肽的基本单元(ggggs)的氨基酸序列如seq id no:12所示,编码所述连接肽的基本单元(ggggs)的基因的核苷酸序列如seq id no:11所示。
14、蛋白质-蛋白质相互作用机制的深入研究促进了相互作用驱动酶组装的广泛应用,蛋白质-蛋白质的相互作用通常是通过构成肽序列来介导的,与相互作用结构域融合的酶可以自发地形成具有规则尺寸和对称性的多酶结构。基于亲和短肽的相互作用,招募酶形成非支架复合物的方法将对酶结构和活性的影响降至最低。两亲性双螺旋riad仅与稳定的二聚体riad特异性结合,形成化学计量比1:2的精确酶组装,其强亲和力和特异性确保了即使在低浓度下也能有效识别和组装。
15、本发明提供的第二个技术方案为第一个技术方案所述的酶自组装复合物的制备方法,所述方法包括如下步骤:(1)将编码重组蛋白lgox-riad的基因和编码重组蛋白katg-ridd的基因分别连接到表达载体上;所述重组蛋白lgox-riad为l-谷氨酸氧化酶lgox的c端添加有riad短肽,所述重组蛋白katg-ridd为过氧化氢酶katg的c端添加有ridd短肽;
16、(2)将步骤(1)中的获得的两个重组载体分别转化大肠杆菌,获得表达lgox-riad的大肠杆菌和表达katg-ridd的大肠杆菌;
17、(3)表达lgox-riad的大肠杆菌和表达katg-ridd的大肠杆菌分别培养、诱导表达和纯化,获得重组蛋白lgox-riad和重组蛋白katg-ridd;
18、(4)将重组蛋白lgox-riad和重组蛋白katg-ridd混合获得酶自组装复合物。
19、在某些实施方式中,步骤(1)中,所述l-谷氨酸氧化酶利用连接肽(ggggs)n连接riad短肽,n为4、5或6。本发明中katg的尺寸较大,当linker为(ggggs)3时,lgox无法成功进入katg二聚体之间的间隙,阻碍了lgox融合的riad与katg融合的ridd的结合,最终阻碍了三联体酶复合物的成功形成。因此本发明延长连接linker长度促进组装的形成。
20、在某些实施方式中,步骤(1)中,所述过氧化氢酶利用连接肽(ggggs)n连接ridd短肽,n为4、5或6。
21、在某些实施方式中,步骤(1)中,l-谷氨酸氧化酶的来源包括但不限于加纳链霉菌(streptomyces ghanaensis)。
22、进一步,所述l-谷氨酸氧化酶的氨基酸序列如seq id no:4所示,编码所述l-谷氨酸氧化酶的基因的核苷酸序列如seq id no:3所示。
23、在某些实施方式中,步骤(1)中,所述过氧化氢酶来源包括但不限于大肠杆菌(escherichia coli)。
24、进一步地,所述过氧化氢酶的氨基酸序列如seq id no:6所示,编码所述l-谷氨酸氧化酶的基因的核苷酸序列如seq id no:5所示。
25、在某些实施方式中,所述riad的氨基酸序列如seq id no:8所示,编码所述riad的基因的核苷酸序列如seq id no:7所示。
26、在某些实施方式中,所述ridd的氨基酸序列如seq id no:10所示,编码所述ridd的基因的核苷酸序列如seq id no:9所示。
27、在某些实施方式中,所述连接肽的基本单元(ggggs)的氨基酸序列如seq id no:12所示,编码所述连接肽的基本单元(ggggs)的基因的核苷酸序列如seq id no:11所示。
28、在某些实施方式中,步骤(2)中,所述表达载体为包括但不限于pet28a。
29、在某些实施方式中,步骤(3)中,所述大肠杆菌为大肠杆菌bl21(de3)。
30、在某些实施方式中,步骤(4)中,所述重组蛋白lgox-riad和重组蛋白katg-ridd的化学计量比为1:2。
31、本发明提供的第三个技术方案为一种多酶级联体系转化4-hil的方法,所述方法为以l-异亮氨酸及l-谷氨酸为出发底物,利用第一个技术方案所述的酶自组装复合物和l-异亮氨酸双加氧酶级联催化生成4-hil。
32、在某些实施方式中,所述方法采用下述(1)或(2)的转化体系:
33、(1)两步法
34、所述转化体系包含:l-谷氨酸钠、l-异亮氨酸、feso4·7h2o、l-抗坏血酸、酶自组装复合物和l-异亮氨酸双加氧酶;所述l-谷氨酸钠的浓度为50~300mm,所述l-异亮氨酸浓度为50~300mm,所述feso4·7h2o浓度为1~5mm、所述l-抗坏血酸浓度为10~50mm,所述l-异亮氨酸双加氧酶浓度为0.1~1mg·ml-1,所述酶自组装复合物的l-谷氨酸氧化酶的浓度为0.1~1mg·ml-1,所述过氧化氢酶的浓度为l-谷氨酸氧化酶两倍摩尔浓度;
35、所述转化过程分为两个阶段:所述级联催化反应第一阶段是共底物α-kg的生产,按照上述浓度,以l-谷氨酸钠作为底物,以强亲和力短肽介导的酶自组装复合物作为催化剂,其中自组装酶的l-谷氨酸氧化酶用于催化l-谷氨酸钠生产α-kg,自组装酶的过氧化氢酶用于原位消除l-谷氨酸氧化酶催化过程中的副产物过氧化氢,反应后的溶液煮沸10min灭活后备用;
36、所述级联催化反应第二阶段是4-羟基异亮氨酸的合成,以第一阶段中反应的溶液作为起始反应溶液以提供共底物α-kg,按照上述浓度,向其中加入l-异亮氨酸、feso4·7h2o、l-抗坏血酸和l-异亮氨酸双加氧酶进行转化反应。
37、(2)一锅法
38、所述“一锅法”级联催化指在一个转化体系中同时进行α-kg的再生和氨基酸的羟基化,由l-谷氨酸钠、l-异亮氨酸、feso4·7h2o、l-抗坏血酸、酶自组装复合物和l-异亮氨酸双加氧酶构成转化体系,所述l-谷氨酸钠的浓度为50~300mm,所述l-异亮氨酸浓度为50~300mm,所述feso4·7h2o浓度为1~5mm、所述l-抗坏血酸浓度为10~50mm、所述l-异亮氨酸双加氧酶浓度为0.1~1mg·ml-1,所述酶自组装复合物的l-谷氨酸氧化酶浓度为0.1~1mg·ml-1,其对应的过氧化氢酶浓度为l-谷氨酸氧化酶两倍摩尔浓度。
39、在某些实施方式中,所述转化体系(1)或(2)将底物及酶添加到ph 7.0~8.0的tris-hcl溶液中进行转化反应。
40、在某些实施方式中,所述转化体系(1)中转化的温度为25~35℃,ph为7.0~8.0,第一阶段转化时间为2~9h,第二阶段转化时间为2~9h,转速为200~400rpm。
41、在某些实施方式中,所述转化体系(2)中转化的温度为25~35℃,ph为7.0~8.0,转化时间为2~9h,转速为200~400rpm。
42、在某些实施方式中,酶混合组装组合物还包括含有tris-hcl、edta和tween-20的缓冲液;所述tris-hcl的ph为7.0;所述edta浓度为1mm;所述tween-20的浓度为0.02%。
43、本发明第四个技术方案为第一个技术方案所述的酶自组装复合物、第二个技术方案所述的方法或者第三个技术方案所述的方法在生产4-hil中的应用。
44、相比于现有技术,有益效果如下:
45、本发明方法具有环境友好,经济简便的优势,利用酶自组装复合物参与的多酶级联体系为双加氧酶供给共底物的方法,在多酶级联反应体系生产4-hil。l-异亮氨酸及l-谷氨酸为出发底物,利用l-异亮氨酸双加氧酶、l-谷氨酸氧化酶和过氧化氢酶级联催化生成4-hil,通过riad-ridd短肽之间特异性强亲和力作用,实现l-谷氨酸氧化酶和过氧化氢酶的自组装,形成酶自组装复合物,原位消除l-谷氨酸氧化酶催化过程中产生的副产物过氧化氢,避免过氧化氢对双加氧酶的活性抑制。以一锅式方法制备(2s,3r,4s)-4-羟基异亮氨酸,在100mm异亮氨酸浓度下,7小时的转化率>95%,时空产率为2g·l-1·h-1。
- 还没有人留言评论。精彩留言会获得点赞!