一种生物抗病产品的制备和应用的制作方法
本发明涉及微生物,尤其涉及一种生物抗病产品的制备和应用。
背景技术:
1、在农业领域,微生物抗病技术已经逐步应用广泛;微生物抗病技术核心在于发现抗病菌种,难点在于如何展现和评价发现的菌种具有抗病性;通常在研究抗病菌种时候,研发人员会采用“平板对峙法”来判断和评价菌种对病原菌是否具有抗病性,以及抗病性的大小,即抑制率,然而常用的抗病对峙方法不但对操作环境及培养条件的要求非常苛刻,需要生物专业人员,在超净台的无菌环境,专业操作,需要培养箱,设定温度,培养菌种,且准备时间长,存放时间短:病原菌和有益菌落、菌饼都要提前3-7天准备,且存放不超过1周时间,因此,亟需一种具有直观化、科普化、方便化以及省时化特点的生物抗病产品,以满足市场应用需求。
2、中国专利公开号:cn112980691a,公开了一种快速准确筛选植物病原真菌拮抗细菌菌株的方法,其技术点是先采用梯度稀释法与划线纯化法获得细菌菌株并进行纯化,然后采用点接法和平板对峙培养法初筛出拮抗细菌,最后采用改良的平板对峙培养法和十字定位法,测量菌落半径和抑菌带的大小;由此可见,现有的抗病对峙方法仍然需要生物专业人员,在超净台的无菌环境,专业操作,使抗病性检测方法很难走出实验室,让大众看到抗病效果,因此,为了避免常规抗病对峙方法对操作环境及培养条件的苛刻要求,本发明利用海藻酸钠与氯化钙包埋病原菌或有益菌形成微胶囊菌球,使病原菌或有益菌与外部环境隔绝以保持其生物活性的同时,染菌风险、抑制生长风险以及操作复杂度均显著降低,甚至在产品的使用上外行也能够轻松成功操作,其稳定、高效、便携的特点适合生物抗病产品的推广、工业化生产及多场景应用。
技术实现思路
1、为此,本发明提供一种生物抗病产品的制备和应用,用以克服现有技术中的由于常规抗病对峙方法对操作环境及培养条件的苛刻要求,使病原菌或有益菌难以长期保存,导致生物抗病产品适用性低的问题。
2、为实现上述目的,本发明提供一种生物抗病产品的制备和应用,包括,
3、进一步地,包括制备病原菌微胶囊、有益菌微胶囊以及培养基,其中,制备病原菌微胶囊和有益菌微胶囊包括,
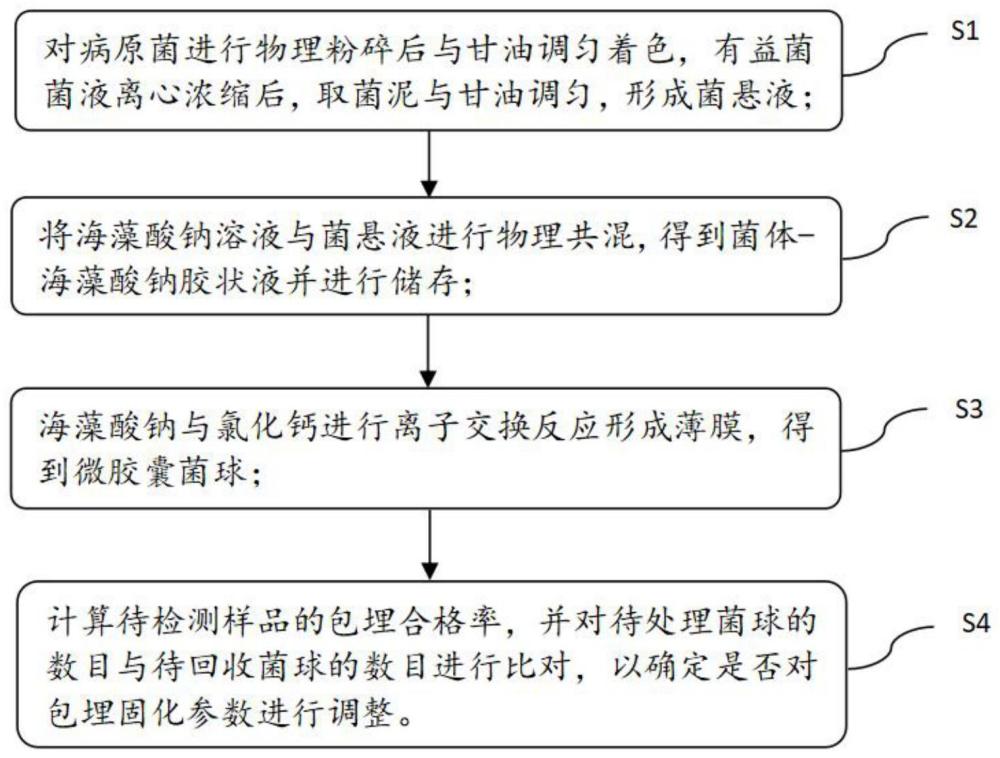
4、步骤s1.1,对病原菌进行物理粉碎后与甘油调匀着色,有益菌菌液离心浓缩后,取菌泥直接与甘油调匀,形成菌悬液;
5、在步骤s1.2中,将海藻酸钠溶液与菌悬液进行物理共混,得到菌体-海藻酸钠胶状液并进行储存;
6、步骤s1.3,在预设压力条件下抽出所述储料器中的菌体-海藻酸钠胶状液作为待处理菌液,使其通过花洒器并以预设降落高度注入至搅拌状态下的氯化钙溶液中进行交联反应,以在空气中固化形成微球,以及对微球进行包埋处理形成包覆在微球表面的薄膜,过滤清洗后,得到微胶囊菌球;
7、步骤s1.4,对一批次的微胶囊菌球进行包埋合格率检测,随机选取预设抽取个数的微胶囊菌球作为待检测样品,通过对待检测样品的实时厚度值与标准厚度值的差值与标准厚度差值进行比对,以及对任一待检测样品的实时厚度值与标准厚度值进行比对,确定该批次的微胶囊菌球的包埋合格率,并将待处理菌球的数目与待回收菌球的数目进行比对,以确定是否对包埋固化参数进行调整。
8、进一步地,在步骤s1.1中,在步骤s1.1中,在预设离心条件下分别对病原菌和有益菌进行物理粉碎,粉碎后的病原菌加入甘油进行混合调匀,再加入色素使其着色,获得病原菌菌悬液,粉碎后的有益菌配置为有益菌菌液进行离心浓缩,分离出有益菌菌泥直接加入甘油调匀,获得有益菌菌悬液。
9、进一步地,所述步骤s1.2中,通过将海藻酸钠溶解于去离子水中,并进行加热搅拌,以配置预设第一浓度的海藻酸钠溶液,将所述海藻酸钠溶液定量加入所述各菌悬液进行搅拌,混匀后静置得到菌体-海藻酸钠胶状液,将菌体-海藻酸钠胶状液转移至储料器进行储存。
10、进一步地,所述步骤s1.3中,在预设压力条件下抽出所述储料器中的菌体-海藻酸钠胶状液作为待处理菌液,并使其通过花洒器以微球形态经过预设降落高度注入至搅拌状态下的预设第二浓度的氯化钙溶液中,以预设反应时长进行旋转交联,以对菌体进行包埋处理形成包覆在微球表面的薄膜,过滤清洗后,得到微胶囊菌球。
11、进一步地,所述步骤s1.4中,设定标准厚度差值,对任意一批次的微胶囊菌球进行包埋合格率检测,通过红外检测仪获取各待检测样品的海藻酸钙盐膜的实时厚度值,计算任一待检测样品的实时厚度值与标准厚度值的差值的绝对值,得到该待检测样品的实时厚度差值,并根据标准厚度差值对实时厚度差值进行判定,若实时厚度差值大于标准厚度差值,判定该待检测样品不合格,将该待检测样品的实时厚度值与标准厚度值进行对比,以确定该待检测样品的包埋固化层的厚度状态。
12、进一步地,设定标准厚度值,在判定实时厚度差值大于标准厚度差值时,获取该待检测样品的实时厚度值并与标准厚度值进行对比,以对该待检测样品进行标记。
13、进一步地,设定标准包埋合格率,计算合格样品数目占待检测样品总数目的百分比,得到该批次微胶囊菌球的实时包埋合格率,并根据标准包埋合格率对实时包埋合格率进行对比,
14、若实时包埋合格率小于标准包埋合格率,通过称重筛选出不合格的微胶囊菌球,并将待处理菌球的数目与待回收菌球的数目进行比对,以选择对包埋固化参数条件的调节方式。
15、进一步地,在判定实时包埋合格率小于标准包埋合格率时,将实时厚度值小于标准厚度值的微胶囊菌球标记为待处理菌球,将实时厚度值大于标准厚度值的微胶囊菌球标记为待回收菌球,将待处理菌球的数目与待回收菌球的数目进行比对,
16、若待处理菌球的数目大于待回收菌球,则将待处理菌球继续注入氯化钙溶液中以第一修正反应时长进行交联反应,并重复上述根据标准厚度差值对实时厚度差值进行判定的操作,若判定该待处理菌球不合格,则对预设第二浓度进行调整;
17、若待处理菌球的数目等于待回收菌球,则对预设第二浓度与预设第一浓度均进行调整,将待处理菌球继续注入氯化钙溶液中以预设反应时长进行交联反应,并重复上述根据标准厚度差值对实时厚度差值进行判定的操作;
18、若待处理菌球的数目小于待回收菌球,则将待处理菌球继续注入氯化钙溶液中以第二修正反应时长进行交联反应,并重复上述根据标准厚度差值对实时厚度差值进行判定的操作,若判定该待处理菌球不合格,则对预设第一浓度进行调整。
19、进一步地,制备培养基包括,
20、步骤s2.1,lb培养基,加水稀释,预设灭菌条件下进行灭菌,得到无菌培养液;
21、步骤s2.2,预设转移温度下将无菌培养液倒入培养皿,培养皿直径为7厘米;
22、步骤s2.3,待培养皿中的培养液凝固后,得到培养基,其用保鲜膜包好备用,两个一组。
23、本发明还提供所述制备的微胶囊菌球与所述培养基在生物抗病检测中的应用,所述制备的微胶囊菌球与所述培养基作为生物抗病产品在平板对峙法中应用。
24、与现有技术相比,本发明的有益效果在于,通过对病原菌和有益菌进行包埋处理,并进行颜色区分,包括将病原菌或有益菌粉碎并使用甘油调匀着色后与海藻酸钠混匀,再通过氯化钙与海藻酸钠交联反应及过滤分离,形成薄膜包覆的球状细菌颗粒,经过去离子水清洗得到微胶囊菌球;即为了避免常规抗病对峙方法对操作环境及培养条件的苛刻要求,通过制备微胶囊菌球,使胶囊内菌数长达8个月未曾下降,延长了对菌种的保存时长,随时取用,增加了使用的便捷性,且由于一个微胶囊菌球内的菌数达到亿级以上,远远高于常规单个菌落,即具备生物量优势,避免进行对峙试验时出现染菌风险,而微胶囊的组分又包括强保水剂海藻酸钠,不但能够与病原菌或有益菌形成菌体-海藻酸钠胶状液,使其以微珠形态在氯化钙溶液中发生离子交换反应,形成包覆在微胶囊表面的膜结构,而且能够保护培养细胞不易脱水,保护菌种的活性功能,进而提高了产品的检测性能及应用潜力。
25、进一步地,通过将菌悬液与海藻酸钠溶液充分混合均匀,为下一步利用海藻酸钠与氯化钙反应形成薄膜以对菌体进行包埋处理提供受体条件的同时,由于海藻酸钠分子结构中的羟基能够保护菌体不易失水,保障了菌体的生物活性。
26、进一步地,通过利用海藻酸钠与氯化钙的离子交换反应生成海藻酸钙盐,使其包覆在待处理菌液微球液滴表面形成一层薄膜,通过定时滤出菌球,并用去离子水清洗多余的海藻酸钙盐,避免海藻酸钠与氯化钙的持续进行离子交换反应生成更多的海藻酸钙盐,导致形成的膜厚度增加,保障抗病性测试有效开展,即形成一层薄膜,不但能够密封包裹内部的菌体,而且使其具有球体软弹的特性,因此能够在进行抗病性试验时,使膜内部的菌体快速释放生长,达到监测及评价细菌的对抗效果,且由于海藻酸钠的保水特性,延长了对菌种的保存时长,使胶囊内菌数长达8个月未曾下降,进行抗病性试验的成功率显著增加,对抗效果明显,其中,用6个月以内的珠子效果最好。
27、进一步地,通过对待检测样品的实时厚度值进行检测,并与设定的标准厚度值进行对比,筛选出经过包埋固化处理的不合格样品与合格样品,即根据包埋处理形成海藻酸钙盐的厚度,将包覆膜厚度较大及较小的样品筛选出,以确定该批次的产品的包埋合格率,将根据包覆膜厚度调整氯化钙溶液的浓度或海藻酸钠溶液的浓度,使下一批次的微胶囊菌球的规格满足要求,保证微胶囊菌球包覆膜的机械强度不但足以保护菌球内部菌体的生物活性,而且适合进行抗病性检测时菌球内部菌体能够及时流出,进而保障抗病性测试的成功率。
28、进一步地,通过将不合格样品的实时膜厚度与标准膜厚度进行对比,以对不合格样品的膜厚度进行分析,若判定实时厚度值小于标准厚度值,表示该微胶囊球菌的包埋固化处理不充分,可能是由于氯化钙浓度低导致微珠中的海藻酸根离子对钙离子的捕捉能力低,也可能是由于交联时间短导致微珠中的海藻酸根离子与钙离子未能充分结合形成海藻酸钙盐,若判定实时厚度值大于标准厚度值,表示该微胶囊球菌的包埋固化处理强度过高,可能是由于交联时间长导致钙离子与微珠中的海藻酸根离子持续反应积累了更多的海藻酸钙盐,使膜厚度增加,也可能是由于海藻酸钠溶液的浓度过高,使利用海藻酸钠对微球包埋处理形成的膜厚度明显增加,通过对不合格样品依次称重,筛选出增重不明显的样品,即膜厚度小于标准厚度值的样品,再次注入氯化钙溶液中进行包埋处理,减少材料浪费且操作简单。
29、进一步地,通过对待检测样品中的待处理菌球的数目与待回收菌球的数目进行比对,分析该批次微胶囊菌球膜厚度形成情况,若待处理菌球的数目大于待回收菌球,表示该批次微胶囊菌球膜厚度值普遍较小,则先通过延长交联反应时长的调整方式对包埋处理进行优化,若这种调整方式无效,则通过增大氯化钙溶液的浓度,使海藻酸根离子与钙离子结合生成的海藻酸钙以增加膜厚度,若待处理菌球的数目小于待回收菌球,表示该批次微胶囊菌球膜厚度值普遍较大,则先通过减小交联反应时长对包埋处理进行优化,若有效,直接简便地优化包埋处理方法,若无效,则通过减小海藻酸钠溶液的浓度,减小菌球的固化程度,精准优化包埋方法,提高微胶囊菌球的生产合格率,若判定待处理菌球的数目等于待回收菌球,表示该批次微胶囊菌球膜厚度值差异大,无法简单通过改变反应时间达到优化方法的效果,直接对各浓度条件进行调整,优化包埋处理方法。
- 还没有人留言评论。精彩留言会获得点赞!