一种用于间充质干细胞封装的自组装聚合物材料及其制备方法与应用
本发明属于生物科学,具体涉及一种用于间充质干细胞封装的自组装聚合物材料及其制备方法与应用。
背景技术:
1、细胞表面封装是一种将细胞包裹在由聚合物形成的半透膜或水凝胶等封装层内的技术。封装层既能有效阻挡外界大尺寸物质与封装细胞的直接接触,避免免疫细胞和酶等攻击;又能保证氧气、营养物质等小尺寸物质的自由交换,维持细胞各项生物学活动和正常功能。细胞表面封装技术被认为在单细胞层面的样品处理和异体细胞移植中具有巨大应用前景。
2、目前,封装细胞的聚合物材料往往是通过单体聚合而成,所形成的封装层稳定性不高,且具有一定的细胞毒性,因此寻找良好生物相容性的封装材料是细胞封装的重要发展方向。其中以海藻酸钠、透明质酸等高生物相容性的天然高分子材料作为基质,通过离子螯合、共价交联等制备的细胞封装层可以维持封装细胞的正常生长和功能,于是构建以天然聚合物为基质的涂层成为细胞封装的研究重点。目前,通过天然高分子材料制备细胞涂层的方法包括以下几种:①微流控技术,借助微流控装置构建凝胶微球,实现单细胞封装。david mooney将微流控装置与海藻酸钠结合,成功在间充质干细胞(mscs)表面构建涂层结构;②层层自组装技术,通常是利用静电吸引、分子生物识别、氢键结合等作用将2种甚至多种高分子依次交替的沉积在细胞表面形成高分子膜,从而实现细胞的纳米封装。davidmills将带正电荷的聚赖氨酸和带负电的透明质酸(ha)通过静电作用吸附在单个msc表面,该封装mscs维持细胞完整形貌和活性长达一周以上。
3、上述报道的制备方法,虽然成功地在细胞外构建涂层结构,但在处理过程中存在技术性缺点:①微流控技术制备方法存在设备依赖性,且水油两相界面处不可避免地存在“细胞逃逸”现象,导致封装效率低;②聚阳离子会破坏细胞膜表面磷脂双分子层,导致细胞表面孔洞的形成,从而释放出细胞质内的酶,致使细胞活性降低甚至死亡。因此,目前亟需开发一种更安全、更简单快捷的用于封装细胞的聚合物材料以解决上述技术问题。
技术实现思路
1、本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种自组装聚合物材料,能够在不依赖设备的条件下,通过透明质酸的靶向作用完成材料对细胞的吸附固定,同时借助自组装基元完成聚合物在细胞表面的原位封装。
2、本发明还提出上述自组装聚合物材料的制备方法。
3、本发明还提出上述自组装聚合物的应用。
4、本发明还提出了一种自组装天然高分子纳米纤维。
5、本发明还提出了一种用于细胞封装的聚合物涂层。
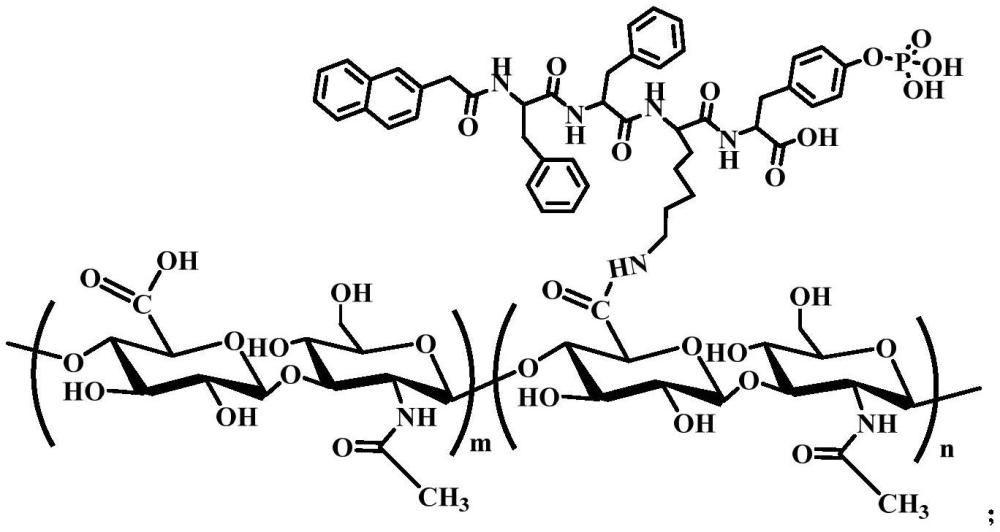
6、根据本发明的第一方面,提供了一种自组装聚合物材料,包括透明质酸主链和短肽侧链,所述自组装聚合物材料结构式如下:
7、
8、其中,248≤m≤319,53≤n≤124。
9、根据本发明的第二方面,提供了一种本发明第一方面所述自组装聚合物材料的制备方法,包括以下步骤:
10、s1:将透明质酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺溶于溶剂中,并充分反应,得到透明质酸溶液;
11、s2:将短肽溶液和步骤s1得到的透明质酸溶液混合,得到反应液;
12、s3:将步骤s2得到的反应液进行透析,收集透析后得到的液相,即为自组装聚合物材料。
13、在本发明的一些实施方式中,步骤s2所述短肽的结构包括:萘-苯丙氨酸-苯丙氨酸-赖氨酸-磷酸化酪氨酸残基。
14、在本发明的一些实施方式中,步骤s1所述透明质酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺的摩尔比为1:(1~2):(1~2)。
15、在本发明的一些优选的实施方式中,步骤s1所述透明质酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺和n-羟基琥珀酰亚胺的摩尔比为2:3:3。
16、在本发明的一些实施方式中,步骤s1所述溶剂包括甲酰胺。
17、在本发明的一些实施方式中,步骤s1所述透明质酸先加入溶剂中,充分溶解后再加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)进行反应。
18、在本发明的一些优选的实施方式中,步骤s1所述透明质酸加入溶剂后的溶解条件包括:40~70℃下搅拌溶解0.5~2h。
19、在本发明的一些更优选的实施方式中,步骤s1所述透明质酸加入溶剂后的溶解条件包括:50℃下搅拌溶解1h。
20、在本发明的一些优选的实施方式中,步骤s1所述edc和nhs加入溶剂后的反应条件包括:0~5℃下反应20~40min。
21、在本发明的一些更优选的实施方式中,步骤s1所述edc和nhs加入溶剂后的反应条件包括:0℃下反应30min。
22、在本发明的一些实施方式中,步骤s2所述短肽溶液的溶剂选自甲酰胺、n,n-二甲基甲酰胺、二甲基亚砜中的至少一种。
23、在本发明的一些优选的实施方式中,步骤s2所述短肽溶液的溶剂为n,n-二甲基甲酰胺。
24、在本发明的一些实施方式中,步骤s2所述透明质酸与短肽的反应基团比为(6~2):1。
25、在本发明的一些优选的实施方式中,步骤s2所述透明质酸与短肽的反应基团比为(5~3):1。
26、在本发明的一些更优选的实施方式中,步骤s2所述透明质酸与短肽的反应基团比为4:1。
27、在本发明的一些实施方式中,步骤s2所述混合包括将短肽溶液逐滴滴加到透明质酸溶液中的步骤。
28、在本发明的一些实施方式中,步骤s2所述反应液的反应条件包括:室温(20~30℃)下反应10~14h。
29、在本发明的一些优选的实施方式中,步骤s2所述反应液的反应条件包括:20℃下反应12h。
30、在本发明的一些实施方式中,步骤s3所述透析使用的透析装置包括:透析袋、透析管、透析桶、透析片。
31、在本发明的一些优选的实施方式中,步骤s3所述透析使用的透析装置为:透析袋。
32、在本发明的一些更优选的实施方式中,步骤s3所述透析使用的透析装置为:截留分子量为12~16kda的透析袋。
33、在本发明的一些更优选的实施方式中,步骤s3所述透析使用的透析装置为:截留分子量为14kda的透析袋。
34、在本发明的一些实施方式中,步骤s3还包括将透析装置置于沸水中预处理5-15min的步骤。
35、在本发明的一些优选的实施方式中,步骤s3还包括将透析装置置于沸水中预处理10min的步骤。
36、在本发明的一些实施方式中,步骤s3所述透析使用的透析液包括n,n-二甲基甲酰胺和去离子水。
37、在本发明的一些优选的实施方式中,步骤s3所述透析使用的透析液还包括n,n-二甲基甲酰胺和去离子水以1:2体积比混合的混合液。
38、在本发明的一些实施方式中,步骤s3所述透析包括:将反应液转移到透析装置中,以n,n-二甲基甲酰胺和去离子水以1:2体积比混合的混合液为透析液,透析4~8h,重复换液透析2~4次;再将透析液换为去离子水,透析20~28h,重复换液透析1~3次。
39、在本发明的一些优选的实施方式中,步骤s3所述透析包括:将反应液转移到透析装置中,以n,n-二甲基甲酰胺和去离子水以1:2体积比混合的混合液为透析液,透析6h,重复换液透析3次;再将透析液换为去离子水,透析24h,重复换液透析2次。
40、在本发明的一些实施方式中,步骤s3还包括将所得液相进行干燥的步骤。
41、在本发明的一些优选的实施方式中,所述干燥包括冷冻干燥、常压干燥、减压干燥、喷雾干燥。
42、在本发明的一些更优选的实施方式中,所述干燥为冷冻干燥。
43、根据本发明的第三方面,提供了本发明第一方面所述自组装聚合物材料和/或本发明第二方面所述制备方法制备得到的自组装聚合物材料在(1)~(2)任一项中的应用:
44、(1)制备由短肽驱动的自组装天然高分子纳米纤维;
45、(2)制备用于细胞封装的聚合物涂层。
46、在本发明的一些实施方式中,所述细胞包括原核细胞、真核细胞、哺乳动物细胞、非哺乳动物细胞、干细胞及其组合。
47、在本发明的一些优选的实施方式中,所述细胞为间充质干细胞。
48、在本发明的一些实施方式中,所述用于封装细胞的聚合物涂层包括水凝胶、囊泡、半透膜。
49、在本发明的一些优选的实施方式中,所述封装细胞的聚合物涂层为水凝胶。
50、根据本发明的第四方面,提供了一种自组装天然高分子纳米纤维,所述自组装天然高分子纳米纤维由本发明第一方面所述的自组装聚合物材料和/或本发明第二方面所述的制备方法制备得到的自组装聚合物材料制备得到。
51、在本发明的一些实施方式中,所述自组装天然高分子纳米纤维的制备方法包括以下步骤:将上述自组装聚合物溶于缓冲液中,再加入碱性磷酸酶溶液,充分反应后即得自组装天然高分子纳米纤维。
52、在本发明的一些优选的实施方式中,所述缓冲液包括:磷酸缓冲盐溶液(pbs)、tris-hcl缓冲液(ph 8.0)。
53、在本发明的一些更优选的实施方式中,所述缓冲液为:0.01mol/l pbs。
54、在本发明的一些优选的实施方式中,所述自组装聚合物溶于缓冲液后的终浓度为:0.05~1.5wt%。
55、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于缓冲液后的终浓度为:0.1~1wt%。
56、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于缓冲液后的终浓度为:0.25~1wt%。
57、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于缓冲液后的终浓度为:0.5~1wt%。
58、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于缓冲液后的终浓度为:0.75~1wt%。
59、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于缓冲液后的终浓度为:1wt%。
60、在本发明的一些优选的实施方式中,所述碱性磷酸酶溶液的溶剂包括pbs、生理盐水和tris-hcl缓冲液(ph 8.0)中的至少一种。
61、在本发明的一些更优选的实施方式中,所述碱性磷酸酶溶液的溶剂为tris-hcl缓冲液(ph 8.0)。
62、在本发明的一些优选的实施方式中,所述碱性磷酸酶溶液在反应体系中的终浓度为0.05~0.2u/ml。
63、在本发明的一些更优选的实施方式中,所述碱性磷酸酶溶液在反应体系中的终浓度为0.1u/ml。
64、在本发明的一些优选的实施方式中,所述充分反应的条件包括:在35~39℃下,以500~700rpm的速度振荡反应1~3h。
65、在本发明的一些更优选的实施方式中,所述充分反应的条件包括:在37℃下,以550~650rpm的速度振荡反应2h。
66、在本发明的一些更优选的实施方式中,所述充分反应的条件包括:在37℃下,以600rpm的速度振荡反应2h。
67、在本发明的一些优选的实施方式中,所述自组装天然高分子纳米纤维的制备方法还包括在充分反应后加入醇类溶剂以终止酶促反应的步骤。
68、在本发明的一些更优选的实施方式中,所述自组装天然高分子纳米纤维的制备方法还包括在充分反应后加入甲醇以终止酶促反应的步骤。
69、根据本发明的第五方面,提供了一种用于细胞封装的聚合物涂层,所述用于细胞封装的聚合物涂层由本发明第一方面所述的自组装聚合物材料和/或本发明第二方面所述的制备方法制备得到的自组装聚合物材料制备得到。
70、在本发明的一些实施方式中,所述细胞包括原核细胞、真核细胞、哺乳动物细胞、非哺乳动物细胞、干细胞及其组合。
71、在本发明的一些优选的实施方式中,所述细胞为间充质干细胞。
72、在本发明的一些实施方式中,所述用于细胞封装的聚合物涂层包括水凝胶、囊泡、半透膜。
73、在本发明的一些实施方式中,所述用于细胞封装的聚合物涂层的制备方法包括以下步骤:将上述自组装聚合物溶于完全培养基中,得到混合液;将混合液加入细胞培养体系中孵育;去除混合液,再加入新鲜完全培养基和碱性磷酸酶溶液充分反应;最后吸出培养上清,用缓冲液清洗细胞,即得用于细胞封装的聚合物涂层。
74、在本发明的一些优选的实施方式中,所述自组装聚合物溶于完全培养基后的终浓度为0.1~1.5wt%。
75、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于完全培养基后的终浓度为0.25~1wt%。
76、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于完全培养基后的终浓度为0.5~1wt%。
77、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于完全培养基后的终浓度为0.75~1wt%。
78、在本发明的一些更优选的实施方式中,所述自组装聚合物溶于完全培养基后的终浓度为1wt%。
79、在本发明的一些优选的实施方式中,所述完全培养基包括基础培养基和胎牛血清。
80、在本发明的一些更优选的实施方式中,所述基础培养基包括:imdm培养基、bme培养基、mem培养基、dmem培养基,ham's f-12培养基、rpmi1640培养基、fischer's培养基、dmem/f12培养基、scgm培养基中的至少一种。
81、在本发明的一些更优选的实施方式中,所述基础培养基为dmem培养基。
82、在本发明的一些优选的实施方式中,所述孵育的条件包括在35~39℃下孵育20~40min。
83、在本发明的一些更优选的实施方式中,所述孵育的条件包括在37℃下孵育30min。
84、在本发明的一些优选的实施方式中,所述碱性磷酸酶溶液在反应体系中的终浓度为0.05~0.2u/ml。
85、在本发明的一些更优选的实施方式中,所述碱性磷酸酶溶液在反应体系中的终浓度为0.1u/ml。
86、在本发明的一些优选的实施方式中,所述充分反应的条件包括:在35~39℃下反应0.5~2h。
87、在本发明的一些更优选的实施方式中,所述充分反应的条件包括:在37℃下反应1h。
88、在本发明的一些优选的实施方式中,所述碱性磷酸酶溶液的溶剂包括pbs、生理盐水和tris-hcl缓冲液(ph 8.0)中的至少一种。
89、在本发明的一些更优选的实施方式中,所述碱性磷酸酶溶液的溶剂为tris-hcl缓冲液(ph 8.0)。
90、在本发明的一些优选的实施方式中,所述碱性磷酸酶溶液在反应体系中的终浓度为0.05~0.2u/ml。
91、在本发明的一些更优选的实施方式中,所述碱性磷酸酶溶液在反应体系中的终浓度为0.1u/ml。
92、在本发明的一些优选的实施方式中,所述缓冲液包括pbs。
93、本发明至少具有以下有益效果:
94、本发明提供了一种自组装聚合物材料,由透明质酸主链和短肽侧链组成,通过外加的碱性磷酸酶切割短肽中酪氨酸残基上的磷酸基团,变成苯酚结构,增强了苯环之间的强的相互作用力,使其自发形成了各向异性的纳米纤维,以此作为驱动开关,引发自组装过程,牵引着主链透明质酸基团形成网状交联结构。本发明提供的自组装材料能够用于制备由短肽驱动的自组装天然高分子纳米纤维以及封装间充质干细胞的水凝胶涂层。天然聚合物透明质酸能够与间充质干细胞表面的膜蛋白cd44特异性结合,将聚合物修饰于细胞表面,在外加酶的作用下发生物理交联形成高分子水凝胶结构。并且,制备过程中所用原料均属于天然材料,具有生理相容性且反应过程在温和的条件下,有利于维持细胞正常功能和活力,用于进一步的工程化修饰,应用范围广。
- 还没有人留言评论。精彩留言会获得点赞!