一种通过金催化的不对称环加成反应及动力学拆分合成手性氮杂八元环类化合物的方法与流程
本发明涉及一种通过金催化的不对称环加成反应及动力学拆分合成手性氮杂八元环类化合物的方法,属于有机合成。
背景技术:
1、手性氮杂八元骨架广泛存在于活性天然产物和药物分子中,例如具有抗菌活性的fr-900482,抗肿癌作用的manzamine a和良好的镇痛作用的吲哚生物碱类天然产物apparicine。然而,这类骨架化合物仅仅通过自然界的分离很难获得,而且具有含量少成本高等缺点。因此,通过不对称合成的方法获得这类天然产物是一种非常有前景的方法。近几十年,通过过渡金属催化的偶极离子环加成的方法,可以一步反应生成多个碳-碳或碳-杂原子键,具有高原子经济性和高步骤经济性的优点,已成为构建各种环状化合物的通用方法。在该反应过程,通常仅仅利用简单的结构单元,就可以一步完成多个环的高效构建。在手性控制的过程,通过手性配体与过渡金属的结合,可以一步反应完成多个手性中心的控制,完成天然产物核心骨架的不对称高效构建。
2、基于文献调研,我们发现近几年构建氮杂八元环化合物的策略主要通过钯催化或者铱催化的烯丙基化反应来构建氮杂八元环,然而通过新的催化体系和催化模式来构建氮杂八元环化合物的方法还没有报道。因此设计开发新的催化反应来构建氮杂八元环化合物具有重要的现实意义。动力学拆分可以将消旋化合物转化成高光学活性的手性分子,是一种高效且应用广泛的不对称合成策略。但是动力学拆分过程由于拆分效率较低或者底物适用范围较窄,这极大影响了该策略的发展与应用。在过去的几十年里,随着手性催化剂和手性配体的快速发展,动力学拆分策略开始广泛运用于不对称催化领域,进而获得优异光学纯度的手性化合物。结合动力学拆分与不对称偶极环加成的优势,利用1,3-偶极环加成反应以实现高效动力学拆分获取手性杂环化合物已得到了较好发展(chin.j.org.chem.2022,42,3322-3334)。然而,关于动力学拆分下的1,4-偶极环加成反应构建手性杂环的报道较少。2012年,张俊良课题组报道了首例金催化的2-(1-炔基)-2-烷基-1-酮与硝酮的不对称[4+3]环加成反应,构建了七元氮杂环,同时实现了外消旋的1-(1-炔基)环丙基酮的动力学拆分(chem.commun.,2012,48,4710-4712)。然而通过金催化的[4+4]环加成反应获取手性氮杂八元环化合物,同时实现外消旋的1-(1-炔基)环丙基酮的高效动力学拆分的反应还没有报道。
3、氨茴内酐(anthranils)由于具有独特的共轭结构和强烈的芳构化驱动力,是一类非常活泼和重要的中间体,在天然产物骨架的构建和药物分子的合成过程中被广泛应用。在之前的工作中,我们课题组已经完成钯催化的γ-亚甲基-δ-戊内酯与氨茴内酐(anthranils)的不对称[4+4]环加成反应(acs catal.,2021,11,2684-2690)。因此,使用1-(1-炔基)环丙基酮生成1,4-偶极离子作为四元合成子,然后与氨茴内酐(anthranils)完成动力学拆分下的[4+4]环加成反应,实现呋喃稠合的苯并氮杂八元环的不对称高效构建,并且可以经过进一步结构修饰可以制备不同骨架的手性氮杂八元环,具有重要的意义。
技术实现思路
1、针对现有技术的不足,本发明提供了一种通过金催化的不对称环加成反应及动力学拆分合成手性氮杂八元环类化合物的方法。本发明以结构简单的手性金复合物作为催化体系,完成动力学拆分下的[4+4]环加成反应,实现手性氮杂八元环的高效不对称合成。
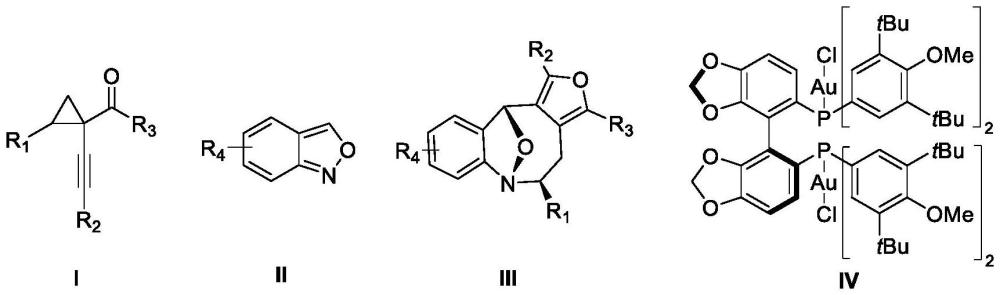
2、术语说明:
3、室温:具有本领域公知含义,指25±5℃。
4、本发明的技术方案如下:
5、一种通过金催化的不对称环加成反应及动力学拆分合成手性氮杂八元环类化合物的方法,包括步骤如下:
6、于溶剂a中,在金催化体系催化下,炔基环丙酮化合物ⅰ和氨茴内酐类化合物ⅱ经不对称[4+4]环加成反应及动力学拆分,得到手性氮杂八元环类化合物ⅲ;所述金催化体系由手性金催化剂和三氟甲磺酸银组成,所述手性金催化剂具有式ⅳ所示结构;
7、
8、其中,式ⅰ化合物结构式中,r1为苯基或卤素取代的苯基;r2选自取代或未取代的芳基、取代或未取代的杂芳基,所述杂芳基的杂原子为o、n或s,所述取代的芳基或取代的杂芳基的芳环上被1个或多个取代基r5取代,各个取代基r5各自独立的选自卤素、甲氧基、氰基;r3为甲基或乙基;
9、式ⅱ化合物结构式中,r4为卤素、c1-c3烷基、c1-c3烷氧基、苯甲酰基、硝基或酯基;
10、式ⅲ化合物结构式中,取代基r1、r2、r3与式ⅰ化合物结构式中相同;取代基r4与式ⅱ化合物结构式中相同。
11、根据本发明优选的,式ⅰ化合物结构式中,所述r1为苯基或4-溴苯基,r2为苯基、4-氟苯基、4-氯苯基、3-溴苯基、2-氟苯基、噻吩基,r3为甲基;
12、式ⅱ化合物结构式中,r4为卤素、苯甲酰基或硝基。
13、根据本发明优选的,所述溶剂a为二氯甲烷;所述溶剂a的体积与炔基环丙酮化合物ⅰ的摩尔数之比为5~20ml:1mmol;所述溶剂a经无水处理。
14、根据本发明优选的,所述炔基环丙酮化合物ⅰ和氨茴内酐类化合物ⅱ的摩尔比为1:0.5-0.8。
15、根据本发明优选的,所述金催化体系中手性金催化剂和三氟甲磺酸银的摩尔比为1:2~2.6;所述手性金催化剂与炔基环丙酮化合物ⅰ的摩尔比为0.01~0.05:1。
16、根据本发明优选的,所述炔基环丙酮化合物ⅰ和氨茴内酐类化合物ⅱ发生不对称[4+4]环加成反应及动力学拆分的反应体系中还加入分子筛;所述分子筛的质量与炔基环丙酮化合物ⅰ的摩尔数之比为1~3g:1mmol,其作用是进一步除去反应体系中微量的水。
17、根据本发明优选的,所述环加成反应及动力学拆分在保护性气体保护下进行,所述保护性气体为氮气或氩气。
18、根据本发明优选的,所述环加成反应及动力学拆分的温度为-20~30℃,进一步优选为20~30℃。
19、根据本发明优选的,所述环加成反应及动力学拆分的时间为12~48h,进一步优选为12~24h;反应过程中通过hplc监控反应进程,待体系中所得手性原料炔基环丙酮化合物的ee值>80%,则反应结束。
20、根据本发明,炔基环丙酮化合物ⅰ和氨茴内酐类化合物ⅱ经不对称[4+4]环加成反应及动力学拆分后,可按常规分离纯化方法进行产物分离和表征;具体反应后处理步骤如下:将反应液除去溶剂,所得粗品经硅胶柱层析分离得到手性氮杂八元环类化合物ⅲ,洗脱剂为乙酸乙酯和石油醚的混合溶剂,混合溶剂中乙酸乙酯和石油醚的体积比为0.02~0.2:1。
21、根据本发明,一种优选的实施方式,包括步骤如下:
22、在保护性气体保护下,在干燥的反应瓶中加入手性金催化剂和三氟甲磺酸银(agotf)和溶剂a,搅拌15~20min后过滤,将所得滤液加入装有炔基环丙酮化合物ⅰ、氨茴内酐类化合物ⅱ和分子筛的反应瓶中,进行不对称[4+4]环加成反应及动力学拆分;反应完成后,除去溶剂,所得粗品经硅胶柱层析分离得到手性氮杂八元环类化合物ⅲ。
23、本发明还提供了上述方法制备得到的手性氮杂八元环类化合物,所得手性氮杂八元环类化合物的结构式如式ⅲ所示。
24、
25、根据本发明,上述手性氮杂八元环类化合物在制备抗胃癌和食道癌药物中的应用。
26、根据本发明,所述炔基环丙酮化合物ⅰ由α,β-不饱和酮为起始原料通过已知方法得到(参见文献:chem.eur.j.2009,15,8975-8978.),反应路线如下所示:
27、
28、上式中,取代基r1、r2和r3如上所述。
29、根据本发明,所述氨茴内酐类化合物ⅱ均由相应的取代硝基芳基甲醛通过已知方法合成得到(参见文献:angew.chem.int.ed.2019,58,5739-5743.),反应路线如下式所示:
30、
31、上式中,取代基r4如上所述。
32、根据本发明,所述手性金催化剂的制备方法为现有技术,可参照文献(j.am.chem.soc.2005,127,18002-18003;j.am.chem.soc.2007,129,12638-12639.)制备。
33、本发明的技术特点及有益效果如下:
34、本发明创造性的提供了一种金催化不对称环加成反应及动力学拆分构建氮杂八元环化合物的新方法。本发明的方法具有以下优点:(1)以结构简单的手性金催化剂作为催化体系,具有催化剂成本低,效率高、催化剂的用量少的优点;(2)反应产率高、非对映选择性好(dr>20:1)、对映选择性高(95%ee);(3)反应原料价廉易得、原子经济性好、底物适用范围广泛;(4)反应条件温和、操作方便简洁;(5)本发明所得手性氮杂八元环类化合物对与胃癌细胞和食道癌细胞具有优异的抑制作用。
- 还没有人留言评论。精彩留言会获得点赞!