IFN-γ和TNF-α联合在作为制备诱导巨噬细胞向M1表型巨噬细胞极化的试剂中的应用
本发明涉及ifn-γ和tnf-α联合在作为制备诱导巨噬细胞向m1表型巨噬细胞极化的试剂中的应用。
背景技术:
1、肿瘤细胞免疫疗法功能被广泛应用于各种恶性肿瘤的实验研究和临床治疗,尤其是嵌合抗原受体修饰的t细胞(chimeric antigen receptor t cells,car-t)疗法在血液系统肿瘤领域取得很好的疗效。但在实体肿瘤中,抑制性肿瘤微环境(tumormicroenvironment,tme)通常会通过多种因素对过继细胞免疫治疗形成免疫壁垒,其致密的细胞和基质屏障首先对工程淋巴细胞浸润实体肿瘤形成物理屏障。即便是进入实体肿瘤,tme形成的免疫抑制微环境,如缺氧和酸性环境、免疫检查点配体的表达、特别是大量的免疫抑制细胞,如肿瘤相关巨噬细胞(tumor associated macrophage,tam)、髓系来源的抑制细胞和调节性t细胞,形成的免疫抑制屏障是当前实体肿瘤免疫治疗的主要难点之一。针对tam的免疫抑制特性,当前一部分临床免疫治疗,采取抑制巨噬细胞向实体肿瘤趋化、杀灭巨噬细胞数量、诱导m2型巨噬细胞向m1型复极化或者促进tam重编程为m1型等不同策略,这些策略仍是着眼于对tam的数量改变的治疗水平。
2、巨噬细胞(mφ),作为重要的固有免疫细胞,是机体抗感染的第一道防线,参与不同免疫相关疾病的调节。与t细胞分泌为主的胞毒作用不同,巨噬细胞主要起到胞吞、消化和抗原递呈作用。因此,若能驯化mφ特异性吞噬肿瘤细胞,调动其抗原呈递特性,则胞吞型mφ有望成为治疗恶性肿瘤的新型免疫治疗工具。
3、结直肠癌(crc),最常见的恶性肿瘤之一,约占全球每年新发癌症病例和癌症相关死亡事件的10%,是目前男性和女性癌症相关死亡的第三大原因。crc有微卫星稳定型(mss)及微卫星不稳定型(msi),微卫星高度不稳定性/dna错配修复缺陷(msi-h/dmmr)的crc患者约占总数的10%~15%。mss,约占总crc患者的85%,治疗差,形成晚期转移性crc,低肿瘤突变负担和缺乏免疫细胞浸润被认为是免疫抵抗的机制,因此mss在抗pd-l1 mab等免疫治疗上疗效欠佳。对于ⅲ期crc患者,无论msi状态如何,目前都建议患者术后接受基于5-氟尿嘧啶(5-fluorouracil,5-fu)类的两药联合的辅助治疗。预后预测方面,msi-h的ⅱ期crc患者整体预后较好,发生远处转移概率较低,除常规放化疗外免疫检查点抑制剂如抗pd-1抗体已成为msi-h/dmmr crc的经典治疗方案。免疫治疗的飞速发展为msi-h/dmmr的晚期crc患者带来了极大的生存获益,然而在使用免疫检查点抑制剂治疗的患者中,仅小部分患者(20%左右)得到持久的应答和良好的长期预后,并且经常伴随着不同程度的免疫相关不良反应事件。因此亟需安全有效的治疗策略以克服mss的治疗瓶颈。同时有研究表明m1型巨噬细胞能抑制crc细胞的增殖,促进凋亡,同时m1型巨噬细胞与crc的淋巴结和肝脏转移能力呈负相关,m1型巨噬细胞与较好的生存呈正相关。
4、针对crc目前匮乏的免疫治疗手段,通过工程化raw264.7巨噬细胞m1表型改造进行crc的细胞治疗,这可能是实现对crc尤其是mss-crc的精准免疫治疗策略。
5、car-t或者car-nk这些细胞治疗药物难浸润到实体瘤(包括crc)中,当前针对肿瘤微环境中的tam主要通过着眼于对tam数量改变来实现治疗目的,如抑制巨噬细胞向实体肿瘤趋化、减少巨噬细胞数量、诱导m2型巨噬细胞向m1型复极化或者促进tam重编程为m1型等不同策略。然而巨噬细胞属于终末分化细胞,机体抗感染的第一道防线,对其进行体内编辑或者改造效率也会比较低;同时,目前体外巨噬细胞m1表型常规采用极化方法为ifn-γ诱导刺激24小时,制备时间长。
技术实现思路
1、本发明的目的是提供一种能快速将巨噬细胞向m1表型巨噬细胞极化的方法。
2、本发明的目的通过以下技术方案实现:
3、ifn-γ和tnf-α联合在作为制备诱导巨噬细胞向m1表型巨噬细胞极化的试剂中的应用。
4、优选的,所述巨噬细胞为raw264.7细胞。
5、优选的,ifn-γ与tnf-α的使用浓度比为10:1~1:10。
6、优选的,其步骤包括培养巨噬细胞,在巨噬细胞中加入ifn-γ和tnf-α进行诱导,即得到m1表型巨噬细胞。
7、优选的,诱导时间为6h,ifn-γ的用量为50ng/ml,tnf-α的用量为50ng/ml。
8、优选的,采用添加10%胎牛血清的dmem培养基对巨噬细胞进行培养。
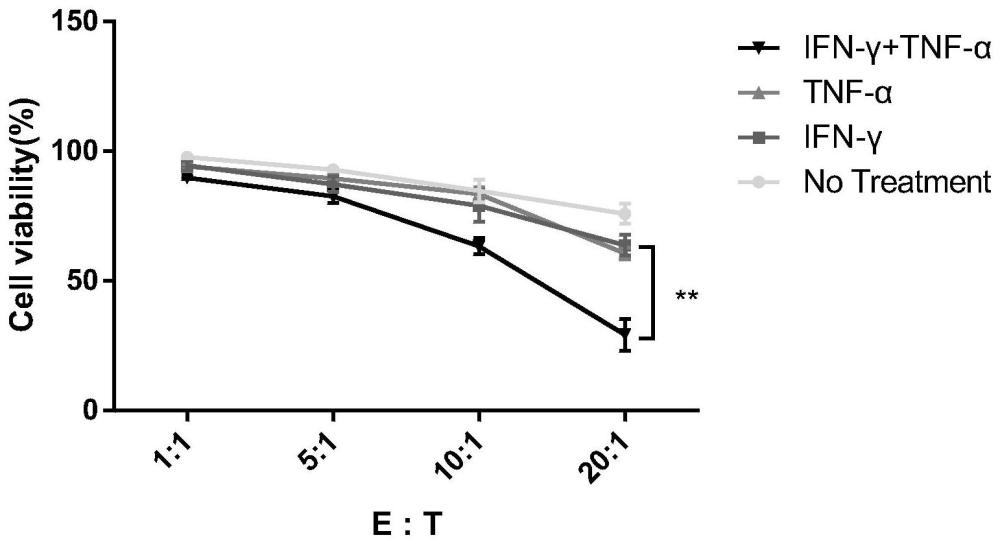
9、本发明方法方便快捷,能在较短的时间内将raw264.7细胞极化为抗肿瘤的m1表型,且稳定均一;raw264.7细胞来源充足且巨噬细胞相较于t细胞或者nk细胞具有更好的浸润能力;良好的抗结直肠癌肿瘤疗效,与mc38细胞共孵育的杀伤效率最高可达到80%。本发明对于crc尤其是mss-crc的精准免疫治疗具有较高的参考价值。
技术特征:
1.ifn-γ和tnf-α联合在作为制备诱导巨噬细胞向m1表型巨噬细胞极化的试剂中的应用。
2.根据权利要求1所述的应用,其特征在于所述巨噬细胞为raw264.7细胞。
3.根据权利要求1所述的应用,其特征在于ifn-γ与tnf-α的使用浓度比为10:1~1:10。
4.根据权利要求1所述的应用,其特征在于其步骤包括培养巨噬细胞,在巨噬细胞中加入ifn-γ和tnf-α进行诱导,即得到m1表型巨噬细胞。
5.根据权利要求4所述的应用,其特征在于诱导时间为6h,ifn-γ的用量为50ng/ml,tnf-α的用量为50ng/ml。
6.根据权利要求4所述的应用,其特征在于采用添加10%胎牛血清的dmem培养基对巨噬细胞进行培养。
7.权利要求1-6中任一项所述的m1表型巨噬细胞在制备治疗肿瘤的药物中的应用。
8.根据权利要求7所述的应用,其特征在于所述肿瘤为结直肠癌。
技术总结
本发明公开了IFN‑γ和TNF‑α联合在作为制备诱导巨噬细胞向M1表型巨噬细胞极化的试剂中的应用。本发明方法方便快捷,能在较短的时间内将Raw264.7细胞极化为抗肿瘤的M1表型,且稳定均一;Raw264.7细胞来源充足且巨噬细胞相较于T细胞或者NK细胞具有更好的浸润能力;良好的抗结直肠癌肿瘤疗效,与MC38细胞共孵育的杀伤效率最高可达到80%。本发明对于CRC尤其是MSS‑CRC的精准免疫治疗具有较高的参考价值。
技术研发人员:黄振,高川成,陈江宁,张峻峰
受保护的技术使用者:无锡市南京大学锡山应用生物技术研究所
技术研发日:
技术公布日:2024/3/24
- 还没有人留言评论。精彩留言会获得点赞!