肾上腺皮质癌生物标志物KPNA2及其识别方法
本技术涉及生物标志物,尤其是涉及一种肾上腺皮质癌生物标志物kpna2及其识别方法。
背景技术:
1、肾上腺皮质癌(acc)是一种预后差,死亡率高的恶性肿瘤。治疗acc的方法包括手术切除、放疗、化疗和靶向治疗。对于早期诊断的患者,手术切除通常是首选治疗方法,尤其是在肿瘤尚未扩散到其他器官的时侯。然而,由于acc对传统化疗的抵抗性较强,特别是在晚期阶段,治疗的效果可能会受限。近年来,研究人员在探索肾上腺皮质癌的分子机制和生物学特性,以便开发更加针对性的治疗方法,如免疫治疗和靶向药物。然而免疫抑制剂在acc中由于治疗效果不稳定、肿瘤异质性、免疫逃逸机制以及副作用等原因,其应用仍面临许多困扰。因此,寻找一个新的acc生物标志物,可以通过预测治疗反应和预后评估等方式为患者提供更好的治疗选择和临床管理。
2、acc由于较强的肿瘤异质性,如今对其预后的预测研究以及免疫治疗仍面临着诸多挑战。而multi-omics作为一种结合了基因组学、转录组学、蛋白质组学、代谢组学等多种不同类型的分子生物学数据的研究方法,可从多个分子层面深入解析acc的肿瘤异质性。多组学分析中通过比较正常细胞和癌症细胞的assay for transposase-accessiblechromatin using sequencing(atac-seq)数据,可以发现与癌症相关的基因组区域,如突变引起的染色质变化、癌基因、抑癌基因以及转录因子结合位点等。因此,利用atac-seq,可以通过差异可及性分析来探索acc中哪些编码基因受非编码调控元件可及性的影响而帮助寻找出acc的潜在的生物标志物、揭示免疫治疗与药物的潜在靶点。
3、karyopherin subunit alpha 2(kpna2)是一种核携带蛋白,主要参与调控蛋白质在细胞核与细胞质之间的转运过程,与癌症细胞的生长与转移过程中起着至关重要的作用。近年来的研究表明,kpna2在多种癌症中的异常高表达与癌症的发生、发展以及治疗抵抗等过程密切相关,但迄今为止,关于kpna2在acc中的研究尚未见报道。
技术实现思路
1、本技术的目的在于克服上述现有技术的不足之处而提供一种肾上腺皮质癌生物标志物kpna2及其识别方法。本技术研究了kpna2的临床意义和生物学特性,可以作为一种良好前景的生物标志物来预测儿童与成人肾上腺皮质癌(acc)的预后和免疫治疗反应。
2、为实现上述目的,本技术采取的技术方案为:
3、本技术提供了kpna2作为生物标志物在制备诊断和治疗肾上腺皮质癌的产品中的应用。
4、本技术利用生物信息学方法、免疫组化及体外实验,鉴定了出一个肾上腺皮质癌相关的基因kpna2,并在后续的研究中发现其具有良好的免疫治疗应答预测能力
5、作为本技术所述应用的优选实施方式,所述产品包括试剂盒或诊断芯片。
6、本技术还提供了一种肾上腺皮质癌相关的生物标志物的识别方法,所述生物标志物为kpna2;
7、所述识别方法包括以下步骤:
8、s1、从tcga和geo数据库中获得肾上腺皮质癌的与正常组织的全转录组测序数据集;
9、s2、结合所述全转录组测序数据集,进行加权基因共表达网络分析wgcna聚类和atac-seq数据分析筛选肾上腺皮质癌进展差异峰相关基因,利用免疫组织化学、细胞功能试验、受试者工作特征roc曲线、单变量cox回归、功能富集分析识别出导致肾上腺皮质癌中不良预后的生物标志物kpna2;
10、所判断生物标志物kpna2与肾上腺皮质癌相关,则通过多组学综合分析对结果进行验证。
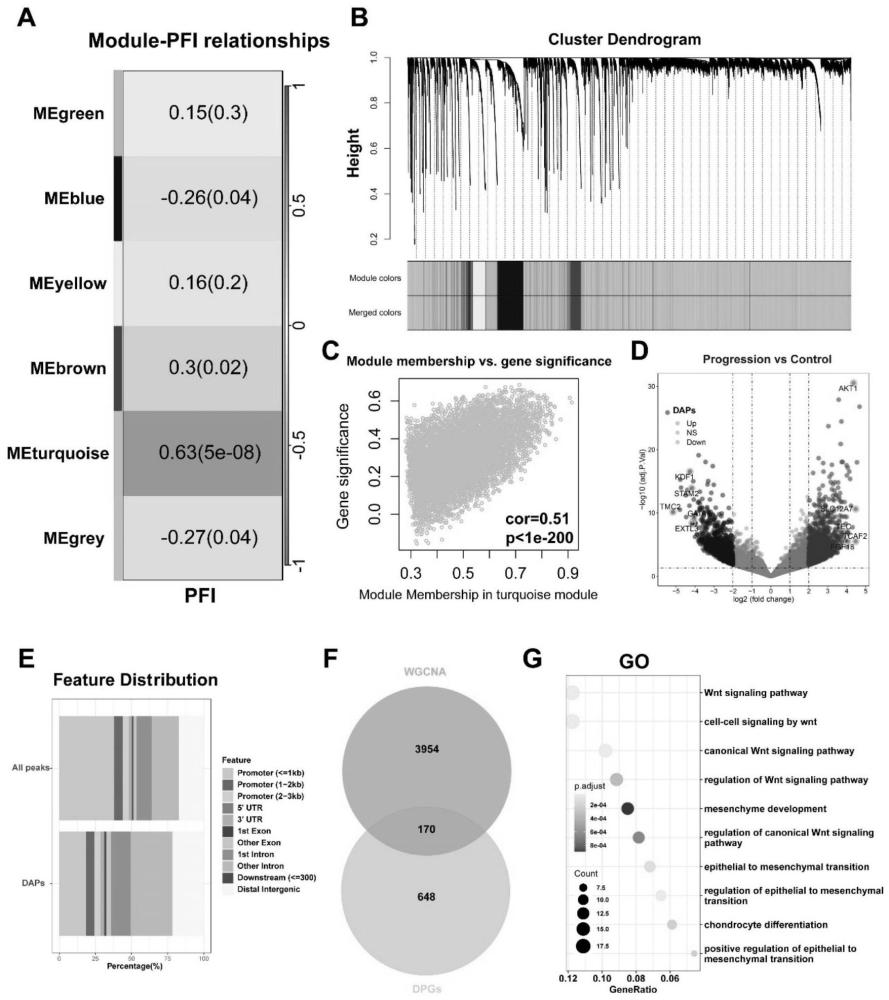
11、本研究结合tcga队列数据,通过weighted gene co-expression networkanalysis(wgcna)以及atac-seq数据分析筛选acc疾病进展差异峰相关基因后,利用受试者工作特征曲线(roc)与cox回归识别出导致acc中不良预后的生物标志物。
12、在geo六个队列的后续验证中,筛选并证实了不良预后相关的kpna2,并在后续的免疫组化及细胞实验中验证其生物作用。并通过gene set enrichment analysis(gsea)、突变分析、免疫浸润、免疫检查点概况以及药物靶点分析等多组学方法多个角度探索kpna2在acc中的角色,为成人与儿童acc患者的预后、免疫治疗效果和潜在靶向治疗药物提供了一个生物标志物,在acc的临床治疗方案优化、预后风险评估、精准治疗等方面具有重要意义。
13、作为本技术所述肾上腺皮质癌相关的生物标志物的识别方法的优选实施方式,所述步骤s1中,所述全转录组测序数据集包括tcga-acc数据集、gse19750数据集、gse10927数据集、gse76019数据集、gse76021数据集,由gse19750、gse10927组成adult meta队列,由gse76019、gse76021组成pediatric meta队列,并使用“sva”r包中的combat函数修正了批次效应。
14、作为本技术所述肾上腺皮质癌相关的生物标志物的识别方法的优选实施方式,所述步骤s2中,使用“wgcna”包将全转录组测序数据集中的tcga-acc数据集的基因图谱开发为基因共表达网络,通过“hclust”函数对样本进行聚类分析,验证和去除离群值,选择软阈值强调基因的强大关联,惩罚低关联,确保无标度网络,通过分析每个提取的基因对之间的pearson相关性建立邻接矩阵,并转化为拓扑重叠矩阵和相应的不相似度,然后再利用“dynamictreecut”算法对每个模块计算模块特征基因,表示给定模块的基因表达谱,将meprofiles与临床特征信息相关系数高的模块作为候选模块,选择进行后续分析。
15、作为本技术所述肾上腺皮质癌相关的生物标志物的识别方法的优选实施方式,对tcga-acc数据集根据中位pfi分组后进行聚类,随后选定0.2和16分别作为模块合并截断值与最小模块体积进行wgcna分析,并使用热图探索模块与pfi之间的关系,得到6个不同的基因模块,再去除无统计学意义相关的基因后,得到与pfi相关性最高的turquoise基因模块(r=0.51,p=1e-200)。
16、作为本技术所述肾上腺皮质癌相关的生物标志物的识别方法的优选实施方式,所述步骤s2中,采用“timeroc”r包计算受试者工作特征曲线auc下的面积,以评估候选模块基因的预测能力;在tcga-acc数据集中选择auc为>0.7且hr>1的基因的基因进行单因素cox分析,以确定总生存队列的预后基因,然后在geo数据库中进一步验证,kaplan-meier生存曲线和logrank检验验证kpna2的预测能力。
17、作为本技术所述肾上腺皮质癌相关的生物标志物的识别方法的优选实施方式,所述步骤s2中,利用“clusterprofiler”(version 4.8.1)r包用于功能富集。
18、作为本技术所述肾上腺皮质癌相关的生物标志物的识别方法的优选实施方式,所述多组学综合分析包括功能富集、突变分析、免疫浸润、免疫应答分析。
19、本技术采用tcga和geo的转录组学和atac-seq对各种acc样本进行加权基因共表达网络分析(wgcna)聚类和综合分析。这些发现与单变量cox回归、roc曲线和生存分析相结合,以筛选潜在的生物标志物,并利用免疫组织化学、和细胞功能试验验证。利用功能富集、突变分析、免疫浸润、免疫应答分析等多组学综合分析以探索生物标志物在儿童与成人acc中的作用。
20、tcga-acc队列中共鉴定出78个基因。结合geo肾上腺皮质癌队列的roc曲线和单变量和多变量cox回归,本技术确定kpna2是导致acc预后不良的独立危险因素。atac-seq数据显示,kpna2表达量高的acc患者的染色质可及性较低。
21、免疫组织化学显示kpna2在acc中高表达。细胞功能实验表明,kpna2的高表达促进肿瘤增殖、迁移。功能富集表明kpna2高表达的acc患者在肿瘤细胞增殖途径中表现出激活,在免疫应答途径中显著受到抑制。随后的免疫浸润分析显示,在高kpna2表达组中cd8+t细胞浸润显著降低。免疫应答分析中,低kpna2表达预示着较好的免疫反应以及良好的预后。
22、与现有技术相比,本技术具有以下有益效果:
23、本技术在wgcna和atac-seq分析得到acc progression异常可及性相关基因集后,进行go分析发现基因集显著富集wnt/β-catenin信号通路,接着本技术从该基因集筛选出最具有预测acc progression能力和潜在的药物靶点的生物标志物kpna2。本技术的研究结果表明,kpna2在acc中表达水平与tmb、smgs、cnv有不同程度的显著相关,提示kpna2在acc中预示着更高的异质性以及tmb,具有潜在的免疫治疗反应的预测能力。
24、在肿瘤组织中,由免疫细胞、细胞因子、趋化因子、免疫检查点分子等多种组分所构成的肿瘤免疫微环境,在肿瘤的发生、发展、转移以及对治疗的响应中扮演重要角色。它可以决定免疫系统如何与肿瘤细胞相互作用,从而影响肿瘤细胞的生存、增殖和转移。在本技术的分析中发现,kpna2显著抑制免疫应答相关通路。研究证明,increased nucleartransporter kpna2 contributes to tumor immune evasion by enhancing pd-l1expression in pdac。此外,除了经典的icb反应指标如tmb和pd-l1免疫组化染色[,kpna2在成人与儿童数据集中的多种算法下均提示与cd8+t细胞负相关。submap分析中低表达kpna2与潜在的pd-l1免疫应答显著相关,而高表达的kpna2患者在免疫治疗队列中提示预后不良。结果表明,低表达kpna2并伴有免疫检查点上调和cd8+t细胞浸润增加的患者最有可能从免疫治疗中受益。因此,kpna2具有潜在的免疫治疗预测价值。
25、虽然在acc中,免疫抑制剂与靶向药物治疗仍处于临床探索阶段,但不少研究者发现kpna2靶向药物可显著抑制癌症的进展与转移。ma et al发现usp1抑制剂使kpna2不稳定而抑制乳腺癌转移。feng等人则发现delanzomib可通过靶向抑制kpna2显著抑制crc的转移。因此,本技术利用cmap分析为靶向kpna2提供了更多的化合物作为化疗方案,用于acc治疗的潜在单一疗法或联合疗法。
26、在肾上腺皮质癌(acc)中,kpna2表达水平高,并且通过多种机制促进了acc的细胞增殖和迁移,还可能影响肿瘤的免疫逃逸。尽管kpna2在其他癌症中已有研究,但在acc中的作用尚未得到报道,本技术的研究填补了这个空白。综上所述,本技术的研究为acc患者提供了重要的生物标志物,对于预后风险评估以及未来发展acc的靶向药物和免疫抑制剂治疗方向具有积极意义
- 还没有人留言评论。精彩留言会获得点赞!