一种药物筛选方法
本发明涉及药物筛选,尤其涉及一种药物筛选的方法。
背景技术:
1、细胞水平的药物筛选是一种更接近生理条件的药物筛选模型这类方法大多以细胞为研究对象,其模型是拟开发药物作用的靶细胞,将候选化合物作用于通过细胞培养技术获取的靶细胞,采用与分子水平筛选类似的检测技术或是显微成像方法,分析测定化合物对各项细胞功能的影响,例如cck8法检测细胞增殖、划痕检测细胞迁移、bifc检测分子互作、报告基因检测靶标调控等,从而对大量化合物进行筛选。
2、细胞水平筛选的关键特征之一是可以一次筛选多个靶标,例如使用显微成像技术可以观察到多个标记荧光分子的靶标蛋白分布和表达情况。适用于对靶点所涉及的信号通路的研究以及对特定细胞产生毒性作用的化合物发现等。需要注意的是,虽然细胞水平的药物筛选模型更接近生理条件,筛选准确率高,但由于需要建立细胞模型,其操作也更复杂,成本更高,且数据之间的平行性略低。因此,需要建立一种筛选准确率高,简单有效的高通量药物筛选方法。
技术实现思路
1、针对现有技术中所存在的不足,本发明提供了一种药物筛选方法,其解决了现有技术中存在的筛选准确率低、操作复杂的问题。
2、具体的,本发明提供如下方案:
3、一种药物筛选方法,所述方法包括以下步骤:
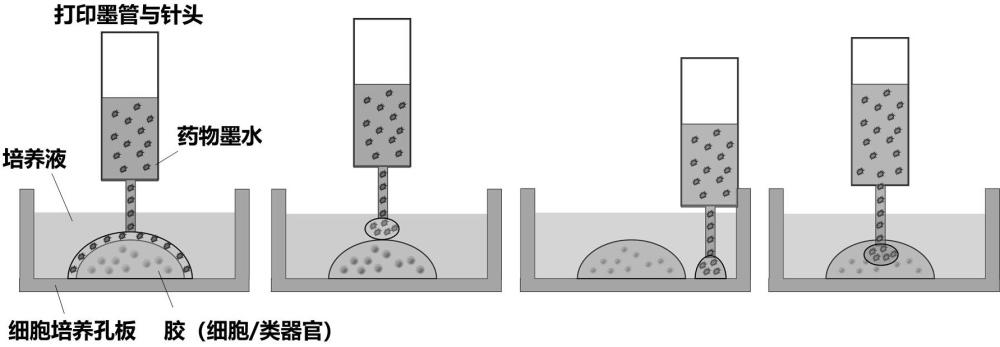
4、s1:制备生物活性墨水,所述生物活性墨水包括分散介质、药物和生物单元;
5、s2:将所述生物活性墨水经3d打印方法打印到基底上,得到药物筛选芯片;
6、s3:评价药物的潜力和有效性,得到待筛选药物;
7、或者,所述方法包括以下步骤:
8、s1’:制备第一生物活性墨水,所述第一生物活性墨水包括分散介质和生物单元;制备第二生物活性墨水,所述第二生物活性墨水包括分散介质和药物;
9、s2’:将所述第一生物活性墨水经3d打印方法打印到基底上,将所述第二生物活性墨水经3d打印方法打印到第一生物活性墨水形成的墨滴上,得到药物筛选芯片;
10、s3’:评价药物的潜力和有效性,得到待筛选药物。
11、在本发明一实施方式中,所述分散介质至少包括水凝胶交联前体和水凝胶粘附增强剂。
12、在本发明一实施方式中,所述分散介质中,水凝胶交联前体和水凝胶粘附增强剂的质量比为(1~10):0.5;示例性地,为1:0.5、2:0.5、3:0.5、4:0.5、5:0.5、6:0.5、7:0.5、8:0.5、9:0.5、10:0.5或介于其中的某一具体比例值。
13、在本发明一实施方式中,所述分散介质至少包括水凝胶交联前体,任选添加或不添加交联引发剂。当添加交联引发剂时,在形成生物墨水时所述水凝胶交联前体能够与对应的交联引发剂作用形成水凝胶。
14、在本发明一实施方式中,所述交联引发剂选自光引发剂、离子引发剂中的一种或几种。
15、在本发明一实施方式中,所述光引发剂包括但不限于苯基-2,4,6-三甲基苯甲酰基亚磷酸锂(简称lap)、2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮(i2959)、2,4,6-三甲基苯甲酰基苯基膦酸乙酯(tpo-l)中的至少一种。
16、在本发明一实施方式中,所述离子引发剂包括但不限于氯化钙溶液、氯化钡溶液中的至少一种。
17、在本发明一实施方式中,所述水凝胶交联前体选自光敏性水凝胶前体、离子型水凝胶前体、热固化水凝胶前体中的一种或几种。优选地,所述水凝胶交联前体为光敏性水凝胶前体和/或离子型水凝胶前体。
18、在本发明一实施方式中,所述热固化水凝胶前体包括但不限于基质胶、聚醚f127二丙烯酸酯中的至少一种。
19、在本发明一实施方式中,所述水凝胶交联前体包括光敏性水凝胶前体、离子型水凝胶前体、基质胶中的一种或几种。
20、在本发明一实施方式中,所述水凝胶交联前体包括基质胶,以及任选的光敏性水凝胶前体和/或离子型水凝胶前体。
21、在本发明一实施方式中,所述水凝胶交联前体包括基质胶、光敏性水凝胶前体和离子型水凝胶前体。
22、根据本发明的实施方案,按质量百分比,所述水凝胶交联前体中,所述基质胶的含量≤50%,优选所述基质胶的含量≤40%,进一步优选地,所述基质胶的含量≤30%,例如为35%、25%、20%、18%。
23、作为一个实例地,按质量百分比,所述水凝胶交联前体中,所述基质胶的含量为20%,光敏性水凝胶前体和/或离子型水凝胶前体的含量为80%。
24、在本发明一实施方式中,所述基质胶包括matrigel、cultrex bme、geltrex中的一种或几种。
25、在本发明一实施方式中,所述水凝胶交联前体包括光敏性水凝胶前体和离子型水凝胶前体,所述光敏性水凝胶前体和离子型水凝胶前体的质量比为1:(0~5),优选所述光敏性水凝胶前体和离子型水凝胶前体的质量比为1:(0~3),例如为1:1。
26、在本发明一实施方式中,所述光敏性水凝胶前体包括但不限于甲基丙烯酰化海藻酸钠(algma)、甲基丙烯酰化透明质酸(hama)、甲基丙烯酰化壳聚糖、甲基丙烯酰化羧甲基壳聚糖、甲基丙烯酰化聚赖氨酸(plma)、甲基丙烯酰化明胶(gm)、甲基丙烯酰化丝素蛋白(silma)、甲基丙烯酰化葡聚糖(dexma)、甲基丙烯酰化硫酸软骨素(chsma)、聚醚f127二丙烯酸酯、聚乙二醇二丙烯酸酯、四臂聚乙二醇丙烯酸酯、以及其他丙烯酰化的材料(如丙烯酰化rgd肽、丙烯酰化聚乙二醇nhs酯)。
27、在本发明一实施方式中,所述离子型水凝胶前体包括但不限于羧甲基纤维素、海藻酸钠、羧甲基壳聚糖。
28、在本发明一实施方式中,所述水凝胶交联前体为光敏性水凝胶前体和离子型水凝胶前体的组合物。研究发现,当选择所述组合物作为水凝胶交联前体时,光敏性水凝胶前体和离子型水凝胶前体可以通过调控光固化时间来调控墨水的粘度,进而控制细胞的生长状态;由于离子交联的键合强度要强于光交联的键合强度,加入离子型水凝胶前体可以进一步强化水凝胶的空间骨架强度,提高水凝胶的稳定性,拓宽细胞生长环境的可调控范围。另外,光固化水凝胶前体中的甲基丙烯酰化海藻酸钠、甲基丙烯酰化明胶和甲基丙烯酰化透明质酸,既具有光固化性能,也具有离子固化性能,在使用时,即使不加入离子型水凝胶前体,也可以先进行光固化调控墨水的粘度,再进行离子固化加强凝胶的稳定性,有效调控细胞的生长环境,也就是说,当选择甲基丙烯酰化海藻酸钠、甲基丙烯酰化明胶和甲基丙烯酰化透明质酸作为光敏性水凝胶前体时,即使仅加入光敏性水凝胶前体,也可以达到与同时加入离子型水凝胶前体相同的效果。
29、在本发明一实施方式中,当所述水凝胶交联前体包括光敏性水凝胶前体时,所述分散介质包括光引发剂。
30、在本发明一实施方式中,所述光敏性水凝胶前体与光引发剂的质量比为(2~15):1;优选所述光敏性水凝胶前体与光引发剂的质量比为(3~12):1;例如为4:1、7:1、9:1、10:1、12:1。
31、在本发明一实施方式中,所述分散介质还至少包括水凝胶粘附增强剂,所述水凝胶粘附增强剂用于增强水凝胶对基底的粘附性。具体的,所述水凝胶粘附增强剂包括但不限于聚多巴胺、聚甲基丙烯酰胺、聚乙二醇、聚乙烯醇等中的至少一种。
32、作为一个实例,所述分散介质至少包括羧甲基纤维素和聚多巴胺。
33、作为一个实例,所述分散介质至少包括海藻酸盐、羧甲基纤维素和聚多巴胺。
34、作为一个实例,所述分散介质至少包括聚多巴胺、光敏性水凝胶前体和光引发剂。
35、作为一个实例,所述分散介质至少包括海藻酸盐、羧甲基纤维素、聚多巴胺和壳聚糖。
36、在本发明一实施方式中,所述分散介质中至少包括海藻酸盐、羧甲基纤维素、聚多巴胺、光敏性水凝胶前体和引发剂。
37、在本发明一具体实施方式中,所述海藻酸盐、羧甲基纤维素、聚多巴胺、光敏性水凝胶前体和引发剂的质量比为(1~5):1:0.5:(1~5):(0.05~0.25)。
38、示例性地,所述质量比中,海藻酸盐的配比为1~5中的任一点值,具体例如1、2、3、4或5。
39、示例性地,所述质量比中,光敏性水凝胶前体的配比为1~5中的任一点值,具体例如1、2、3、4或5。
40、示例性地,所述质量比中,引发剂的配比为0.05~0.25中的任一点值,具体例如0.05、0.10、0.15、0.20或0.25。
41、在本发明一具体实施方式中,所述光敏性水凝胶前体包括甲基丙烯酰化海藻酸钠。
42、在本发明一具体实施方式中,所述引发剂包括苯基-2,4,6-三甲基苯甲酰基亚磷酸锂(lap)。
43、在本发明一具体实施方式中,所述分散介质中还包括层粘蛋白、rgd多肽、细胞因子、抗生素、小分子化合物、纤维素酶、培养基中的一种或几种。
44、在本发明一具体实施方式中,所述层粘蛋白和/或rgd多肽的浓度为0.1-1mg/ml。
45、在本发明进一步的具体实施方式中,所述细胞因子包括但不限于r-spondin细胞生长因子、mnoggin细胞生长因子、egf细胞生长因子、wnt3a细胞生长因子中的至少一种。
46、在本发明一具体实施方式中,所述细胞因子的浓度为50-100 ng/ml。
47、在本发明进一步的具体实施方式中,所述抗生素包括但不限于primocin™原代细胞抗生素。
48、在本发明一具体实施方式中,所述抗生素的浓度为50-100μg/ ml。
49、在本发明进一步的具体实施方式中,所述小分子化合物包括但不限于sb202190、gastrin i、a83-01、烟酰胺、prostaglandin e2、及n-乙酰-l-半胱氨酸中的至少一种。
50、在本发明一具体实施方式中,所述小分子化合物的浓度为10 nm-10 mm。
51、在本发明进一步的具体实施方式中,所述纤维素酶包括但不限于内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶,商业购得的混合型纤维素酶(cas no:9012-54-8)。
52、在本发明一具体实施方式中,所述纤维素酶的浓度为0.01-0.1%。
53、在本发明进一步的具体实施方式中,所述培养基包括但不限于dmem/f12培养基。
54、在本发明一实施方式中,所述生物单元包括细胞、组织或类器官。
55、在本发明一具体实施方式中,所述细胞包含但不限于正常原代细胞、肿瘤原代细胞、细胞系、诱导多能干细胞等中的至少一种。
56、在本发明一具体实施方式中,所述组织包含但不限于细胞团、小块生物组织、细胞质基质等中的一种或多种。具体的,所述生物组织包含但不限于上皮组织、结缔组织、肌肉组织、神经组织中的一种或多种。
57、在本发明一具体实施方式中,所述类器官包括但不限于包括小肠类器官、胃类器官、结肠类器官、肺类器官、膀胱类器官、大脑类器官、肝脏类器官、胰腺类器官、肾脏类器官、卵巢类器官、食道类器官、心脏类器官中的一种或多种。
58、在本发明一具体实施方式中,所述生物单元中的药物为待筛药物,包含任何能够均匀分散于水、缓冲溶液(磷酸缓冲盐溶液(pbs)、4-羟乙基哌嗪乙磺酸(hepes)、生理盐水等)、血清、培养基等介质中的颗粒或分子,可以是一种,也可以是多种混合药物。
59、以结肠癌的治疗药物为例,可以是奥沙利铂、亚叶酸(lv)、5-氟脲嘧啶(5-fu)、贝伐珠单抗、西妥昔单抗、卡培他滨、伊立替康、瑞戈非尼、呋喹替尼、曲氟尿苷替匹嘧啶、曲妥珠单抗、拉帕替尼、维莫非尼、达拉非尼、曲美替尼、雷替曲塞或帕博利珠单抗等。
60、本发明的药物给药方式为“打印”,通过打印过程中编程性打印位点来调控给药位点、分布,通过喷墨气压、喷墨时间来调控药物的量与浓度。
61、本发明中,所述的混合药物,可以预先将多种药物混合于同一墨管进行打印;也可以将多种药物分装于不同的墨管,通过在同一位点进行多轮打印完成药物混合;优选为后者,以此减少人为操作步骤。
62、在一些具体实施方式中,所述生物单元的来源包括病人组织切片、组织分离物、原代细胞(组织)、传代细胞(组织)、实验室细胞等中的一种或多种。
63、在一些具体实施方式中,所述生物单元通过包括以下步骤的方法得到:
64、1)将目标组织进行分离剪碎处理,加入消化液,过滤除上清;
65、2)加入红细胞裂解液中裂解,离心去上清;
66、3)加入分离液进行清洗,之后加入matrigel基质胶进行固化;
67、4)加入培养基中进行培养及传代。
68、优选地,所述消化液为添加凋亡抑制剂10 μm y-27632、100μg/ ml primocin™原代细胞抗生素、2 mg/ml collagenase type2酶的分离液;
69、优选地,所述分离液为为添加2mm l-丙氨酰-l-谷氨酰胺(glutamax™)、25 mm 缓冲溶液hepes、1%链霉素和青霉素的dmem/f12培养基。
70、在一些具体实施方式中,所述步骤s1具体包括:将海藻酸盐、羟甲基纤维素、聚多巴胺、光敏性水凝胶的原料和引发剂混合,得到所述分散介质;将所述生物单元、所述分散介质和药物混合,得到所述生物活性墨水。
71、在一些具体实施方式中,所述步骤s1具体包括:将海藻酸盐、羟甲基纤维素、聚多巴胺、光敏性水凝胶的原料和引发剂与其他组分混合,得到所述分散介质;将所述生物单元、所述分散介质和药物混合,得到所述生物活性墨水;其中,所述其他组分包括层粘蛋白、rgd多肽、细胞因子、抗生素、小分子化合物、纤维素酶、培养基中的至少一种。
72、在一些具体实施方式中,所述基底为柔性材料。
73、优选地,所述的柔性材料包含高分子膜、水凝胶等一种或多种材料。所述的高分子膜例如为聚二甲基硅氧烷膜(pdms)、聚对苯二甲酸乙二醇酯膜(pet)、abs塑料膜、聚四氟乙烯膜。所述的水凝胶例如为透明质酸水凝胶、海藻酸水凝胶、纤维素水凝胶、壳聚糖水凝胶、胶原蛋白水凝胶、明胶水凝胶、丝素水凝胶、琼脂水凝胶、dna水凝胶、去细胞化组织水凝胶、聚乙烯醇水凝胶、聚丙烯酸水凝胶、聚乙二醇水凝胶、聚多巴胺(pda)水凝胶或聚丙烯酸酯水凝胶等;优选为聚对苯二甲酸乙二醇酯膜或聚多巴胺水凝胶。
74、在一些具体实施方式中,所述基底为刚性材料。
75、优选地,所述的刚性材料包含塑料类、硅类、金属类等一种或多种材料,所述的塑料类例如为常见的培养皿、细胞培养孔板(材质可为聚苯乙烯、聚乙烯、聚丙烯、聚氨酯、聚碳酸酯、聚硅氮烯、聚四氟乙烯),所述硅类例如为玻璃片、单晶硅片、二氧化硅片、石英片或聚二甲基硅氧烷薄膜等,所述金属类例如为铝片、铜片、镍片或氧化铝片等;优选为铝片或玻璃片。
76、在一些具体实施方式中,3d打印的参数设置包括:打印图案、打印针头距离基底的高度、喷墨气压、单位点喷墨时间、基底接触角、墨滴打印精度中的至少一种。
77、优选地,所述打印图案设置为点阵、线条或2d/3d图案;
78、优选地,所述打印针头距离基底的高度为20-100微米;
79、优选地,所述单位点喷墨时间为0-10s;
80、优选地,所述喷墨气压为0-60 psi,精度为0.1 psi;所述喷墨气压与墨水粘度相关,低粘度液体(如水,温度5℃,粘度1.5 mpa•s)对应喷墨气压为0.5-5.0psi,优选1.0psi;高粘度液体(如2%羧甲基纤维素与2%海藻酸钠混合物,温度4℃,剪切速率0.1/s,剪切应力26.554pa,粘度250000±50000mpa•s)对应喷墨气压为10-55psi,优选30psi;
81、优选地,所述基底接触角为0-100度,优选为50±10度;
82、优选地,所述细胞打印的墨滴打印精度为100-1500微米,优选为300-500微米。所述墨滴打印精度定义为最小喷墨量于基底上形成的墨点尺寸,例如单点的直径、线的宽度等。
83、本发明的生物活性墨水的设计,可以通过打印给药方式,实现精确调控给药的体积。优选地,所述打印给药的体积为0.01-100 nl,优选为0.5-5 nl。
84、<基底预处理和表面修饰>
85、在本发明一实施方式中,在步骤s1和步骤s2之间,或者,在步骤s1’和步骤s2’之间,还包括将基底进行预处理和表面修饰的步骤。
86、在本发明一实施方式中,所述预处理包括将基底进行丙酮处理,得到预处理的基底。
87、在本发明一具体实施方式中,预处理的时间为10-20min。
88、在本发明一实施方式中,所述表面修饰包括将基底表面进行多巴胺修饰。
89、在本发明一具体实施方式中,所述表面修饰包括以下步骤:(1)将多巴胺盐溶解于缓冲液中,得到多巴胺水溶液;(2)将预处理的基底浸入多巴胺水溶液中,加热,静置得到修饰的基底。
90、<步骤s3或步骤s3’>
91、在本发明一实施方式中,评价药物的潜力包括测定细胞增殖活力,具体的,包括计算细胞存活率、计算ic50、emax和auc值。
92、在本发明一实施方式中,评价药物的有效性包括基于药物基因组学分析,检测所述筛选药物的药效生物标志物。
93、本发明还提供上述方法在药物筛选、特别是高通量药物筛选中的应用。
94、相比于现有技术,本发明具有如下有益效果:
95、(1)本发明的高通量药物筛选方法可以利用打印的方法进行精准加药,可以调控加药的位置、浓度、种类,模拟药物的给药方式、药物扩散路径、药物动力学、多元药物协同作用等的实验模型。该方法可通过简易的编程实现多种复杂的细胞药物实验模型。
96、(2)本发明的高通量药物筛选方法可以利用少量样本实现高通量药物筛选。相比传统手工点样技术,本发明所需细胞量少,通量高,自动化程度高,极大减少细胞培养成本、培养时间及人工成本,降低人工误差。
97、(3)相比于现有技术仅能通过手术切除组织提取细胞进行培养,本发明可以利用细胞量更少的活检样本进行细胞提取,极大减少细胞样本扩增所需时间,可缩短从病人身上得到肿瘤组织到得出药物筛选结果的时间,及时为后续治疗提供指导信息。
- 还没有人留言评论。精彩留言会获得点赞!