产麦角硫因重组谷氨酸棒杆菌及其构建方法与应用
本发明属于基因工程,具体涉及重组谷氨酸棒杆菌及其构建方法,以及该重组谷氨酸棒杆菌在制备麦角硫因中的应用。
背景技术:
1、麦角硫因(egt)是一种由组氨酸衍生而来的天然氨基酸衍生物,极易溶于水,是目前发现的唯一天然的2-硫代咪唑氨基酸。由于麦角硫因具有特殊的硫酮结构和较高的还原电位(-60mv),与其他含硫基类抗氧化剂(如:谷胱甘肽、半胱氨酸)的还原电位相比更高(-200mv至-320mv),因此具有更好的抗氧化性,且它在生理ph条件下和强碱溶液中能稳定存在,不易发生自氧化。麦角硫因具有抗炎、维持氧化还原平衡、解毒、抗辐射、美白及抗衰老等诸多功能,是一种多功能的细胞生理保护剂,具有广阔的应用前景。
2、目前在工业上,麦角硫因的制备方法包括天然生物提取法、化学合成法和微生物合成法。天然生物提取法主要是从天然蘑菇进行提取,但由于其中麦角硫因含量极低,制备的麦角硫因成本较高,分离纯化困难。化学合成法合成麦角硫因合成路线冗长,收率较低,且原料2-巯基咪唑很难制备,极易造成资源浪费。传统微生物合成方法常使用本身可以合成麦角硫因的微生物通过固态发酵获取,但该方法时间较久且产量很低。因此,为了提高麦角硫因生产的产量,急需一种高效生产麦角硫因的策略。
3、目前开发的生产麦角硫因的菌株及生产方法制约了麦角硫因的工业化生产和大规模的应用。在生产麦角硫因的宿主菌株主要是大肠杆菌;但大肠杆菌在生长过程中会分泌内毒素,而去除内毒素的分离过程繁琐,这严重限制了麦角硫因的应用。此外,现有的谷氨酸棒杆菌生产麦角硫因此仍存在一定的缺陷,例如,minhye kim等人构建了一株可产麦角硫因的重组谷氨酸棒杆菌,将此重组谷氨酸棒杆菌发酵36h,仅可使发酵液中麦角硫因的含量达264.4mg/l,产量过低;takashi hirasawa等人在谷氨酸棒杆菌中引进了不同的麦角硫因合成途径,使菌株麦角硫因的产量在摇瓶中发酵两周达到100mg/l,产量仍然较低,不足以大规模生产。
技术实现思路
1、针对现有技术在微生物发酵生产麦角硫因过程中所面临的内毒素分离困难、产量低、耗时较长等问题,本发明提出了一种重组谷氨酸棒杆菌,其在麦角硫因生产过程中无内毒素分泌,并通过合成生物学手段对麦角硫因合成所需的三个前体氨基酸合成途径进行了优化,从而进一步提升了麦角硫因的产量,具有较高的麦角硫因生产应用潜力。
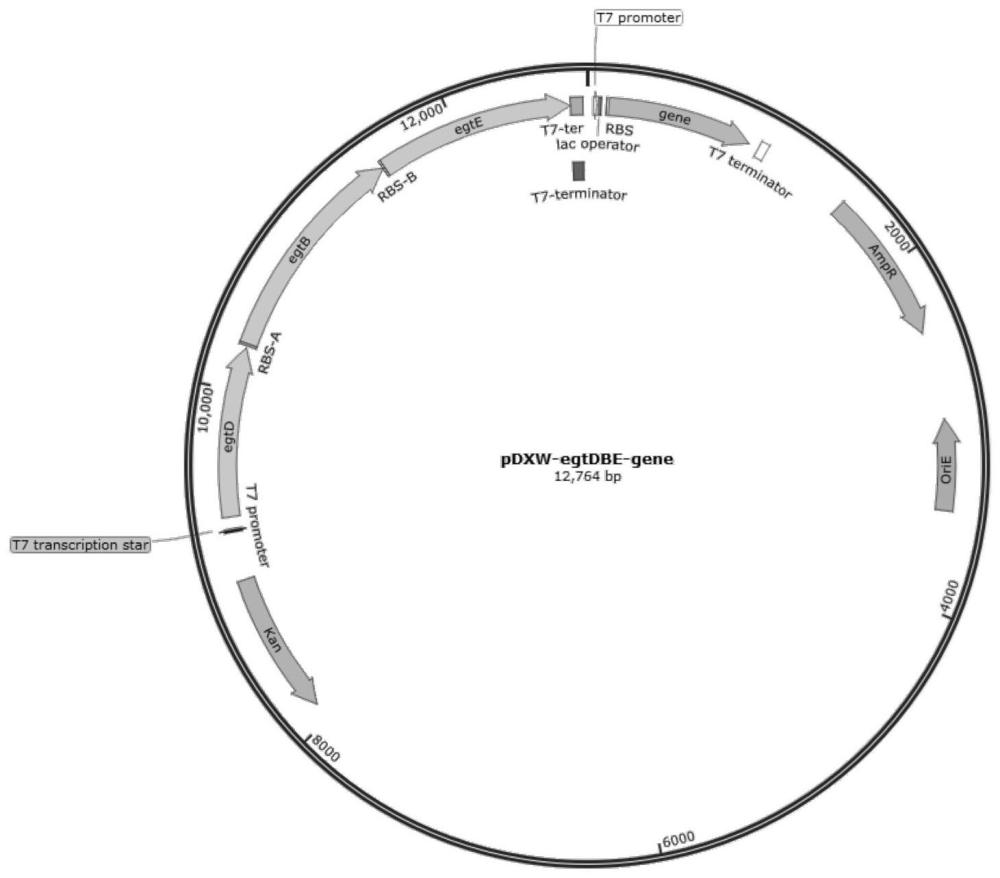
2、为实现上述目的,本发明提供了一种重组谷氨酸棒杆菌,其构建方法包括以下步骤:以谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032(de3)为底盘菌,异源表达mycolicibacterium smegmatis来源的egtd基因、egte基因,以及methylobacteriumpseudosasicola来源的egtb基因,和/或敲除底盘菌基因组中的thrb基因。
3、本发明还提供了所述的重组谷氨酸棒杆菌的构建方法,包括以下步骤:以谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032(de3)为底盘菌,异源表达mycolicibacteriumsmegmatis来源的egtd基因、egte基因,以及methylobacteriumpseudosasicola来源的egtb基因,和/或敲除底盘菌基因组中的thrb基因。作为食品安全级微生物,谷氨酸棒杆菌广泛应用于工业化的氨基酸生产,如谷氨酸、赖氨酸。相较于大肠杆菌,谷氨酸棒杆菌不会分泌内毒素,利用其生产的产品具有更广泛的应用市场。为增强谷氨酸棒杆菌对麦角硫因的表达,本发明将与麦角硫因合成相关的蛋白编码基因egtb、egtd、egte以基因簇的形式通过载体导入至底盘菌谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032(de3)中进行异源表达。其中,来源于mycolicibacterium smegmatis的egtd、egte基因分别编码合成sam依赖型组氨酸甲基转移酶、plp结合型c-s裂解酶,来源于methylobacteriumpseudosasicola的egtb基因编码合成单核非血红素铁酶。将上述的egtb、egtd、egte基因通过化学合成的方式形成麦角硫因合成基因簇egtdbe,并针对谷氨酸棒杆菌表达系统进行密码子优化。将优化后碱基序列如seqid no.1所示的基因簇egtdbe通过载体导入至底盘菌中进行过表达。进一步地,为提高合成前体s-腺苷甲硫氨酸的积累,本发明选择了敲除底盘菌基因组中的thrb基因,所述thrb基因的碱基序列优选如seq id no.6所示。
4、作为优选,其构建方法还包括以下步骤:强化底盘菌中麦角硫因前体的表达,所述麦角硫因前体选自半胱氨酸、s-腺苷甲硫氨酸、组氨酸中的至少一种。麦角硫因的合成过程中主要有三种前体,分别为半胱氨酸、s-腺苷甲硫氨酸和组氨酸。因此,为了提高三种氨基酸前体的积累,本发明对谷氨酸棒杆菌进行了代谢途径优化。针对组氨酸代谢,本发明选择了对谷氨酸棒杆菌来源的hisg基因突变体hisgy56m-t235p,和/或hise基因进行过表达。针对s-腺苷甲硫氨酸代谢,本发明还选择了对谷氨酸棒杆菌来源的metk基因进行过表达。针对半胱氨酸代谢,本发明选择了对大肠杆菌来源的突变基因cysem201r或谷氨酸棒杆菌来源的cyse基因、截短sera基因sera△197进行过表达。对上述三种前体代谢途径的改造,增加了麦角硫因前体的代谢流,进一步提高了麦角硫因的产量。
5、具体地,强化底盘菌中半胱氨酸表达的方法为:在底盘菌中过表达cysem201r基因、sera△197基因、cyse基因中的至少一种。其中,所述cysem201r基因来源于escherichia coli,其碱基序列优选如seq id no.2所示;所述sera△197基因来源于corynebacteriumglutamicum,其碱基序列优选如seq id no.3所示;所述cyse基因来源于corynebacteriumglutamicum,其碱基序列优选如seq id no.4所示。
6、具体地,强化底盘菌中s-腺苷甲硫氨酸表达的方法为:在底盘菌中过表达metk基因。其中,所述metk基因来源于corynebacterium glutamicum,其碱基序列优选如seq idno.5所示。
7、具体地,强化底盘菌中组氨酸表达的方法为:在底盘菌中过表达hisgy56m-t235p基因,和/或hise基因。其中,所述hisgy56m-t235p基因、hise基因来源于corynebacteriumglutamicum,其碱基序列分别优选如seq id no.7、seq id no.8所示。
8、作为优选,所述构建方法还包括以下步骤:将所述egtd基因、egte基因、egtb基因连接至同一过表达载体中。为进一步优化谷氨酸棒杆菌对麦角硫因的表达,本发明将与麦角硫因合成相关的蛋白编码基因egtb、egtd、egte通过化学合成的方式形成麦角硫因合成基因簇egtdbe,并针对谷氨酸棒杆菌表达系统进行密码子优化。将优化后碱基序列如seqid no.1所示的基因簇egtdbe通过载体导入至底盘菌中进行过表达。
9、本发明还提供了上述重组谷氨酸棒杆菌或上述方法构建得到的重组谷氨酸棒杆菌在制备麦角硫因、含有麦角硫因的产品、麦角硫因衍生物中的应用。作为优选,所述应用包括:以含可发酵糖的原料为底物,对所述重组谷氨酸棒杆菌进行发酵培养,制备得到麦角硫因;其中,发酵培养优选在25~30℃,ph 6.8-7.0,0.5~1mm iptg条件下进行的。诱导剂iptg优选在发酵5-8h时添加。为进一步提高麦角硫因产量,优选对所述重组谷氨酸棒杆菌进行补料发酵,即在所述发酵过程中流加碳源、氮源。最终证实,在一定培养条件下,所述重组谷氨酸棒杆菌经发酵后麦角硫因的产量可达355.4mg/l。
10、作为优选,所述可发酵糖选自糖蜜、葡萄糖、玉米浆、甘露糖、甘油中的至少一种。本发明设计得到的重组谷氨酸棒杆菌能够利用葡萄糖、糖蜜、玉米浆等廉价原料作为底物,在低盐的条件下连续发酵生产麦角硫因,大大降低原料成本,简化了发酵过程,有利于麦角硫因的工业化生产和大规模的应用。
11、本发明中术语“增强”指的是增加由对应的多核苷酸编码的酶的活性,可以通过基因的过表达或替换基因组上该基因的表达调控序列(启动子替换等)实现。
12、本发明中使用的载体可不被具体的限制,只要载体在宿主中是可复制的,可以使用本领域中已知的任何载体。
13、本发明的有益效果:本发明将与麦角硫因合成相关的蛋白编码基因egtb、egtd、egte以基因簇的形式通过载体导入至底盘菌谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032(de3)中进行异源表达,使其具备生产麦角硫因的能力,且谷氨酸棒杆菌在生产麦角硫因的过程中不会分泌内毒素,可代替大肠杆菌进行应用,生物安全性高,大大简化了后提取工艺。为进一步提高麦角硫因产量,本发明还对针对底盘菌中组氨酸、s-腺苷甲硫氨酸和半胱氨酸代谢进行改造,增加了麦角硫因前体的代谢流。其中,通过强化底盘菌中s-腺苷甲硫氨酸的表达,显著提高了所述重组谷氨酸棒杆菌麦角硫因的产量,达到了355.4mg/l。此外,本发明设计得到的重组谷氨酸棒杆菌能够利用廉价原料如糖蜜、葡萄糖、玉米浆等进行发酵,降低原料成本,简化发酵过程,有利于麦角硫因的工业化生产和大规模应用。
- 还没有人留言评论。精彩留言会获得点赞!